В/в введение
Перед началом лечения и перед началом каждого нового цикла лечения афлиберцептом рекомендуется проводить общий анализ крови с определением лейкоцитарной формулы.
При первом развитии тяжелой нейтропении следует рассмотреть вопрос о терапевтическом применении Г-КСФ, кроме этого, у пациентов, которые имеют повышенный риск развития нейтропенических осложнений, рекомендуется введение Г-КСФ для профилактики нейтропении.
Пациенты должны находиться под постоянным наблюдением на предмет выявления признаков и симптомов желудочно-кишечных и других тяжелых кровотечений. Нельзя вводить афлиберцепт пациентам с тяжелыми кровотечениями.
У пациентов, получавших лечение афлиберцептом, сообщалось о развитии сердечной недостаточности и снижении фракции выброса левого желудочка. Пациенты должны находиться под постоянным наблюдением на предмет выявления признаков вышеуказанных нарушений. У пациентов, у которых возникает сердечная недостаточность или снижение фракции выброса левого желудочка применение афлиберцепта необходимо прекратить.
Пациенты должны находиться под наблюдением на предмет выявления признаков и симптомов перфорации стенок ЖКТ. В случае развития перфорации стенок ЖКТ лечение афлиберцептом следует прекратить.
При развитии свищей лечение афлиберцептом следует прекратить.
Во время лечения афлиберцептом рекомендуется контролировать АД каждые 2 нед, включая контроль АД перед введением афлиберцепта, или чаще по клиническим показаниям во время лечения афлиберцептом. В случае повышения АД во время лечения афлиберцептом необходимо применять соответствующую антигипертензивную терапию и регулярно контролировать АД. При чрезмерном повышении АД лечение афлиберцептом следует приостановить до снижения АД до целевых значений, и в последующих циклах дозу афлиберцепта следует снизить. В случае развития гипертонического криза или гипертонической энцефалопатии введение афлиберцепта следует прекратить.
Следует соблюдать осторожность при введении афлиберцепта пациентам с клинически выраженной сердечно-сосудистой патологией, такой как ИБС и сердечная недостаточность.
В случае развития у пациента АТЭО лечение афлиберцептом следует прекратить.
Перед каждым введением афлиберцепта следует определять величину протеинурии с помощью индикаторной тест-полоски или путем определения соотношения белок/креатинин в моче для выявления развития или увеличения протеинурии. Пациентам с соотношением белок/креатинин в моче >1 следует провести определение количества белка в суточной моче.
При развитии нефротического синдрома или тромботической микроангиопатии лечение афлиберцептом следует прекратить.
В случае развития тяжелых реакций гиперчувствительности (бронхоспазм, одышка, ангионевротический отек, анафилаксия) следует прекратить лечение и начать соответствующую терапию, направленную на купирование этих реакций.
В случае развития умеренно выраженных реакции гиперчувствительности на афлиберцепт (гиперемия кожных покровов, сыпь, крапивница, зуд) следует временно приостановить лечение до разрешения реакции. В случае клинической необходимости для купирования этих реакций можно применять ГКС и/или антигистаминные препараты; в последующих циклах можно рассмотреть вопрос о проведении премедикации этими препаратами. При возобновлении лечения пациентов, имевших ранее реакции гиперчувствительности, следует соблюдать осторожность, т.к. у некоторых пациентов наблюдалось повторное развитие реакций гиперчувствительности, несмотря на их профилактику, включающую применение ГКС.
Применение афлиберцепта следует приостановить в течение не менее 4 недель после крупных хирургических вмешательств и до полного заживления операционной раны. При небольших хирургических вмешательствах, таких как установка центрального венозного катетера, биопсия, экстракция зубов, лечение афлиберцептом может быть начато/возобновлено после полного заживления операционной раны. У пациентов с нарушением заживления раны, потребовавшим медицинского вмешательства, применение афлиберцепта следует прервать.
СОЗЛ может проявляться изменением психического состояния, эпилептическими припадками, тошнотой, рвотой, головными болями и зрительными расстройствами. Диагноз СОЗЛ подтверждается исследованием головного мозга с помощью МРТ. У пациентов с СОЗЛ применение афлиберцепта следует прекратить.
У пациентов пожилого возраста (≥65 лет) имеется повышенный риск развития диареи, головокружения, астении, снижения массы тела и дегидратации. С целью минимизации риска такие пациенты нуждаются в тщательном медицинском наблюдении для раннего выявления и лечения признаков и симптомов диареи и дегидратации.
Пациенты, имеющие индекс общего состояния ≥2 баллов (по пятибалльной [0-4 балла] оценочной шкале ECOG [Восточной объединенной группы онкологов]) или имеющие серьезные сопутствующие заболевания, могут иметь более высокий риск неблагоприятного клинического исхода и нуждаются в тщательном медицинском наблюдении для раннего выявления клинического ухудшения.
Внутриглазное введение
Была выявлена связь интравитреальных инъекций, включая инъекции афлиберцепта, с развитием эндофтальмита, воспалительной реакции со стороны стекловидного тела, регматогенной отслойки сетчатки, разрыва сетчатки, ятрогенной травматической катаракты. При введении афлиберцепта всегда следует строго соблюдать соответствующую технику асептического проведения инъекций. Пациенты должны находиться под наблюдением в течение 1 недели после проведенной инъекции для выявления первых признаков воспаления и своевременного назначения необходимой терапии. Следует информировать пациентов о необходимости немедленно сообщать врачу о любых симптомах, свидетельствующих о развитии эндофтальмита или любой другой реакции, указанной выше.
Наблюдались случаи повышения внутриглазного давления в первые 60 мин после интравитреальных инъекций, включая инъекции афлиберцепта. При лечении пациентов с плохо контролируемой глаукомой необходимы особые меры предосторожности (не следует вводить афлиберцепт при внутриглазном давлении > 30 мм рт. ст.). Во всех случаях необходим контроль внутриглазного давления и перфузии диска зрительного нерва с назначением соответствующей состоянию терапии.
Поскольку афлиберцепт представляет собой белок с терапевтическими свойствами, существует вероятность проявления иммуногенности. Следует информировать пациентов о необходимости сообщать врачу о любых признаках или симптомах внутриглазного воспаления, таких как боль, светобоязнь или конъюнктивальная или перикорнеальная инъекция, которые могут быть клиническими проявлениями гиперчувствительности.
После интравитреальных инъекций ингибиторов VEGF были отмечены системные нежелательные явления, в т.ч. кровоизлияния вне органа зрения и тромбоэмболия артерий. Существует теоретический риск связи этих явлений с ингибированием VEGy. Имеются ограниченные данные по безопасности применения афлиберцепта пациентами с ОЦВС, ОВЦВС, ДМО или миопической ХНВ, имеющими в анамнезе инсульт, транзиторную ишемическую атаку или инфаркт миокарда за период в 6 мес до начала терапии. При лечении таких пациентов следует соблюдать осторожность.
При введении афлиберцепта одновременно в оба глаза возможно повышение его системной экспозиции, что, в свою очередь, повышает риск возникновения системных нежелательных явлений.
Факторы риска, связанные с нарушением целостности слоя пигментных клеток после анти-VEGF терапии «влажной» формы ВМД, включают обширную и/или выраженную отслойку пигментного эпителия сетчатки. В начале терапии афлиберцептом следует соблюдать осторожность при его назначении пациентам с факторами риска развития разрывов пигментного эпителия сетчатки.
Пациентам с регматогенной отслойкой сетчатки или с макулярными разрывами 3 или 4 стадии не рекомендуют терапию афлиберцептом.
В случае разрыва сетчатки инъекцию афлиберцепта следует отменить, лечение не следует возобновлять до адекватного восстановления разрыва.
От инъекции следует воздержаться на период 28 дней до планируемого и 28 дней после проведенного интраокулярного хирургического вмешательства.
При наличии у пациентов клинических признаков необратимых изменений зрительных функций на фоне ишемической ОЦВС и ОВЦВС терапия афлиберцептом не рекомендована.
Влияние на способность к управлению транспортными средствами и механизмами
При появлении у пациентов симптомов, оказывающих влияние на зрение и на способность к концентрации, а также замедляющие психомоторные реакции, следует рекомендовать пациентам воздерживаться от управления транспортными средствами и занятий другими потенциально опасными видами деятельности.
Эйлеа — интравитреальное введение препарата афлиберцепт в глаз
Заболевания сетчатки включают большое количество разнообразных патологий, но вне зависимости от вида все они требуют квалифицированной диагностики и своевременного лечения, ведь от этого зачастую зависит не только прогноз лечения, но и качество жизни больного в течение жизни.
Довольно часто возникновение патологий сетчатой оболочки глаза связано с нарушением ее кровоснабжения. Сосуды сетчатки могут стать широкими и полнокровными или наоборот суженными и плотными, в ней также могут образовываться функционально неполноценные аномальные сосуды. Для лечения болезней сетчатки специалисты применяют комплекс мероприятий, включающих, как правило, медикаментозные препараты, лазерные и хирургические методики. Одним из действенных методов лечения, позволяющих предотвратить прогрессирование болезни сетчатки и улучшить прогноз лечения, являются интравитреальные инъекции, при которых лекарственные вещества вводятся непосредственно в полость глаза, в толщу стекловидного тела.
Для интравитреального введения в офтальмологии применяют несколько групп препаратов. Эйлеа (Eylea) – один из медикаментозных препаратов, применяемых для консервативного лечения сосудистой патологии глаза, в частности, экссудативной формы макулодегенерации и диабетической макулопатии. Основное действующее вещество препарата, афлиберцепт, представляет собой сложный белок, в состав которого входят фрагменты рецепторов сосудистого эндотелиального фактора роста (VEGF) и иммуноглобулина G.
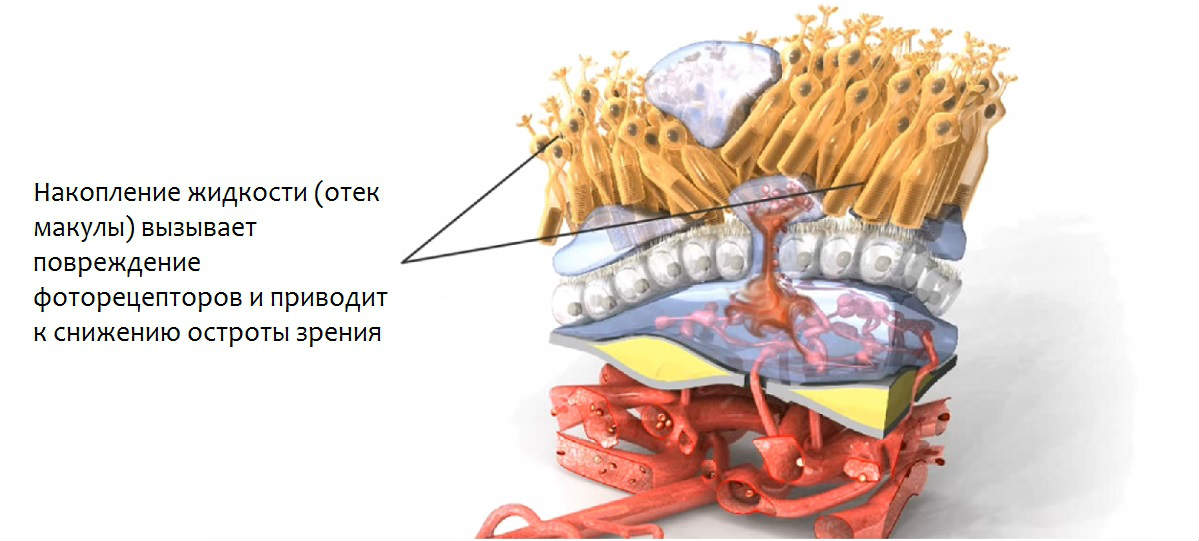
Экссудативная макулопатия (влажная форма ВМД) характеризуется образованием и избыточным разрастанием в сосудистой оболочке неполноценных сосудов, обладающих хрупкостью и повышенной проницаемостью. Просачивание сквозь них жидкости и крови приводит к отеку и кровоизлияниям в центральной части макулы, что впоследствии вызывает снижение остроты зрения.
Механизм действия афлиберцепта обусловлен его строением. Фрагменты рецепторов, которые входят в состав данного лекарства, являются более «привлекательными» для белков VEGF, отвечающих за рост аномальных сосудов в сосудистой оболочке глаза, чем естественные рецепторы тканей глаза. В связи с этим препарат Эйлеа, введенный в полость глаза, работает как растворимая «ловушка» для VEGF, перехватывая их и блокируя активацию рецепторов, отвечающих за неоваскуляризацию. Таким образом, афлиберцепт блокирует процесс связывания белка, отвечающего за неоваскуляризацию, с соответствующими рецепторами, и предотвращает процесс образования дефектных кровеносных сосудов, являющийся основой при развитии пролиферативных сосудистых заболеваний глаз (экссудативной ВМД, диабетической ретинопатии и т.п.).
Видео о механизме действия препарата
По сравнению с другими лекарственными средствами из группы блокаторов VEGF-рецепторов (например с ранибизумабом, торговое название — «Луцентис»), Эйлеа отличается более высокой эффективностью, что было доказано в ходе нескольких независимых научных исследований. Наряду с высокой результативностью применения, препарат отличается лучшей безопасностью и переносимостью и практически не имеет неблагоприятного воздействия на организм.
Основными показаниями к применению препарата Эйлеа являются заболевания глаз, сопровождающиеся неоваскуляризацией и макулярным отеком (экссудативная форма ВМД, диабетическая ретинопатия, миопическая хориодальная неоваскуляризация, окклюзия центральной вены сетчатки или ее ветвей). Препарат не применяют для лечения пациентов младше 18 и старше 75 лет, в период беременности и лактации, а также в случае выявления внутриглазной или периокулярной инфекции.
Эйлеа выпускается в виде готового к введению раствора во флаконе с прилагающейся к нему фильтровальной иглой. Один флакон предназначен для однократного введения. Во время выполнения интравитреальной инъекции необходимо строго соблюдать определенные правила. Вводить препарат могут только квалифицированные врачи офтальмологи, которые имеют опыт выполнения подобных манипуляций. Техника введения препарата в полость глаза детально описана в инструкции.
За одну процедуру можно выполнять только одну инъекцию в один глаз. В течение часа после выполнения укола врач должен проконтролировать уровень внутриглазного давления, так как афлиберцепт может вызывать повышение ВГД.
Видео введения из операционной
Препарат вводится в дозе 2 мг (50 мкл) однократно, в виде трех инъекций с интервалом один месяц, после чего переходят на введение каждые два месяца. Через 12 месяцев от начала лечения по результатам диагностики глаз интервалы между уколами могут быть постепенно увеличены. Режим введения и продолжительность курса лечения определяет врач по результатам проверки остроты зрения и состояния глазного дна.
Основные побочные эффекты препарата Эйлеа связаны с необходимостью введения его в полость стекловидного тела. Серьезные побочные эффекты интраокулярной инъекции возникают очень редко, но о них следует предупредить пациента до введения (эндофтальмит, отслойка сетчатки, слепота, вторичная катаракта, гемофтальм, офтальмогипертензия). Примерно в 5% случаев введение препарата в полость глаза может сопровождаться болью в глазу, снижением остроты зрения, кровоизлияниями под конъюнктиву в месте укола, развитием вторичной катаракты, появлением помутнений в стекловидном теле, повышением ВГД, аллергическими проявлениями.
Несмотря на то, что опыт применения препарата Эйлеа, по сравнению с другими офтальмологическими препаратами, относительно недолог, он завоевал доверие офтальмологов во всем мире и в настоящее время рекомендован к применению ведущими официальными инстанциями. Препарат дает шанс на излечение многим тысячам пациентов, ведь он демонстрирует положительную динамику у 95% пациентов уже после первого введения.
Специалисты «Центра сетчатки глаза» в совершенстве владеют техникой введения препарата Эйлеа. Обращайтесь в нашу клинику, и мы обеспечим вам современную диагностику и эффективное лечение самых сложных сосудистых заболеваний глаз, которое уже испытали на себе многие наши пациенты.
Стоимость процедуры
| Интравитреальное введение препарата «Эйлеа» (1 глаз) | 96 000 рублей |
ВНИМАНИЕ! Точную стоимость лечения можно будет сказать только после очной коснультации, когда будет определено состояние глаз пациента и составлен план лечения.
Смотреть официальную инструкцию к Эйлеа (PDF)
Возрастная макулярная дегенерация (ВМД) является лидирующей причиной тяжелой потери зрения среди лиц старше 55 лет в Западной Европе и США [11]. В России заболеваемость составляет более 15 чел. на 1000 населения. По данным ВОЗ число людей старше 60 лет к 2050 г. увеличится втрое [1, 5]. Ежегодный риск билатерального вовлечения глаз оценивается в 12% в течение 5 лет [2]. Все эти факторы позволяют предполагать дальнейший рост числа пациентов.
В патогенезе «влажной» формы ВМД ведущая роль принадлежит генетическим факторам, процессам старения сетчатки и мембраны Бруха под действием оксидативного стресса. В результате увеличивается продукция факторов роста, таких как фактор роста эндотелия сосудов (VEGF), способствующих развитию и прогрессированию хориоидальной неоваскуляризации (ХНВ) [4]. Считается также, что плацентарный фактор роста (PGF), являющийся также представителем семейства VEGF, играет важную роль в патологическом ангиогенезе и в обеспечении миграции клеток воспаления в пораженную сетчатку, приводящей к высвобождению VEGF и других медиаторов воспаления и, соответственно, к продолжению цикла ангиогенеза и воспаления [7, 10].
Тяжесть поражения центральных отделов сетчатки при развитии ВМД может быть различной: от перераспределения пигмента и появления друзоподобных отложений до экссудативно-гемморагической отслойки пигментного эпителия сетчатки (ПЭС) и нейроэпителия сетчатки (НЭС) с последующим развитием субретинальной фиброваскулярной мембраны [1, 5, 8]. Серозная отслойка ПЭС, если она диагностирована у лиц старше 50 лет, даже при отсутствии других изменений глазного дна, рассматривается как возможное проявление влажной формы ВМД [2]. При отсутствии прилегания сетчатки у 61,9% пациентов в течение 1 года формируется неоваскулярная мембрана с резким снижением зрения [1, 5, 6]. При длительно существующей отслойке ПЭС развивается отрыв листка пигментного эпителия – фактор риска потери центрального зрения, поэтому необходима разработка эффективных методов борьбы с отслойкой ПЭС [3].
Прорывом в лечении «влажной» формы ВМД явилось внедрение в клиническую практику ингибиторов фактора роста эндотелия сосудов (анти-VEGF-препаратов) [4].
Афлиберцепт (Эйлеа®) – раствор для интравитреальных инъекций, представляющий собой растворимый гибридный рецептор-ловушку, связывающийся со всеми изоформами VEGF-A и PGF с более высокой степенью сродства, чем естественные рецепторы VEGF, и образующий стабильный инертный комплекс с VEGF в соотношении 1:1 [9, 12].
Цель
На основании клинико-функциональных исследований изучить эффективность лечения пациентов с отслойкой ПЭС при «влажной» форме ВМД при помощи интравитреального введения афлиберцепта на примерах клинических случаев.
Материал и методы
Клинический случай № 1
Пациент Б., 65 лет (муж.). Клинический диагноз: осложненная неполная катаракта левого глаза. Возрастная макулярная дегенерация (отслойка ПЭС) левого глаза».
Сопутствующий диагноз: артериальная гипертензия II стадии, II степени, риск III. Пароксизмальная форма фибрилляции – трепетания предсердий, нормосистолический вариант, CHADS-VASC – 1б. HAS – BLED – 1. ХСН I, ФК I (NYHA).
Отмечает постепенное снижение зрения на левый глаз в течение 7 лет. Пациент находится под наблюдением терапевта и кардиолога, принимает гипотензивные препараты.
Жалобы при первом обращении в сентябре 2009 г. на снижение зрения, искажение линий, Vis OS=0,1. По данным оптической когерентной томографии (ОКТ) выявлена отслойка нейроэпителия сетчатки (НЭС), признаки центральной серозной хориоретинопатии (ЦСХРП), и было рекомендовано наблюдение (рис. 1). Проводилась флюоресцентная ангиография (ФАГ), точек просачивания обнаружено не было, лазерная коагуляция сетчатки не выполнялась.
При очередном визите в мае 2010 г. Vis OS=1,0, по ОКТ признаков отслойки НЭС не выявлено. Повторное снижение зрения, искажение линий появилось в ноябре 2010 г., Vis OS=0,1. По ОКТ – отслойка НЭС, диагностирована влажная форма ВМД, выполнена ИВВ (интравитреальное введение) ранибизумаба № 1 (рис. 2).
Наблюдалось отсутствие активности ВМД, сохранение Vis OS 0,8-0,9 до ноября 2011 г. (рис. 3, 4).
В течение последующих 5 лет наблюдения у пациента выявлялись рецидивы отслойки НЭС и снижение остроты зрения до 0,6. Было выполнено более 30 ИВВ ранибизумаба, после которых в течение месяца наблюдалось повышение остроты зрения и исчезновение отслойки НЭС. При очередном визите в мае 2016 г. на фоне рецидива отслойки НЭС и снижения остроты зрения до 0,2 было рекомендовано оперативное лечение катаракты и повторное введение ранибизумаба (рис. 5). После оперативного лечения катаракты левого глаза острота зрения составила 0,4 н/к. В июле 2016 г. рецидив отслойки ПЭС и НЭС.
Таким образом, анатомические результаты на фоне терапии ранибизумабом коррелировали с функциональным улучшением. Регулярное наблюдение позволило поддерживать улучшение остроты зрения.
Учитывая далеко зашедший дегенеративный процесс (ригидная отслойка пигментного эпителия, резистентность к терапии ранибизумабом), было принято решение ИВВ афлиберцепта 08.08.2016 г. (рис. 6).
В течение двух месяцев после ИВВ афлиберцепта рецидива отслойки НЭС и ПЭС не наблюдается, острота зрения левого глаза 0,7 (рис. 7).
В данном клиническом примере в течение длительного времени наблюдения пациента были выполнены многочисленные интравитреальные введения ранибизумаба, которые приводили к анатомическому и функциональному улучшению длительностью около месяца. В связи с наблюдающейся устойчивостью к терапии ранибизумабом и рецидивом отслойки ПЭС было принято решение о смене препарата. При переводе пациента на терапию интравитреальными введениями афлиберцепта (Эйлеа®) уже после первой инъекции наблюдалось значительное улучшение остроты зрения и отсутствие рецидива отслойки ПЭС и НЭС. Причем данное улучшение сохранялось более месяца после ИВВ афлиберцепта
Клинический случай № 2
Пациент М., 54 года (муж.). Клинический диагноз: возрастная макулярная дегенерация, отслойка пигментного эпителия сетчатки обоих глаз.
Жалобы на снижение зрения на оба глаза (искажение линий) в течение трех лет. В 2014-2016 гг. трижды ИВВ ранибизумаба в правый и левый глаз. Проводилась ФАГ, точек просачивания обнаружено не было, лазерная коагуляция сетчатки не выполнялась.
Тип отслойки пигментного эпителия – серозная. Улучшение остроты зрения после первой инъекции ингибитора ангиогенеза (с 0,7 до 1,0 на оба глаза), но полного разрешения отслойки ПЭС не наблюдалось. Однако сохранение отслойки ПЭС служило показанием к повторным инъекциям ранибизумаба (рис. 8, 9).
Таким образом, в данном наблюдении анатомические результаты не коррелировали с функциональными.
Сохранение отслойки ПЭС на фоне терапии ранибизумабом послужило основанием к назначению ИВВ афлиберцепта. После однократной инъекции наблюдалась положительная динамика в течение месяца (рис. 10-13).
У данного пациента после ИВВ ранибизумаба сохранялись отслойки ПЭС и НЭС, несмотря на улучшение остроты зрения. После смены терапии – переход на ИВВ афлиберцепта – наблюдалась положительная динамика – уплощение отслоек ПЭС и полное исчезновение отслойки НЭС, которое зафиксировано на следующий день после введения афлиберцепта. Для того чтобы сделать окончательные выводы об эффективности препарата, необходим более длительный период наблюдения пациентов.
Клинический случай № 3
Пациентка Р., 90 лет (жен.). Клинический диагноз: возрастная макулярная дегенерация, влажная форма, субретинальное кровоизлияние левого глаза. Артифакия обоих глаз.
Пациентка предъявляла жалобы на снижение зрения на левый глаз в течение 10 лет постепенно, резкое ухудшение около недели. Факоэмульсификация катаракты с имплантацией интраокулярной линзы в 2008 г. на оба глаза. Периодически проходила курсы консервативного лечения в условиях стационара 1 раз в год («сосудистая» терапия: Пирацетам, Ретиналамин, Кортексин). Vis OS при обращении 0,02 н/к эксц.
16.08.2016 г. выполнена ИВВ афлиберцепта, через 7 дней Vis OS=0,2. По данным ОКТ положительная динамика – уменьшение площади макулярного отека, количества интра- и субретинальной жидкости, уплощение отслоек ПЭС и НЭС (рис. 14-17).
В данном клиническом примере анатомический результат коррелирует с функциональным. Благоприятный эффект от воздействия афлиберцепта наблюдался на вторые сутки после интравитреальной инъекции – уменьшение высоты отека НЭС и количества интра- и субретинальной жидкости, повышение ОЗ (Vis=0,08 н/к эксц.). В дальнейшем по данным ОКТ отмечалась также положительная динамика – уменьшение площади макулярного отека, количества интра- и субретинальной жидкости, уплощение отслоек ПЭС и НЭС и повышение ОЗ – Vis=0,2 (в 10 раз).
Заключение
1. Афлиберцепт (Эйлеа®) продемонстрировал свою клиническую эффективность во всех представленных случаях и даже при ранее безуспешном лечении ранибизумабом. При этом наблюдалось улучшение не только анатомических, но и функциональных показателей уже после первой инъекции афлиберцепта.
2. Два клинических примера показали, что афлиберцепт является эффективной заменой ранибизумабу и способствует значительному улучшению остроты зрения и анатомических показателей (отсутствию рецидивов отслойки ПЭС и НЭС).
3. Для оценки отдаленных результатов терапии требуется дальнейшее наблюдение.
Интравитреальное введение препарата Эйлеа
Для жителей Ярославля, Ярославской области, Вологды и Вологодской области интравитреальное введение препаратов Эйлеа и Визкью бесплатно!
Для прохождения операции в нашей клинике, вам нужно позвонить в наш центр по телефону +7(499)110-4302 и записаться у администратора, который:
Интравитреальное введение Эйлеа способствует прекращению ухудшения остроты зрения, а в некоторых случаях дает возможность больному лучше видеть. В целом, данный препарат является одним из наиболее эффективных средств для лечения влажных форм макулодистрофии, диабетической ретринопатии, а также при тромбозах центральной вены сетчатки глаза.
Уникальная возможность! Бесплатное введение препарата Эйлеа по полису ОМС для жителей Ярославской и Вологодской областей!
Многоканальный телефон для записи +7(499)110-4302.
- Что такое Эйлеа
- Показания
- Подготовка к процедуре
- Как проходит процедура введения Эйлеа в глаз
- Реабилитационный период
- Что можно ожидать от лечения Эйлеа
- Введение препарата Эйлеа по полису ОМС для пациентов из Вологодской области
Что такое Эйлеа
Афлиберцепт – препарат, более известный под названием Эйлеа, является одним из действенных лекарств, используемых в офтальмологии для улучшения остроты зрения. Механизм воздействия активных компонентов этого средства несколько отличается от аналогов. Активные компоненты Эйлеа являются своего рода ловушкой для рецепторов VEFF, и с большей эффективностью связываются с ними.
Как отмечают специалисты, введение Эйлеа обладает рядом преимуществ:
- инъекция быстрая и безболезненная;
- терапия данным препаратом не требует госпитализации;
- пролонгированный срок воздействия, благодаря чему инъекции можно проводить реже.
Показания
Эйлеа (Афлиберцепт) является препаратом, который относится к группе ингибиторов ангиогенеза, которые используются для повышения эффективности терапии различных патологий глаз. Интравитреальное введение Эйлеа может быть назначено при наличии следующих показаний:
- снижение остроты зрения по причине ранее диагностированной возрастной макулярной дегенерации (ВМД);
- диагностирован макулярный отек, спровоцированный окклюзией сосудов сетчатки;
- макулярный отек диабетической формы;
- миопическая хориоидальная неоваскуляризация.
Особенно высоких результатов при лечении позволяют добиться уникальные методики сочетанной терапии Эйлеа с лазерной микрохирургией или лазерной терапией сетчатки, разработанные в клинике «Реалайз».
Подготовка к процедуре
- Предоперационное офтальмологическое обследование, после которого врач-офтальмолог определяет диагноз и тактику лечения, подтверждает наличие медицинских показаний к инъекции, отсутствие противопоказаний, выдает направление на операцию.
Сообщите лечащему врачу о приеме любых лекарственных препаратов, чтобы избежать появления побочных эффектов. - Перед введением препарата Эйлеа необходимо пройти общее обследование, которое включает:
- анализ крови клинический + СОЭ + сахар, свертываемость;
- анализ крови на ВИЧ, RW, HbsAg, гепатит С;
- анализ крови: группа, резус-фактор;
- общий анализ мочи;
- консультацию ЛОР-врача с рентгенограммой придаточных пазух;
- ЭКГ;
- рентгенограмму (флюорографию) легких;
- консультацию терапевта;
- консультацию стоматолога;
- консультация эндокринолога (при сахарном диабете);
- для женщин: консультация гинеколога (исключить гистологию).
В течение 3 дней до введения препарата и 10 дней после инъекции вам потребуется закапывать глазные капли – это нужно для того, чтобы предотвратить развитии инфекции.
Как проходит процедура введения Эйлеа в глаз
Процедура может проводится как амбулаторно, так и в стационаре. Это зависит от сопутствующих заболеваний и состояния пациента. Как правило, пребывания в стационаре не требуется, а сама процедура занимает 10-15 минут.
«Реалайз» – единственная негосударственная офтальмологическая клиника в Ярославской области со стационарным отделением круглосуточного пребывания. В случае необходимости круглосуточного наблюдения за вашим состоянием, мы имеем все необходимые для этого условия.
Применяется местная анестезия в виде капель. Непосредственно во время процедуры при помощи специальной тонкой иглы офтальмологический раствор в количестве 2 мг вводится в полость стекловидного тела. Манипуляция считается микрохирургической операцией, не занимает много времени – до 15 минут с учетом применения анестезии и антибактериальной обработки.
Участок глаза, в который была произведена инъекция Эйлеа, скорее всего, покраснеет. Это нормально – покраснение пройдет в течение нескольких дней. В поле зрения может появиться некоторое количество «мушек».
Работающим выдаем листок нетрудоспособности (больничный лист).
Введение препарата в стекловидное тело часто вызывает опасения у пациентов, однако большинство больных после процедуры говорят, что инъекции практически безболезненны и не так страшны, как кажется сначала.
В центре «Реалайз» работают опытные офтальмологи, выполнившие тысячи подобных операций.
Реабилитационный период
В течение 10 дней после инъекции необходимо использовать антибактериальные капли, чтобы снизить вероятность инфекции. Лечащий врач сообщит схему применения таких капель, дату следующей инъекции или контрольного осмотра (в зависимости от назначенной тактики лечения).
Что можно ожидать от лечения Эйлеа
Согласно статистике и отзывам пациентов, в подавляющем большинстве случаев терапия с использованием раствора для инъекций Эйлеа, не только способствует остановке постоянного снижения зрения, но и его видимому улучшению.
Некоторые пациенты отмечают улучшение зрения уже через неделю после инъекции.
Немедленного результат может и не быть, однако, важно продолжать регулярные инъекции. Улучшение может наступить после нескольких инъекций.
Операция проводится в филиале центра в Ярославле.
Для прохождения бесплатной операции по интравитреальному введению препарата Эйлеа в нашем центре, вам нужно позвонить по телефону +7(499)110-4302 и записаться у администратора, который:
- подробно ответит на все ваши вопросы;
- запишет вас к офтальмологу нашего центра в Ярославле, Вологде или Череповце, где вы пройдете предварительное предоперационное обследование и получите направление на операцию в наш центр, а также список анализов.
Введение препарата Эйлеа по полису ОМС для пациентов из Вологодской области
Для вашего удобства мы набираем группу пациентов в Вологде и Череповце и организуем трансфер на комфортабельном автобусе в Ярославль на операцию и после окончания лечения обратно.
Свяжитесь с нами по телефону +7(499)110-4302, администратор ответит на все вопросы, запишет вас к офтальмологу нашего центра в Вологде или Череповце, где вы пройдете предварительное предоперационное обследование, предложит дату и время к которому вам необходимо будет подойти к месту сбора группы, где вас будет ожидать микроавтобус.
Обращаем внимание — транспортные расходы не входят в тариф ОМС и оплачивается пациентом самостоятельно.
Записаться на консультацию >>>
Афлиберцепт (Эйлеа)
Уважаемые пациенты и их родственники! Информируем Вас о государственной регистрации лекарственного препарата Эйлеа (афлиберцепт), раствор для внутриглазного введения, 40 мг/мл (РУ ЛП-003544 от 29.03.16.).
Эйлеа — Афлиберцепт – инновационный препарат из группы ингибиторов ангиогенеза, специально разработанный для лечения заболеваний сетчатки, сопровождающихся патологической неоваскуляризацией вследствие повышенной экспрессии сосудистого эндотелиального фактора роста. Клиническая эффективность и безопасность препарата были доказаны в ряде крупных международных многоцентровых рандомизированных контролируемых испытаний.
Показания к применению Афлиберцепта (Эйлеа):
1. Возрастная макулярная дегенерация, «влажная» форма макулодистрофии. При лечении влажной формы макулярной дегенерации сетчатки с субретинальной неоваскуляризацией вероятность сохранения остроты зрения согласно результатам исследований VIEW-1 и VIEW-2 при назначении препарата Эйлеа составляет 95%, среднее повышение остроты зрения составляет по шкале ETDRS 8 букв.
2. Диабетический макулярный отек. Результаты клинических исследований VISTA-DME и VIVID-DME свидетельствуют, что препарат Эйлеа (Афлиберцепт) обладает значительно большей клинической эффективностью по сравнению с лазерной фотокоагуляцией сетчатки, являющейся «золотым стандартом» лечения отечной формы диабетической макулопатии. При назначении препарата Эйлеа пациентам, у которых диагностирован диабетический макулярный отек, среднее увеличение остроты зрения по шкале ETDRS было больше на 10 букв, а вероятность значительного улучшения остроты зрения была выше в 4 раза по сравнению с результатами контрольной группы.
3. Окклюзия вен сетчатки (тромбоз центральной вены сетчатки или ее ветвей). В ходе клинических исследований COPERNICUS и GALI-LEO назначение препарата Эйлеа в 3,5 раза повышало вероятность восстановления остроты зрения у пациентов с окклюзией центральной вены сетчатки по сравнению со стандартным подходом. В исследовании VIBRANT назначение препарата Эйлеа в 2 раза повышало вероятность увеличения остроты зрения пациентов, у которых был диагностирован тромбоз ветви центральной вены сетчатки, по сравнению с лазерной фотокоагуляцией.
Эйлеа (Афлиберцепт). Отзывы и рекомендации
Препарат Эйлеа включен в рекомендации Американской академии офтальмологии и рекомендован к применению Национальным институтом совершенства медицинской помощи Великобритании. Появление препарата Эйлеа в Российской Федерации значительно расширяет возможности перечисленных выше заболеваний, что позволяет усовершенствовать медицинскую помощь пациентам с ними и повысить качество их жизни.
Эйлеа (Афлиберцепт) за короткое время использования в клинической практике уже получил многочисленные положительные отзывы как со стороны практикующих офтальмологов, так и со стороны пациентов, которым от реально помог. И если Вам уже проводились инъекции Афлиберцепта, мы настоятельно просим Вас оставить отзыв о препарате на странице сайта https://eyesurgerycenter.ru/otzyvy-i-predlozheniya. Возможно именно Ваш опыт применения препарата Эйлеа и отзывы помогут другим пациентам сделать правильный выбор.
С февраля нынешнего года Микрохирургия глаза. Клиника им. Святослава Федорова при поддержке Фонда содействия развитию передовых медицинских технологий им. Святослава Федорова оказывает специализированную офтальмологическую помощь с использованием препарата Эйлеа всем льготным категориям пациентов, являющихся гражданами Российской Федерации, на специальных условиях.
Более подробную информацию об офтальмологическом препарате Эйлеа (Афлиберцепт), а также о необходимости проведения лечения и показаниях к нему конкретно в Вашем случае, Вы всегда сможете получить на консультации в Клинике.
С уважением, ведущий хирург клиники Миронов Андрей Викторович
Эйлеа®
МНН: Афлиберцепт
Производитель: Регенерон Фармасьютикалс, Инк.
Анатомо-терапевтическо-химическая классификация: Афлиберцепт
Номер регистрации в РК:
№ РК-ЛС-5№020045
Информация о регистрации в РК:
02.10.2018 — бессрочно
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
319 827.2 KZT
- Скачать инструкцию медикамента
Торговое название
Эйлеа®
Международное непатентованное название
Афлиберцепт
Лекарственная форма
Раствор для инъекций, 40 мг/мл
Состав
1 мл препарата содержит
активное вещество — афлиберцепта 40 мг,
вспомогательные вещества: натрия хлорид, натрия дигидрофосфат моногидрат, натрия гидрофосфат гептагидрат, сахароза, полисорбат 20, вода для инъекций.
Описание
Прозрачный, слегка опалесцирующий раствор.
Фармакотерапевтическая группа
Препараты для лечения заболеваний глаз. Средства для лечения сосудистых расстройств окологлазного пространства. Антинеоваскулярные средства. Афлиберцепт.
Код АТХ S01LA05
Фармакологические свойства
Фармакокинетика
Абсорбция / распределение
После интравитреального введения афлиберцепт медленно проникает в системный кровоток и находится, главным образом в виде неактивного стабильного комплекса с VEGF (фактор роста эндотелия сосудов), однако только «свободный афлиберцепт» может связываться с эндогенным VEGF.
Максимальная концентрация свободного афлиберцепта в плазме крови (системный Cmax) низкая и в среднем составляет приблизительно 0,02 микрограмма/мл (в диапазоне от 0 до 0,054) в течение 1-3 дней после интравитреального введения 2 мг, а через две недели после введения дозы не обнаруживается в плазме. При интравитреальном введении каждые 4 недели афлиберцепт не кумулирует в плазме.
Предполагается, что после интравитреального введения пациентам 2 мг препарата, средняя максимальная концентрация свободного афлиберцепта в плазме крови более чем в 100 раз ниже концентрации афлиберцепта, необходимой для связывания половины максимального уровня системного VEGF. Таким образом, системный фармакодинамический эффект (такой как, изменения АД) маловероятен.
Экскреция
Свободный афлиберцепт связывается с VEGF для формирования стабильного инертного комплекса. Как и в случае с другими крупными белками предполагается, что свободный и связанный афлиберцепт будет выводиться путем протеолитического катаболизма.
Фармакодинамика
Афлиберцепт представляет собой рекомбинантный гибридный белок, состоящий из фрагментов внеклеточных доменов рецепторов VEGF (фактора роста эндотелия сосудов) 1 и 2, соединенных с Fc-фрагментом человеческого IgG1.
Афлиберцепт вырабатывается в клетках K1 яичника китайского хомячка (CHO/ЯКХ) путем рекомбинантной ДНК-технологии.
Механизм действия
Эндотелиальный сосудистый фактор роста А (VEGF-A) и плацентарный фактор роста (PIGF) относятся к семейству ангиогенных факторов, которые могут действовать в качестве активного митогенного, хемотаксического фактора и фактора сосудистой проницаемости для эндотелиальных клеток. VEGF действует посредством тирозинкиназы двух рецепторов, VEGFR-1 и VEGFR-2, которые присутствуют на поверхности эндотелиальных клеток. PIGF связывается только с фактором VEGFR-1, который также присутствует на поверхности лейкоцитов. Излишняя активация рецепторов VEGF-А может привести к патологической неоваскуляризации и повышенной проницаемости сосудов.
Возможен синергизм между фактором PIGF и VEGF-A в этих процессах, также известно, что фактор PIGF способствует лейкоцитарной инфильтрации и сосудистому воспалению. Множество глазных болезней связаны с патологической неоваскуляризацией, сосудистым пропотеванием, которые могут привести к утолщению или отеку сетчатки, что, как полагают, способствует потере зрения.
Афлиберцепт действует как растворимый рецептор-«ловушка», который связывает все изоформы VEGF-A и PIGF с большей аффинностью, чем их природные рецепторы, и таким образом ингибирует связывание и активацию нативных рецепторов VEGF. Константа равновесной диссоциации (КD) для связывания афлиберцепта, с человеческим VEGF-A165 составляет 0,5 промилле, а для человеческого VEGF-A121 составляет 0,36 промилле. Константа KD для связывания с человеческим PIGF-2 составляет 39 промилле.
Исследования на животных показали, что афлиберцепт может предотвращать патологическую неоваскуляризацию и пропотевание жидкости из сосудов на ряде различных моделей глазных болезней. Например, интравитреальное введение афлиберцепта обезьянам предотвращало развитие выраженной хориоидальной неоваскуляризации ( ХНВ/CNV) после повреждения лазерным лучом, и способствовало уменьшению пропотевания жидкости через сосуды на установленных участках патологической хориоидальной неоваскуляризации.
Фармакодинамические эффекты
Неоваскулярная влажная возрастная макулярная дегенерация (влажная ВМД) характеризуется патологической хориоидальной неоваскуляризацией (ХНВ). Пропотевание крови или жидкости из участков ХНВ может вызывать отек сетчатки и/или суб- /интраретинальное кровоизлияние, приводящее к потере остроты зрения.
У пациентов, получающих препарат Эйлеа® (одна инъекция в месяц в течение трех первых месяцев, с последующей одной инъекцией каждые 2 месяца), отмечалось уменьшение толщины сетчатки вскоре после начала лечения и уменьшение среднего размера патологического участка ХНВ, что соответствует результатам, полученным у пациентов на фоне ежемесячного введения ранибизумаба в дозе 0,5 мг.
Макулярный отек вследствие окклюзии центральной вены сетчатки или ее ветвей
При окклюзии центральной вены сетчатки или ее ветвей возникает ишемия сетчатки, провоцирующая высвобождение VEGF, которые в свою очередь дестабилизируют плотные соединения и способствуют пролиферации эндотелиальных клеток. Повышение активности VEGF приводит к нарушению гематоретинального барьера, и такая повышенная сосудистая проницаемость приводит к отеку сетчатки, стимулированию роста эндотелиальных клеток и неоваскуляризации.
У пациентов, получающих лечение Эйлеа®, (одна инъекция раз в месяц на протяжении шести месяцев) наблюдалась постоянная, быстрая и устойчивая ответная реакция в отношении морфологии ( толщина центральной зоны сетчатки (ТЦЗС) по данным ОКТ (оптической когерентной томографии). Улучшение среднего показателя ТЦЗС сохранялось на протяжении 24 недель.
Диабетический макулярный отек
Диабетический макулярный отек характеризуется повышенной проницаемостью сосудов и повреждением капилляров сетчатки, что может вызвать потерю остроты зрения.
У пациентов, получавших препарат Эйлеа®, вскоре после начала лечения наблюдался быстрый и устойчивый морфологический ответ (толщина центральной зоны сетчатки [ТЦЗС]), согласно оценке данных ОКТ. Среднее изменение в ТЦЗС от исходного уровня значения к 52 неделе было статистически значимым в пользу Эйлеа®.
Миопическая хориоидальная неоваскуляризация
Миопическая хориоидальная неоваскуляризация является частой причиной потери зрения у взрослых с патологической миопией.
Она развивается как ранозаживляющий механизм вследствие разрыва мембраны Бруха и представляет собой наиболее угрожающее зрению событие при патологической миопии.
Показания к применению
— неоваскулярная (влажная) возрастная макулярная дегенерация (ВМД)
— нарушение зрения вследствие макулярного отека, обусловленного окклюзией вен сетчатки (центральной вены сетчатки (ОЦВС) и ее ветвей (ОВВС))
— нарушение зрения вследствие диабетического макулярного отека (ДМО) — нарушение зрения вследствие миопической хориоидальной неоваскуляризации (миопической ХНВ)
Способ применения и дозы
Эйлеа® предназначен только для интравитреального введения.
Препарат должен вводиться только квалифицированным врачом, имеющим опыт проведения интравитреальных инъекций.
Каждый флакон содержит 0.278 мл раствора для интравитреального введения, что предоставляет извлекаемый объем 0.1 мл.
Разовая доза препарата во флаконе составляет 2 мг афлиберцепта, что эквивалентно 50 мкл (0.05 мл) раствора для инъекций.
Режим дозирования
Неоваскулярная возрастная макулярная дегенерация
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл (0.05 мл) раствора для инъекций.
Лечение Эйлеа® начинают с трех последовательных инъекций 1 раз в месяц (каждые 4 недели в течение первых 12 недель) с дальнейшей инъекцией 1 раз каждые 2 месяца. Нет необходимости в проведении мониторинга между инъекциями.
После первых 12 месяцев лечения Эйлеа®, интервал между инъекциями может быть продлен на основании визуальных и анатомических результатов. В этом случае график обследований должен устанавливаться лечащим врачом и при этом он может быть чаще, чем график инъекций.
Макулярный отек вследствие окклюзии вен сетчатки (центральной вены сетчатки или ее ветвей)
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл (0.05 мл) раствора для инъекций.
После начальной инъекции препарата лечение проводят каждый месяц. Интервал между двумя инъекциями не должен быть короче одного месяца.
Если визуальные и анатомические результаты не указывают на пользу проводимой непрерывной терапии, инъекции Эйлеа® следует прекратить.
Лечение продолжают до достижения максимальной остроты зрения и/или отсутствия признаков активности заболевания. Возможна необходимость в выполнении 3-х или более последовательных ежемесячных инъекций.
Лечение затем можно продолжить в режиме treat-and-extend (лечить-и-увеличивать) с постепенным увеличением интервалов между инъекциями для поддержания стабильных визуальных и/или анатомических результатов, однако имеется недостаточно данных, чтобы сделать заключение о длительности этих интервалов. Если отмечается ухудшение визуальных и/или анатомических результатов необходимо сократить интервал в лечении, соответственно.График мониторинга и лечения должен определяться лечащим врачом на основании индивидуальной реакции пациента.
Мониторинг активности заболевания включает в себя проведение клинического обследования, функциональных тестов или методов визуализации (например, оптической когерентной томографии или флуоресцентной ангиографии).
Диабетический макулярный отек
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл (0.05 мл) раствора для инъекций.
Лечение Эйлеа® начинают с пяти последовательных инъекций 1 раз в месяц с дальнейшим интервалом лечения 1 инъекция в 2 месяца. Нет необходимости в проведении мониторинга между инъекциями.
После первых 12 месяцев лечения Эйлеа®, интервал между инъекциями может быть продлен на основании визуальных и анатомических результатов. График обследований должен устанавливаться лечащим врачом.
Если визуальные и анатомические результаты не указывают на пользу проводимой непрерывной терапии, инъекции Эйлеа® следует прекратить.
Миопическая хориоидальная неоваскуляризация
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл (0.05 мл) раствора в виде однократной интравитреальной инъекции.
Дополнительные дозы могут вводиться, если визуальные и/или анатомические результаты свидетельствуют о сохранении признаков заболевания. При развитии рецидива необходимо лечение как в случае новой манифестации заболевания.
График обследований должен устанавливаться лечащим врачом.
Интервал между двумя инъекциями не должен быть короче одного месяца.
Дополнительная информация для особых категорий пациентов
Пациенты с нарушениями функции печени и/или почек
Не проводилось каких-либо специальных исследований Эйлеа® у больных с нарушениями функции печени и почек. Доступные данные не предполагают коррекции дозы у таких пациентов.
Пожилые пациенты
Специальных предостережений не существуют. Имеется ограниченный опыт применения у больных старше 75 лет с диабетическим макулярным отеком.
Дети и подростки
Безопасность и эффективность в данной возрастной группе не установлена.
Нет обоснования для применения Эйлеа® в педиатрической популяции по показаниям ВМД, ОЦВС и ОВВС, ДМО, миопической ХНВ
Техника введения
Интравитреальные введения должны осуществляться квалифицированным врачом, имеющим опыт проведения интравитреальных инъекций в соответствии с медицинскими стандартами и действующими руководящими положениями. В целом, должна обеспечиваться адекватная анестезия и асептика, включая наружные бактерицидные средства широкого спектра (например, повидон-йод), наносимые на кожу вокруг глаза, веко и поверхность глаза. Рекомендуется применять хирургическую дезинфекцию рук, использовать стерильные перчатки, стерильные салфетки, стерильные векорасширители (или эквивалент).
Иглу для инъекций следует вводить на 3,5–4 мм кзади от лимба в полость стекловидного тела, избегая области горизонтальной меридианы и направляя иглу к центру глазного яблока. Затем следует выполнить инъекцию 0.05 мл раствора; для последующих инъекций следует использовать разные места склеры.
Сразу после интравитреальной инъекции должно быть начато наблюдение за пациентами на предмет выявления возможного повышения внутриглазного давления. Надлежащий мониторинг может состоять из проверки перфузии диска зрительного нерва или тонометрии. При необходимости следует обеспечить доступ к стерильному оборудованию для проведения парацентеза.
После интравитреальной инъекции пациентов необходимо проинструктировать о том, что они должны без промедления сообщать о каких-либо симптомах эндофтальмита (например, глазная боль, покраснение глаза, светобоязнь, нечеткость зрения).
Каждый флакон должен применяться только для лечения одного глаза.
После инъекции любой неиспользованный продукт должен быть утилизирован.
Инструкция по введению изложена в отдельном разделе.
Побочные действия
Серьезные побочные реакции, связанные с инъекцией Эйлеа® наблюдались менее чем в одной из 2200 проведенных интравитреальных инъекций, и включали слепоту, эндофтальмит, отслойку сетчатки, травматическую катаракту, кровоизлияния в стекловидное тело, катаракту, отслойку стекловидного тела, и повышение внутриглазного давления (смотрите раздел «Особые указания»).
Наиболее частыми побочными реакциями (как минимум у 5% пациентов, получивших терапию Эйлеа®) были кровоизлияние под конъюнктиву (24%), снижение остроты зрения (10%), боль в глазу (10%), повышение внутриглазного давления (7%), отслойка стекловидного тела (7%), плавающие помутнения стекловидного тела (6%) и катаракта (6%).
Перечисленные ниже данные по безопасности препарата включают в себя все побочные реакции, основанные на исследованиях фазы III, с допустимой возможностью их взаимосвязи с процедурой инъекции или с самим препаратом
Очень часто (1/10)
— снижение остроты зрения
— кровоизлияние под конъюнктиву
— боль в глазу
Часто (1/100, 1/10)
— разрыв пигментного эпителия сетчатки⃰, отслойка пигментного эпителия сетчатки, дегенерация сетчатки, кровоизлияние в стекловидное тело, катаракта, ядерная катаракта, субкапсулярная катаракта, эрозия роговицы, повреждение роговицы, повышение внутриглазного давления, нечеткость зрения, плавающие помутнения стекловидного тела, отек роговицы, отслойка стекловидного тела, боль в месте введения, ощущение инородного тела в глазах, повышенное слезоотделение, отек век, кровоизлияние в месте введения, точечный кератит, гиперемия конъюнктивы, окулярная гиперемия
Нечасто (1/1 0001/100)
— реакции гиперчувствительности
— эндофтальмит**, отслойка сетчатки, разрыв сетчатки, ирит, иридоциклит, кортикальная катаракта, помутнение хрусталика, отек роговицы, повреждение эпителия роговицы, раздражение в месте введения, ощущение дискомфорта в глазу, раздражение век, воспаление передней камеры глаза.
Редко (1/10 000, 1/1 000)
— слепота, увеит, травматическая катаракта, воспаление стекловидного тела, гипопион
*Состояния, о которых известно, что они связаны с влажной ВМД. Наблюдались только в исследованиях влажной ВМД.
**Эндофтальмит с положительной и отрицательной культурой.
Описание отдельных побочных реакций
Артериальные тромбоэмболические явления
Артериальные тромбоэмболические явления (АТЯ)– это побочные реакции, потенциально связанные с ингибированием системного эндотелиального фактора роста сосудов (VEGF). Существует теоретический риск развития АТЯ после интравитреального применения ингибиторов VEGF.
АТЯ, как это определено критериями Сотрудничества Антитромбоцитарных исследователей (АРТС), включают в себя нефатальный инфаркт миокарда, нефатальный инсульт или сосудистую смерть (включая смерть неизвестной этиологии)
Частота АТЯ у больных с ВМД в исследованиях III фазы в течение 96 недель была 3,3% (60 из 1,824) в комбинированной группе пациентов, получавших Эйлеа® по сравнению с 3,2% (19 из 595) у пациентов, получавших ранибизумаб (см. раздел «Фармакодинамические свойства»). Соответствующие цифры в исследованиях отмечались у пациентов с ДМО в течение первых 52 недель как 3,3% (19 из 578) на фоне Эйлеа® и 2,8% (8 из 287) в контрольной группе) (см. раздел «Фармакодинамические свойства»).
Частота АТЯ у больных с ОЦВС в исследованиях III фазы продолжительностью 76/100 недель была 0,6% (2 из 317) у пациентов, получавших, по крайней мере, одну дозу Эйлеа® по сравнению с 1,4% (2 из 142) в группе пациентов, получавших только имитацию инъекции (см. раздел «Фармакодинамические свойства»). Частота АТЯ у больных с ОВВС в исследованиях III фазы продолжительностью 52 недели была 0% (0 из 91) у пациентов, получавших Эйлеа® сравнению с 2,2% (2 из 92) в контрольной группе (см. раздел «Фармакодинамические свойства»).
Один из пациентов в контрольной группе получил лечение препаратом Эйлеа® в качестве «терапии спасения».
Частота АТЯ у больных с миопической ХНВ в исследовании продолжительностью 48 недель была 1,1% (1 из 91) на фоне Эйлеа® по сравнению с 0% (0 из 31) в контрольной группе).
Как и для других препаратов белковой природы существует вероятность развития иммуногенности на введение препарата Эйлеа®.
Противопоказания
— гиперчувствительность к афлиберцепту или вспомогательным компонентам препарата
— активная окулярная или периокулярная инфекция или подозрение на них
— активное тяжелое интраокулярное воспаление.
Лекарственные взаимодействия
Исследования на лекарственные взаимодействия не проводились.
Особые указания
Эндофтальмит
Побочные действия
При введении Эйлеа® всегда необходимо применять соответствующую технику проведения асептических инъекций. Кроме того, необходимо наблюдать за состоянием пациента в течение недели после проведения инъекции для обеспечения своевременного лечения при появлении признаков инфекционного процесса. Пациентов необходимо проинструктировать о том, что они должны без промедления сообщать при подозрении на какие-либо симптомы эндофтальмита или других вышеуказанных нарушений.
После проведения интравитреальных инъекций, в том числе препарата Эйлеа®, в течение первых 60 мин. наблюдается повышение внутриглазного давления (смотрите раздел «Побочные действия»). Пациенты с плохо контролируемой глаукомой нуждаются в особых мерах предосторожности. Эйлеа® не вводят когда внутриглазное давление ≥ 30 мм рт. ст. Во всех случаях необходимо проводить наблюдение за внутриглазным давлением и перфузией диска зрительного нерва и принимать соответствующие меры терапии.
Иммуногенность
Как и для других препаратов белковой природы существует вероятность развития иммуногенности на введение препарата Эйлеа®.
Пациенты должны быть проинструктированы о необходимости сообщать о любых признаках или симптомах интраокулярного воспаления, таких как боль, светобоязнь, покраснение, что может быть клиническим признаком повышенной чувствительности.
Системные эффекты
После интравитреальных инъекций ингибиторов VEGF отмечались системные побочные эффекты, включая внеглазные кровоизлияния и артериальные тромбоэмболические явления, которые теоретически могут быть обусловлены ингибированием VEGF. Данные о безопасности применения у пациентов с ДМО, ОЦВС, ОВВС, а также миопической ХНВ, имевших в анамнезе инсульт или транзиторные ишемические атаки в течение последних 6 месяцев, ограничены. Следовательно, при лечении таких пациентов следует соблюдать осторожность.
Другие
Как и при лечении другими ингибиторами VEGF для терапии ВМД, ОЦВС, ОВВС, ДМО и миопической ХНВ, следующие предостережения также применимы и к Эйлеа®.
-
Безопасность и эффективность терапии с Эйлеа® при введении в оба глаза систематически не изучалась. Если лечение проводится одновременно в оба глаза, это может привести к повышенному воздействию препарата, что может повысить риск развития системных побочных эффектов.
-
Одновременное применение с другими анти-VEGF препаратами, (ингибиторами фактора роста эндотелия сосудов).
Доступных данных об одновременном применении Эйлеа® с другими анти-VEGF препаратами (для системного или окулярного применения), нет.
-
Факторы риска, связанные с развитием разрыва пигментного эпителия сетчатки после терапии анти-VEGF препаратами для лечения влажной ВМД, включают обширную и/или высокую отслойку пигментного эпителия сетчатки. Перед началом лечения Эйлеа® следует проявлять осторожность пациентам, имеющим указанные факторы риска разрыва пигментного эпителия сетчатки.
-
Необходимо воздержаться от проведения лечения пациентам с регматогенной отслойкой сетчатки или с макулярным разрывом 3-4 степени.
-
В случае разрыва сетчатки следует воздержаться от введения дозы и не возобновлять его до тех пор, пока разрыв не будет устранен должным образом.
-
При нижеуказанных состояниях необходимо прекратить введение дозы и не возобновлять его ранее следующей запланированной инъекции препарата:
— снижение показателя наилучшей корригированной остроты зрения (НКОЗ) ≥30 букв по сравнению с показателем при последней оценке остроты зрения
— субретинальное кровоизлияние с вовлечением центра фовеа или, если размер кровоизлияния составляет ≥50% общей области поражения
-
Если проведено или запланировано хирургическое вмешательство на глазах необходимо воздержаться от введения дозы за 28 дней до и после операции.
-
Не cледует назначать Эйлеа® во время беременности, за исключением тех случаев, когда потенциальная польза от лечения превышает потенциальный риск для плода.
-
Женщинам репродуктивного возраста во время лечения препаратом необходимо использовать эффективную контрацепцию, по крайней мере в течение 3 месяцев после последней интравитреальной инъекции Эйлеа®.
-
Имеется ограниченный опыт применения препарата у пациентов с ишемической окклюзией центральной вены сетчатки и ее ветвей. Не рекомендуется применять препарат пациентам, имеющим клинические признаки необратимой потери функции зрения ишемического характера.
Популяции с ограниченными данными
Имеется ограниченный опыт применения препарата для лечения ДМО у пациентов с сахарным диабетом 1 типа или у диабетических пациентов с уровнем гликозилированного гемоглобина более 12% или с пролиферативной диабетической ретинопатией.
Эйлеа® не изучался у пациентов с активными системными инфекциями или у пациентов с сопутствующими заболеваниями глаз, такими как, отслойка сетчатки или макулярный разрыв. Также не имеется опыта применения препарата у диабетических пациентов с неконтролируемой артериальной гипертензией. Лечащий врач должен принимать во внимание недостаток данной информации при лечении таких пациентов.
Нет опыта применения препарата в лечении миопической ХНВ у лиц не азиатской популяции, пациентов, ранее получавших лечение по поводу миопической ХНВ, а также с экстрафовеальной локализацией поражения.
Беременность и период лактации
Беременность
Данные об использовании афлиберцепта у беременных женщин отсутствуют.
Доклинические исследования продемонстрировали эмбриофетальную токсичность.
Хотя системное воздействие после окулярного введения является очень низким, не cледует назначать Эйлеа® во время беременности, за исключением тех случаев, когда потенциальная польза от лечения превышает потенциальный риск для плода.
Лактация
Неизвестно, проникает ли афлиберцепт в грудное молоко. Нельзя исключить существование риска для ребенка находящегося на грудном вскармливании.
Не рекомендуется принимать Эйлеа® в период кормления грудью. Необходимо принять решение о прекращении кормления грудью или воздержании от приема препарата с учетом пользы от кормления для ребенка и пользы от терапии для женщины.
Фертильность
Результаты исследований на животных при высоком системном воздействии препарата свидетельствуют о том, что афлиберцепт может оказывать неблагоприятное влияние на фертильность у женщин и мужчин. Не ожидается подобных эффектов после окулярного введения препарата с очень низким системным воздействием.
Применение в педиатрии
Безопасность и эффективность препарата у детей и подростков не изучались.
Особенности влияния лекарственного средства на способность управлять транспортным средством и потенциально опасными механизмами
После инъекций Эйлеа® отмечается незначительное влияние на способность управлять транспортным средством и потенциально опасными механизмами вследствие возможных временных нарушений зрения после проведения интравитреальных инъекций препарата или сопутствующего обследования зрения.
Пациентам не следует управлять автомобилем или сложными механизмами до тех пор, пока зрительная функция не будет в достаточной степени восстановлена.
Передозировка
В клинических исследованиях дозы до 4 мг с интервалом в 1 месяц и отдельные случаи передозировки в дозе 8 мг в целом хорошо переносились.
Симптомы: передозировка в результате повышенного объема введения может привести к повышению внутриглазного давления.
Лечение: в случаях передозировки необходимо проводить наблюдение за внутриглазным давлением и при необходимости лечащий врач должен назначить адекватное лечение.
Форма выпуска и упаковка
По 0.278 мл раствора во флакон из бесцветного стекла типа I вместимостью 2 мл, укупоренный пробкой из бутилкаучука, фольгированный фторполимером; обжатый алюминиевым кольцом и полипропиленовым колпачком.
По 1 флакону, 1 фильтровальной игле вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона.
Условия хранения
Хранить при температуре от 2°С до 8°С. Не замораживать.
Хранить в картонной пачке для предотвращения воздействия света.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не использовать по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель
Регенерон Фармасьютикалс, Инк.,
Нью-Йорк 12144, США
Владелец регистрационного удостоверения
Байер Фарма АГ, Берлин, Германия.
Упаковщик
Байер Фарма АГ, Берлин, Германия.
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукта (товара)
ТОО «Байер КАЗ»
ул. Тимирязева, 42, бизнес-центр «Экспо-Сити», пав. 15
050057 Алматы, Республика Казахстан,
тел. +7 727 258 80 40, факс: +7 727 258 80 39,
e-mail: kz.claims@bayer.com
Инструкции по введению
Флакон предназначен только для однократного использования.
Перед введением следует визуально осмотреть флакон. Нельзя использовать флакон при наличии частиц, хлопьев или изменения цвета раствора.
Перед применением неоткрытый флакон может храниться при комнатной температуре (25 °C / 77°F) в течение максимум 24 часов. Все манипуляции с открытым флаконом следует проводить в асептических условиях.
Для интравитреального введения необходимо использовать иглу для инъекций размером 30 G x ½.
-
Снимите пластиковый колпачок и продезинфицируйте наружную часть резиновой пробки флакона
| 073721241477976842_ru.doc | 323.5 кб |
| 075162901477978000_kz.doc | 351.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники