Описание препарата Апидра® СолоСтар® (раствор для подкожного введения, 100 ЕД/мл) основано на официальной инструкции, утверждено компанией-производителем в 2020 году
Дата согласования: 17.09.2020
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Апидра® СолоСтар®
- Заказ в аптеках Москвы
Фотографии упаковок

17.09.2020
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для подкожного введения, 100 ЕД/1 мл | 1 мл |
| активное вещество: | |
| инсулин глулизин | 100 ЕД (3,49 мг) |
| вспомогательные вещества: метакрезол (м-крезол); трометамол (трометамин); натрия хлорид; полисорбат 20; натрия гидроксид; хлористоводородная кислота; вода для инъекций |
Описание лекарственной формы
Прозрачная, бесцветная или почти бесцветная жидкость.
Фармакологическое действие
Фармакологическое действие
—
гипогликемическое.
Фармакодинамика
Инсулин глулизин является рекомбинантным аналогом человеческого инсулина, который по силе действия равен обычному человеческому инсулину. После п/к введения инсулин глулизин начинает действовать быстрее и имеет меньшую продолжительность действия, чем растворимый человеческий инсулин.
Наиболее важным действием инсулина и аналогов инсулина, включая инсулин глулизин, является регуляция обмена глюкозы. Инсулин снижает концентрацию глюкозы в крови, стимулируя поглощение глюкозы периферическими тканями, особенно скелетной мускулатурой и жировой тканью, а также ингибируя образование глюкозы в печени. Инсулин подавляет липолиз в адипоцитах и протеолиз и увеличивает синтез белка. Исследования, проведенные у здоровых добровольцев и пациентов с сахарным диабетом, показали, что при п/к введении инсулин глулизин начинает действовать быстрее и имеет меньшую продолжительность действия, чем растворимый человеческий инсулин. При п/к введении понижающее уровень глюкозы в крови действие инсулина глулизина начинается через 10–20 мин. При в/в введении эффекты снижения уровня глюкозы в крови инсулина глулизина и растворимого человеческого инсулина являются равными по силе. Одна единица инсулина глулизина имеет ту же самую глюкозопонижающую активность, что и одна единица растворимого человеческого инсулина.
В исследовании фазы I у пациентов с сахарным диабетом типа 1 оценивались глюкозопонижающие профили инсулина глулизина и растворимого человеческого инсулина, вводившиеся п/к в дозе 0,15 ЕД/кг в разное время по отношению к стандартному 15-минутному приему пищи.
Результаты исследования показали, что инсулин глулизин, введенный за 2 мин до приема пищи, обеспечивал такой же гликемический контроль после еды, что и растворимый человеческий инсулин, введенный за 30 мин до приема пищи. При введении за 2 мин до приема пищи инсулин глулизин обеспечивал лучший гликемический контроль после еды, чем растворимый человеческий инсулин, введенный за 2 мин до приема пищи. Инсулин глулизин, введенный через 15 мин после начала приема пищи, давал такой же гликемический контроль после еды, что и растворимый человеческий инсулин, вводимый за 2 мин до приема пищи.
Ожирение. Исследование фазы I, проводившееся с инсулином глулизином, инсулином лизпро и растворимым человеческим инсулином у группы пациентов с ожирением, продемонстрировало, что у этих пациентов инсулин глулизин сохраняет свои характеристики быстрого действия. В этом исследовании время достижения 20% от полного AUC составляло 114 мин — для инсулина глулизина, 121 мин — для инсулина лизпро и 150 мин — для растворимого человеческого инсулина, а AUC(0–2 ч), отражающее также раннюю глюкозопонижающую активность, составляла 427 мг/кг — для инсулина глулизина, 354 мг/кг — для инсулина лизпро и 197 мг/кг — для растворимого человеческого инсулина.
Клинические исследования
Сахарный диабет типа 1. В 26-недельном клиническом исследовании фазы III, в котором проводилось сравнение инсулина глулизина с инсулином лизпро, вводившимися п/к незадолго до еды (за 0–15 мин) пациентам с сахарным диабетом типа 1, использующим в качестве базального инсулина инсулин гларгин, инсулин глулизин был сопоставим с инсулином лизпро в отношении гликемического контроля, который оценивался по изменению концентрации гликозилированного гемоглобина (HbA1С) на момент конечной точки исследования в сравнении с исходом. Наблюдались сопоставимые значения глюкозы крови, определяемые путем самоконтроля. При введении инсулина глулизина, в отличие от лечения инсулином лизпро, не потребовалось повышения дозы базального инсулина.
12-недельное клиническое исследование III фазы, проведенное у пациентов с сахарным диабетом типа 1, получавших в качестве базальной терапии инсулин гларгин, показало, что эффективность введения инсулина глулизина непосредственно после еды была сопоставима с таковой при введении инсулина глулизина непосредственно перед приемом пищи (за 0–15 мин) или растворимого человеческого инсулина за 30–45 мин до еды.
В популяции пациентов, выполнивших протокол исследования, в группе пациентов, получавших перед едой инсулин глулизин, наблюдалось достоверно большее снижение HbA1С по сравнению с группой пациентов, получавших растворимый человеческий инсулин.
Сахарный диабет типа 2. 26-недельное клиническое исследование фазы III с последовавшим за ним 26-недельным продолжением в виде исследования по безопасности было проведено для сравнения инсулина глулизина (за 0–15 мин до приема пищи) с растворимым человеческим инсулином (за 30–45 мин до приема пищи), которые вводились п/к пациентам с сахарным диабетом типа 2, кроме этого использующих в качестве базального инсулин-изофан. Средний индекс массы тела пациентов составлял 34,55 кг/м2. Инсулин глулизин показал большее снижение концентрации HbA1c от исходного значения по сравнению с растворимым человеческим инсулином (-0,46% для инсулина глулизина и -0,30% для растворимого человеческого инсулина, p=0,0029). В этом исследовании большинство пациентов (79%) смешивали свой инсулин короткого действия с инсулином-изофаном непосредственно перед инъекцией. На момент рандомизации 58 пациентов использовали пероральные гипогликемические препараты и получили инструкции по продолжению их использования в той же дозе.
При проведении непрерывной п/к инфузии инсулина с помощью помпового устройства (при сахарном диабете типа 1) у 59 пациентов, получавших лечение препаратом Апидра® или инсулином аспарт, в обеих группах лечения наблюдалась низкая частота окклюзии катетера (0,08 окклюзий в месяц при применении препарата Апидра® и 0,15 окклюзий в месяц при применении инсулина аспарт), а также подобная частота реакций в месте введения (10,3% при применении препарата Апидра® и 13,3% при применении инсулина аспарт).
У детей и подростков с сахарным диабетом типа 1, которым в качестве базального инсулина один раз в день вечером вводили инсулин гларгин или два раза в день утром и вечером инсулин-изофан, при сравнении эффективности и безопасности лечения инсулином глулизином и инсулином лизпро при их п/к введении за 15 мин до приема пищи было показано, что гликемический контроль, частота развития гипогликемии, потребовавшей вмешательства третьих лиц, а также частота тяжелых гипогликемических эпизодов были сопоставимыми в обеих группах лечения. При этом через 26 нед лечения пациентам, получавшим лечение инсулином глулизином, для достижения гликемического контроля, сопоставимого с инсулином лизпро, потребовалось достоверно меньшее увеличение суточных доз базального инсулина, быстродействующего инсулина и суммарной дозы инсулина.
Расовое происхождение и пол. В контролируемых клинических исследованиях у взрослых не было показано различий в безопасности и эффективности инсулина глулизина при анализе подгрупп, выделенных по расовой принадлежности и полу.
Фармакокинетика
В инсулине глулизине замещение аминокислоты аспарагин человеческого инсулина в позиции В3 на лизин и лизина в позиции В29 на глутаминовую кислоту способствует более быстрой абсорбции.
Абсорбция и биодоступность. Фармакокинетические кривые AUC у здоровых добровольцев и пациентов с сахарным диабетом типа 1 и 2 продемонстрировали, что абсорбция инсулина глулизина по сравнению с растворимым человеческим инсулином была приблизительно в 2 раза быстрее с достижением до двух раз большей Cmax.
В исследовании, проведенном у пациентов с сахарным диабетом типа 1, после п/к введения инсулина глулизина в дозе 0,15 ЕД/кг Тmax составляло 55 мин, и Сmax в плазме крови составляла (82±1,3) μЕД/мл по сравнению с Tmax, составляющим 82 мин, и Cmax, составляющей (46±1,3) μЕД/мл, для растворимого человеческого инсулина. Среднее время пребывания в системном кровотоке у инсулина глулизина было короче (98 мин), чем у обычного человеческого инсулина (161 мин).
В исследовании у пациентов с сахарным диабетом типа 2 после п/к введения инсулина глулизина в дозе 0,2 ЕД/кг Сmax составляла 91 μЕД/мл с межквартильной широтой от 78 до 104 μЕД/мл.
При п/к введении инсулина глулизина в переднюю брюшную стенку, бедро или плечо (область дельтовидной мышцы) абсорбция была более быстрой при введении в переднюю брюшную стенку по сравнению с введением препарата в бедро. Скорость абсорбции из области дельтовидной мышцы была промежуточной. Абсолютная биодоступность инсулина глулизина после п/к введения составляла приблизительно 70% (73% — из области передней брюшной стенки; 71% — из области дельтовидной мышцы; 68% — из области бедра) в разных местах введения была подобной и имела низкую вариабельность между разными пациентами.
Распределение и выведение. Распределение и выведение инсулина глулизина и растворимого человеческого инсулина после в/в введения являются подобными объемам распределения, составляющим 13 и 22 л, и Т1/2, составляющим 13 и 18 мин соответственно.
После п/к введения инсулин глулизин выводится быстрее, чем растворимый человеческий инсулин с кажущимся Т1/2, составляющим 42 мин, по сравнению с кажущимся Т1/2 растворимого человеческого инсулина, составляющим 86 мин. При перекрестном анализе исследований инсулина глулизина как у здоровых лиц, так и у лиц с сахарным диабетом типа 1 и 2, кажущийся Т1/2 находился в диапазоне от 37 до 75 мин.
Специальные группы пациентов
Почечная недостаточность. В клиническом исследовании, проведенном у лиц без сахарного диабета с широким диапазоном функционального состояния почек (Cl креатинина >80 мл/мин, 30–50 мл/мин, <30 мл/мин), в целом быстрота наступления эффекта инсулина глулизина сохранялась. Однако потребность в инсулине при наличии почечной недостаточности может быть снижена.
Печеночная недостаточность. У пациентов с нарушениями функции печени фармакокинетические показатели не изучались.
Лица пожилого возраста. Имеются очень ограниченные данные по фармакокинетике инсулина глулизина у пожилых пациентов с сахарным диабетом.
Дети и подростки. Фармакокинетические и фармакодинамические свойства инсулина глулизина были исследованы у детей (7–11 лет) и подростков (12–16 лет) с сахарным диабетом типа 1. В обеих возрастных группах инсулин глулизин быстро абсорбируется с Тmax и Сmax, подобными таковым у взрослых. Как и у взрослых, при введении непосредственно перед тестом с приемом пищи инсулин глулизин обеспечивает лучший контроль глюкозы крови после еды, чем растворимый человеческий инсулин. Повышение концентрации глюкозы в крови после еды (AUC0–6 ч — площадь под кривой концентрация глюкозы в крови — время от 0 до 6 ч) составляла 641 мг/ч×дл — для инсулина глулизина и 801 мг/ч×дл — для растворимого человеческого инсулина.
Показания
Сахарный диабет, требующий лечения инсулином, у взрослых, подростков и детей старше 6 лет.
Противопоказания
- гиперчувствительность к инсулину глулизину или к какому-либо из компонентов препарата;
- гипогликемия.
С осторожностью следует применять у беременных.
Применение при беременности и кормлении грудью
Отсутствуют контролируемые клинические исследования по использованию препарата Апидра® СолоСтар® у беременных женщин.
Ограниченное количество данных, полученных по применению инсулина глулизина у беременных женщин (сообщалось о менее чем 300 исходах беременностей), не указывает на его неблагоприятное воздействие на течение беременности, внутриутробное развитие плода или на новорожденного ребенка. Репродуктивные исследования на животных не выявили каких-либо различий между инсулином глулизином и человеческим инсулином в отношении течения беременности, эмбрионального/фетального развития, родов и постнатального развития.
Применение препарата Апидра® СолоСтар® у беременных должно проводиться с осторожностью. Обязателен тщательный мониторинг концентрации глюкозы в крови и поддержание гликемического контроля.
Пациенткам с имевшимся до беременности или гестационным сахарным диабетом необходимо в течение всей беременности поддерживать гликемический контроль. Во время I триместра беременности потребность в инсулине может уменьшаться, а во время II и III триместров она, как правило, может увеличиваться. Сразу же после родов потребность в инсулине быстро снижается.
Неизвестно, экскретируется или нет инсулин глулизин в грудное молоко. Для женщин в период кормления грудью может потребоваться коррекция режима дозирования инсулина и диеты.
Способ применения и дозы
Реклама: ООО «РЛС-Библиомед», ИНН 7714758963, erid=4CQwVszH9pUmKjt23pm
П/к, незадолго (за 0–15 мин) до или вскоре после приема пищи.
Препарат Апидра® СолоСтар® должен использоваться в схемах лечения, включающих в себя или инсулин средней продолжительности действия, или длительно действующий инсулин, или аналог инсулина длительного действия. Кроме этого, препарат Апидра® СолоСтар® может использоваться в сочетании с пероральными гипогликемическими препаратами.
Режим дозирования препарата Апидра® СолоСтар® подбирается индивидуально.
Введение препарата
Препарат Апидра® СолоСтар® вводится или с помощью п/к инъекции, или путем непрерывной инфузии в подкожно-жировую клетчатку с помощью помповой системы.
П/к инъекции препарата Апидра® СолоСтар® следует производить в область передней брюшной стенки, плеча или бедра, а введение препарата путем непрерывной инфузии в подкожно-жировую клетчатку производится в области передней брюшной стенки. Места инъекций и места инфузий в вышеупомянутых областях (передняя брюшная стенка, бедро или плечо) должны чередоваться при каждом новом введении препарата. На скорость абсорбции и, соответственно, на начало и продолжительность действия могут влиять: место введения, физическая нагрузка и другие изменяющиеся условия. П/к введение в брюшную стенку обеспечивает несколько более быструю абсорбцию, чем введение в другие вышеуказанные участки тела (см. раздел «Фармакокинетика»).
Следует соблюдать меры предосторожности для исключения попадания препарата непосредственно в кровеносные сосуды. После введения препарата нельзя производить массаж области введения. Пациенты должны быть обучены правильной технике проведения инъекций.
Смешивание с инсулинами
Препарат Апидра® СолоСтар® может смешиваться с человеческим инсулином-изофаном.
При смешивании препарата Апидра® СолоСтар® с человеческим инсулином-изофаном, препарат Апидра® СолоСтар® должен набираться в шприц первым. П/к инъекция должна производиться сразу же после смешивания. Смешанные вышеуказанные инсулины нельзя вводить в/в.
Помповое устройство для проведения непрерывной п/к инфузии
При использовании препарата Апидра® СолоСтар® с помповой системой для инфузии инсулина его нельзя смешивать с другими инсулинами или растворителями.
Препарат Апидра® может также вводиться с помощью помпового устройства для проведения непрерывной п/к инфузии инсулина. При необходимости препарат Апидра® может быть извлечен из картриджа шприц-ручки Апидра® СолоСтар® и быть использован для введения с помощью помпового устройства для проведения непрерывной п/к инфузии инсулина.
При этом набор для проведения инфузии и резервуар, которые используются с препаратом Апидра®, должны заменяться с соблюдением правил асептики, как минимум, каждые 48 ч. Эти рекомендации могут отличаться от общих инструкций в руководствах по использованию помповых устройств. Важно, чтобы пациенты следовали вышеуказанным специальным инструкциям по применению препарата Апидра®. Несоблюдение этих специальных инструкций по применению препарата Апидра® может привести к развитию серьезных нежелательных явлений.
Пациенты, которым препарат Апидра® вводится путем непрерывной п/к инфузии, должны иметь альтернативные системы для введения инсулина и должны быть обучены введению инсулина путем п/к инъекции (на случай поломки используемого помпового устройства).
При использовании препарата Апидра® с помповыми устройствами для проведения непрерывной п/к инфузии инсулина нарушение работы помпового устройства, неисправность набора для проведения инфузии или ошибки в обращении с ними могут быстро привести к развитию гипергликемии, кетоза и диабетического кетоацидоза. В случае развития гипергликемии или кетоза или диабетического кетоацидоза требуется быстрое выявление и устранение причин их развития.
Следует точно выполнять инструкции по правильному обращению с предварительно заполненными шприцами (см. раздел «Инструкции по использованию и обращению»).
Инструкция по использованию и обращению предварительно заполненной шприц-ручки СолоСтар®
Перед первым использованием шприц-ручку необходимо подержать при комнатной температуре 1–2 ч.
Перед использованием следует осмотреть картридж внутри шприц-ручки. Его следует использовать только в случае, если раствор прозрачен, бесцветен, не содержит видимых твердых частиц и по консистенции напоминает воду.
Пустые шприц-ручки СолоСтар® не должны использоваться повторно и подлежат уничтожению.
Для предотвращения инфицирования предварительно заполненная шприц-ручка должна использоваться только одним пациентом и не передаваться другому лицу.
Обращение со шприц-ручкой СолоСтар®
Перед использованием шприц-ручки СолоСтар® следует внимательно прочитать инструкцию по использованию.
Важная информация по использованию шприц-ручки СолоСтар®
Перед каждым использованием необходимо с осторожностью подсоединить новую иглу к шприц-ручке и провести тест на безопасность. Необходимо использовать только иглы, совместимые с СолоСтар®.
Необходимо принимать специальные меры предосторожности во избежание несчастных случаев, связанных с применением иглы, и возможностью переноса инфекции.
Ни в коем случае не использовать шприц-ручку СолоСтар® при ее повреждении или в том случае, если нет уверенности, что она будет работать надлежащим образом.
Всегда следует иметь в наличии запасную шприц-ручку СолоСтар® на случай потери или повреждения используемого экземпляра.
Инструкция по хранению
Если шприц-ручка СолоСтар® хранится в холодильнике, ее следует извлечь оттуда за 1–2 ч перед предполагаемой инъекцией, чтобы раствор принял комнатную температуру. Введение охлажденного инсулина является более болезненным.
Использованная шприц-ручка СолоСтар® должна подвергаться уничтожению.
Эксплуатация
Шприц-ручку СолоСтар® необходимо предохранять от пыли и грязи.
Внешнюю сторону шприц-ручки СолоСтар® можно очищать, протирая ее влажной тканью.
Не следует погружать в жидкость, промывать и смазывать шприц-ручку СолоСтар®, поскольку этим можно ее повредить.
Шприц-ручка СолоСтар® точно дозирует инсулин и безопасна в работе. Она также требует бережного обращения. Следует избегать ситуаций, при которых может произойти повреждение шприц-ручки СолоСтар®. Если есть подозрение, что экземпляр шприц-ручки СолоСтар® мог быть поврежден, необходимо использовать новую шприц-ручку.
Стадия 1. Контроль инсулина
Необходимо проверить этикетку на шприц-ручке СолоСтар® для того, чтобы убедиться, что он содержит соответствующий инсулин. После снятия колпачка шприца-ручки контролируют внешний вид содержащегося в ней инсулина: раствор инсулина должен быть прозрачен, бесцветен, не содержать видимых твердых частиц и по консистенции напоминать воду.
Стадия 2. Подсоединение иглы
Необходимо использовать только иглы, совместимые со шприц-ручкой СолоСтар®.
Для каждой последующей инъекции всегда применяют новую стерильную иглу. После удаления колпачка иглу необходимо осторожно установить на шприц-ручке.
Стадия 3. Испытание на безопасность
Перед введением каждой инъекции необходимо провести тест на безопасность и убедиться, что шприц-ручка и игла хорошо работают и пузырьки воздуха удалены.
Отмеряют дозу, равную 2 ЕД.
Наружный и внутренний колпачки иглы должны быть сняты.
Располагая шприц-ручку иглой вверх, осторожно постукивают по картриджу с инсулином пальцем таким образом, чтобы все пузырьки воздуха смещались по направлению к игле.
Нажимают (полностью) на кнопку введения инъекции.
Если инсулин появляется на кончике иглы, это означает, что шприц-ручка и игла работают правильно.
Если появления инсулина на кончике иглы не наблюдается, то стадия 3 повторяется до тех пор, пока инсулин не появится на кончике иглы.
Стадия 4. Выбор дозы
Доза может быть установлена с точностью до 1 ЕД, от минимальной дозы (1 ЕД) до максимальной (80 ЕД). Если необходимо ввести дозу, превышающую 80 ЕД, следует провести 2 или более инъекций.
Дозировочное окошко должно показывать «0» после завершения испытания на безопасность. После этого может быть установлена необходимая доза.
Стадия 5. Введение дозы
Пациент должен быть проинформирован о технике проведения инъекции медицинским работником.
Иглу необходимо ввести под кожу.
Кнопка введения инъекции должна быть нажата полностью. Она удерживается в этом положении в течение еще 10 с до момента извлечения иглы. Таким образом обеспечивается введение выбранной дозы инсулина полностью.
Стадия 6. Извлечение и выбрасывание иглы
Во всех случаях после каждой инъекции игла должна быть удалена и выброшена. Этим обеспечивается профилактика загрязнения и/или внесения инфекции, попадания воздуха в емкость для инсулина и утечки инсулина.
При удалении и выбрасывании иглы должны быть осуществлены специальные меры предосторожности. Необходимо соблюдать рекомендованные меры безопасности для удаления и выбрасывания игл (например техника надевания колпачка одной рукой) для того, чтобы уменьшить риск несчастных случаев, связанных с применением иглы, а также предотвратить инфицирование.
После удаления иглы следует закрыть шприц-ручку СолоСтар® колпачком.
Особые группы пациентов
Нарушение функции почек. Потребность в инсулине при почечной недостаточности может снижаться.
Нарушение функции печени. У пациентов с нарушением функции печени потребность в инсулине может снижаться из-за сниженной способности к глюконеогенезу и замедлению метаболизма инсулина.
Пациенты пожилого возраста. Имеющиеся данные по фармакокинетике у пациентов пожилого возраста с сахарным диабетом недостаточны. Нарушение функции почек в пожилом возрасте может привести к снижению потребности в инсулине.
Дети и подростки. Препарат Апидра® можно применять у детей старше 6 лет и подростков. Клиническая информация по применению препарата у детей моложе 6 лет ограничена.
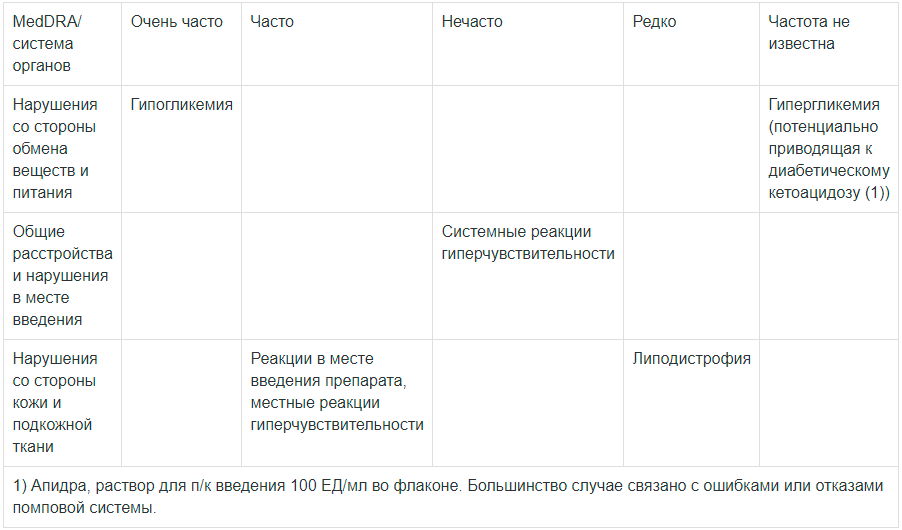
Побочные действия
Наблюдавшиеся нежелательные реакции были реакциями, известными для этого фармакологического класса, и следовательно, общими для любых инсулинов.
Со стороны обмена веществ и питания: гипогликемия, наиболее частый нежелательный эффект инсулинотерапии, может возникать в случае применения слишком высоких доз инсулина, превышающих потребность в нем.
Симптомы развития гипогликемии обычно возникают внезапно. Однако обычно психоневрологическим нарушениям на фоне нейрогликопении (чувство усталости, необычная утомляемость или слабость, снижение способности к концентрации внимания, сонливость, зрительные расстройства, головная боль, тошнота, спутанность сознания или его потеря, судорожный синдром) предшествуют симптомы адренергической контррегуляции (активации симпато-адреналовой системы в ответ на гипогликемию): чувство голода, раздражительность, нервное возбуждение или тремор, беспокойство, бледность кожных покровов, холодный пот, тахикардия, выраженное сердцебиение (чем быстрее развивается гипогликемия и чем она тяжелее, тем сильнее выражены симптомы адренергической контррегуляции).
Эпизоды тяжелой гипогликемии, особенно повторяющиеся, могут приводить к поражению нервной системы. Длительная и выраженная гипогликемия может угрожать жизни пациентов, т.к. при нарастании гипогликемии возможен даже смертельный исход.
Со стороны иммунной системы:
Местные реакции гиперчувствительности на инсулин (гиперемия, отечность и зуд в месте инъекции инсулина). Эти реакции обычно исчезают через несколько дней или недель применения препарата. В некоторых случаях эти реакции могут быть не связаны с инсулином, а обусловлены раздражением кожи, вызванным антисептической обработкой ее перед инъекцией или неправильным проведением п/к инъекции (при нарушении правильной техники проведения п/к инъекции).
Системные реакции гиперчувствительности на инсулин. Такие реакции на инсулин (включая инсулин глулизин) могут например сопровождаться появлением сыпи по всему телу (в т.ч. сопровождающейся зудом), чувства стесненности в груди, удушья, снижения АД, учащения пульса или обильного потоотделения. Тяжелые случаи генерализованной аллергии, включая анафилактические реакции, могут угрожать жизни пациента.
Со стороны кожи и подкожной клетчатки: липодистрофия. Как и при применении любых других инсулинов, в месте инъекций может развиться липодистрофия, что может замедлить абсорбцию инсулина. Развитию липодистрофии может способствовать нарушение чередования мест введения инсулина, т.к. введение препарата в одно и то же место может способствовать развитию липодистрофии. Постоянное чередование мест инъекции в пределах одной из областей введения (область бедра, плеча, передней поверхности брюшной стенки) может способствовать уменьшению и профилактике развития этой нежелательной реакции.
Прочие: сообщалось о случайном введении других инсулинов по ошибке, особенно длительно действующих инсулинов, вместо инсулина глулизина.
Взаимодействие
Исследований по фармакокинетическим взаимодействиям не проводилось. На основании имеющихся эмпирических знаний в отношении других подобных лекарственных препаратов возникновение клинически значимых фармакокинетических взаимодействий маловероятно. Некоторые вещества могут влиять на метаболизм глюкозы, что может потребовать коррекции доз инсулина глулизина и особенно тщательного контроля за лечением.
К веществам, способным увеличивать гипогликемическое действие инсулина и увеличивать предрасположенность к гипогликемии, относятся: пероральные гипогликемические средства, ингибиторы ангиотензинпревращающего фермента, дизопирамид, фибраты, флуоксетин, ингибиторы моноаминоксидазы, пентоксифиллин, пропоксифен, салицилаты и сульфаниламидные противомикробные средства.
К веществам, способным уменьшать гипогликемическое действие инсулина, относятся: ГКС, даназол, диазоксид, диуретики, глюкагон, изониазид, производные фенотиазина, соматропин, симпатомиметики (например эпинефрин (адреналин), сальбутамол, тербуталин), гормоны щитовидной железы, эстрогены, гестагены (например в пероральных контрацептивных средствах), ингибиторы протеазы и антипсихотические лекарственные препараты (например оланзапин и клозапин).
Бета-адреноблокаторы, клонидин, соли лития или этанол могут или потенцировать, или ослаблять гипогликемическое действие инсулина. Пентамидин может вызывать гипогликемию c последующей гипергликемией.
Кроме того, под влиянием таких препаратов с симпатолитической активностью, как бета-адреноблокаторы, клонидин, гуанетидин и резерпин, симптомы рефлекторной адренергической активации могут быть менее выраженными или отсутствовать.
Указания по совместимости
В связи с отсутствием исследований по совместимости инсулин глулизин не следует смешивать с какими-либо другими препаратами, за исключением человеческого инсулина изофан.
При введении с помощью инфузионной помпы препарат Апидра® СолоСтар® не должен смешиваться с растворителями и другими препаратами инсулина.
Передозировка
Симптомы: при избытке дозы инсулина по отношению к потребности в нем, определяющейся потреблением пищи и энергозатратами, может развиться гипогликемия.
Отсутствуют специальные данные относительно передозировки инсулина глулизина. Однако при его передозировке возможно развитие гипогликемии.
Лечение: эпизоды легкой гипогликемии могут быть купированы с помощью приема глюкозы или продуктов, содержащих сахар. Поэтому рекомендуется, чтобы пациенты с сахарным диабетом постоянно имели при себе кусочки сахара, конфеты, печенье или сладкий фруктовый сок.
Эпизоды тяжелой гипогликемии с комой, судорогами и неврологическими расстройствами, во время которых пациент теряет сознание, могут быть купированы в/м или п/к введением 0,5–1 мг глюкагона, которое производится лицом, получившим соответствующие инструкции, или или в/в введением концентрированного (20%) раствора декстрозы (глюкозы) медицинским работником.
После восстановления сознания рекомендуется давать пациенту углеводы внутрь для предотвращения повторения гипогликемии, которая возможна после кажущегося клинического улучшения.
После введения глюкагона для установления причины тяжелой гипогликемии и предотвращения развития других подобных эпизодов пациент должен наблюдаться в стационаре.
Особые указания
Перевод пациента на новый тип инсулина или инсулин другого производителя должен осуществляться под строгим медицинским наблюдением, т.к. может потребоваться изменение дозировки вследствие изменения концентрации инсулина, торговой марки (производителя), типа инсулина (растворимый, инсулин-изофан и т.д.), вида инсулина (животного происхождения) и/или способа производства. Кроме того, может потребоваться коррекция сопутствующей пероральной гипогликемической терапии. Использование неадекватных доз инсулина или прекращение лечения, особенно у пациентов с сахарным диабетом типа 1, может привести к развитию гипергликемии и диабетического кетоацидоза — состояний, которые являются потенциально опасными для жизни.
Гипогликемия. Время, через которое развивается гипогликемия, зависит от скорости наступления эффекта используемых инсулинов и в связи с этим может изменяться при изменении схемы лечения. К условиям, которые могут изменить или сделать менее выраженными предвестники развития гипогликемии, относятся: длительное существование сахарного диабета, интенсификация инсулинотерапии, наличие диабетической нейропатии, прием некоторых лекарственных препаратов, таких как бета-адреноблокаторы, или перевод пациента с инсулина животного происхождения на человеческий инсулин.
Коррекция доз инсулина может также потребоваться в случае, если пациенты увеличивают физическую активность или изменяют свой обычный распорядок приема пищи. Физическая нагрузка, выполненная непосредственно после еды, может увеличить риск развития гипогликемии. По сравнению с растворимым человеческим инсулином после инъекции быстродействующих аналогов инсулина, гипогликемия может развиваться раньше.
Некомпенсированные гипогликемическая или гипергликемическая реакции могут привести к потере сознания, развитию комы или смертельному исходу.
Потребность в инсулине может изменяться при заболеваниях или эмоциональных перегрузках.
Срок годности препарата в одноразовой шприц-ручке Апидра® СолоСтар® после первого использования — 4 нед. Рекомендуется отмечать на этикетке дату первого введения препарата.
Шприц-ручку Апидра® СолоСтар® нельзя охлаждать перед использованием (инъекция охлажденного раствора является более болезненной).
После начала использования одноразовые шприц-ручки Апидра® СолоСтар® следует хранить при температуре не выше 25 °C в недоступном для детей месте, защищая от воздействия света.
Влияние на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности. Гипергликемия и гипогликемия, а также зрительные расстройства, возникающие при их развитии, могут ухудшить способность к концентрации и замедлить психомоторные реакции пациента. Это может представлять риск при управлении им транспортными средствами и занятии другими потенциально опасными видами деятельности. Это особенно опасно у пациентов, у которых ослаблены или отсутствуют симптомы, предвещающие развитие гипогликемии, или имеются частые эпизоды гипогликемии. Это следует учитывать в каждом конкретном случае для принятия решения о возможности или невозможности для пациента управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности. Пациентам следует рекомендовать во время управления транспортными средствами принимать меры предосторожности для того, чтобы избегать возможности развития гипогликемии.
Форма выпуска
Раствор для подкожного введения, 100 ЕД/мл. В картриджах по 3 мл из прозрачного бесцветного стекла (тип I), вмонтированных в одноразовую шприц-ручку СолоСтар®. Картридж укупорен с одной стороны пробкой и обжат алюминиевым колпачком, с другой стороны — плунжером. По 5 шприц-ручек помещают в пачку картонную.
Производитель
1. Санофи-Авентис Дойчланд ГмбХ, Германия.
2. ЗАО «Санофи-Авентис Восток», Россия. 302516, Россия, Орловская обл., Орловский р-н, с/п Большекуликовское, ул. Ливенская, 1.
Претензии потребителей направлять по адресу представительства компании в России: 125009, Москва, ул. Тверская, 22.
Тел.: (495) 721-14-00; факс: (495) 721-14-11.
В случае производства препарата на ЗАО «Санофи-Авентис Восток», Россия, претензии потребителей направлять по адресу: 302516, Россия, Орловская обл., Орловский р-н, с/п Большекуликовское, ул. Ливенская, 1.
Тел./факс: +7 (486) 244-00-55.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Апидра® (Apidra) инструкция по применению
📜 Инструкция по применению Апидра®
💊 Состав препарата Апидра®
✅ Применение препарата Апидра®
📅 Условия хранения Апидра®
⏳ Срок годности Апидра®
⚠️ Государственная регистрация данного препарата отменена
Описание лекарственного препарата
Апидра®
(Apidra)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2011
года, дата обновления: 2021.08.17
Владелец регистрационного удостоверения:
Код ATX:
A10AB06
(Инсулин глулизин)
Лекарственная форма
| Апидра® |
Р-р д/п/к введения 100 ЕД/1 мл: картриджи 3 мл 5 шт. рег. №: ЛС-002064 |
Форма выпуска, упаковка и состав
препарата Апидра®
Раствор для п/к введения прозрачный, бесцветный.
Вспомогательные вещества: метакрезол (м-крезол) — 3.15 мг, трометамол (трометамин) — 6 мг, натрия хлорид — 5 мг, полисорбат 20 — 0.01 мг, натрия гидроксид — до pH 7.3, хлористоводородная кислота — до pH 7.3, вода д/и — до 1 мл.
3 мл — картриджи бесцветного стекла (5) — упаковки ячейковые контурные (1) — пачки картонные.
Фармакологическое действие
Инсулин глулизин является рекомбинантным аналогом человеческого инсулина, который по силе действия равен растворимому человеческому инсулину, но начинает действовать быстрее и имеет меньшую продолжительность действия.
Наиболее важным действием инсулина и аналогов инсулина, включая инсулин глулизин, является регуляция обмена глюкозы. Инсулин снижает концентрацию глюкозы в крови, стимулируя поглощение глюкозы периферическими тканями, особенно скелетной мускулатурой и жировой тканью, а также ингибируя образование глюкозы в печени. Инсулин подавляет липолиз в адипоцитах, протеолиз и увеличивает синтез белка. Исследования, проведенные у здоровых добровольцев и пациентов с сахарным диабетом, показали, что при п/к введении инсулин глулизин начинает действовать быстрее и имеет меньшую продолжительность действия, чем растворимый человеческий инсулин. При п/к введении гипогликемический эффект развивается через 10-20 мин. При в/в введении гипогликемические эффекты инсулина глулизина и растворимого человеческого инсулина являются равными по силе. Одна единица инсулина глулизина имеет такую же гипогликемическую активность, как и одна единица растворимого человеческого инсулина.
В исследовании фазы I у пациентов с сахарным диабетом 1 типа оценивались гипогликемические профили инсулина глулизина и растворимого человеческого инсулина, вводившихся п/к в дозе 0.15 МЕ/кг в разное время по отношению к стандартному 15-минутному приему пищи.
Результаты исследования показали, что инсулин глулизин, введенный за 2 мин до приема пищи, обеспечивал такой же контроль уровня глюкозы после еды, что и растворимый человеческий инсулин, введенный за 30 мин до приема пищи. При введении за 2 мин до приема пищи инсулин глулизин обеспечивал лучший контроль уровня глюкозы после еды, чем растворимый человеческий инсулин, введенный за 2 мин до приема пищи. Инсулин глулизин, введенный через 15 мин после начала приема пищи, давал такой же контроль уровня глюкозы после еды, что и растворимый человеческий инсулин, вводимый за 2 мин до приема пищи.
Ожирение
Исследование фазы I, проводившееся с инсулином глулизином, инсулином лизпро и растворимым человеческим инсулином у группы пациентов с ожирением, продемонстрировало, что у этих пациентов инсулин глулизин сохраняет время развития эффекта. В этом исследовании время достижения 20% от полного AUC составляло 114 мин для инсулина глулизина, 121 мин для инсулина лизпро и 150 мин для растворимого человеческого инсулина, а AUC0-2 ч, отражающее также раннюю гипогликемическую активность, составляло 427 мг × кг-1 для инсулина глулизина, 354 мг × кг-1 для инсулина лизпро, и 197 мг × кг-1 для растворимого человеческого инсулина.
Клинические исследования
Сахарный диабет типа 1
В 26-недельном клиническом исследовании фазы III, в котором проводилось сравнение инсулина глулизина с инсулином лизпро, вводившимися п/к незадолго до еды (за 0-15 мин) пациентам с сахарным диабетом типа 1, использующим в качестве базального инсулина инсулин гларгин, инсулин глулизин был сопоставим с инсулином лизпро в отношении контроля уровня глюкозы, который оценивался по изменению концентрации гликированного гемоглобина (HbA1С) на момент конечной точки исследования в сравнении с исходом. Наблюдались сопоставимые значения концентрации глюкозы в крови, определяемые путем самоконтроля. При введении инсулина глулизина в отличие от лечения инсулином лизпро не потребовалось повышения дозы базального инсулина.
12-недельное клиническое исследование III фазы, проведенное у пациентов с сахарным диабетом типа 1, получавших в качестве базальной терапии инсулин гларгин, показало, что эффективность введения инсулина глулизина непосредственно после еды была сопоставима с таковой при введении инсулина глулизина непосредственно перед приемом пищи (за 0-15 мин) или растворимого человеческого инсулина (за 30-45 мин до еды).
Среди пациентов, выполнивших протокол исследования, в группе пациентов, получавших перед едой инсулин глулизин, наблюдалось достоверно большее снижение HbA1С по сравнению с группой пациентов, получавших растворимый человеческий инсулин.
Сахарный диабет 2 типа
26-недельное клиническое исследование фазы III с последовавшим за ним 26-недельным продолжением в виде исследования безопасности было проведено сравнение инсулина глулизина (за 0-15 мин до приема пищи) с растворимым человеческим инсулином (за 30-45 мин приема пищи), которые вводились п/к пациентам с сахарным диабетом 2 типа, кроме этого использующих в качестве базального инсулин-изофан. Средний индекс массы тела пациентов составлял 34.55 кг/м2. Инсулин глулизин показал себя сопоставимым с растворимым человеческим инсулином в отношении изменений концентраций HbA1С через 6 мес лечения по сравнению с исходом (-0.46% для инсулина глулизина и -0.30% для растворимого человеческого инсулина, p=0.0029) и через 12 мес лечения по сравнению с исходом (-0.23% для инсулина глулизина и -0.13% для растворимого человеческого инсулина, различие не достоверно). В этом исследовании большинство пациентов (79%) смешивали свой инсулин короткого действия с инсулин-изофаном непосредственно перед инъекцией. 58 пациентов на момент рандомизации использовали пероральные гипогликемические препараты и получили инструкции по продолжению их использования в той же дозе.
Расовое происхождение и пол
В контролируемых клинических исследованиях у взрослых не было показано различий в безопасности и эффективности инсулина глулизина при анализе подгрупп, выделенных по расовому происхождению и полу.
Фармакокинетика
В инсулине глулизине замещение аминокислоты аспарагин человеческого инсулина в позиции В3 на лизин и лизина в позиции В29 на глутаминовую кислоту способствует более быстрой абсорбции его из места инъекции.
Абсорбция и биодоступность
Фармакокинетические кривые концентрация-время у здоровых добровольцев и пациентов с сахарным диабетом 1 и 2 типа продемонстрировали, что абсорбция инсулина глулизина по сравнению с растворимым человеческим инсулином была приблизительно в 2 раза быстрее с достижением приблизительно до 2 раз большей максимальной концентрации.
В исследовании, проведенном у пациентов с сахарным диабетом 1 типа, после п/к введения инсулина глулизина в дозе 0.15 МЕ/кг Сmax достигалась через 55 мин и составляла 82±1.3 микроМЕ/мл по сравнению с Cmax растворимого человеческого инсулина, которая достигалась через 82 мин и составляла 46±1.3 микроМЕ/мл. Среднее время пребывания в системном кровотоке у инсулина глулизина было короче (98 мин), чем у растворимого человеческого инсулина (161 мин). В исследовании у пациентов с сахарным диабетом 2 типа после п/к введения инсулина глулизина в дозе 0.2 МЕ/кг Сmax составляла 91 микроМЕ/мл (от 78 до 104 микроМЕ/мл).
При п/к введении инсулина глулизина в переднюю брюшную стенку, бедро или плечо (область дельтовидной мышцы) абсорбция была более быстрой при введении в переднюю брюшную стенку по сравнению с введением препарата в бедро. Скорость абсорбции из области дельтовидной мышцы была промежуточной. Абсолютная биодоступность инсулина глулизина (70%) в разных местах введения была подобной и имела низкую вариабельность между разными пациентами (коэффициент вариации — 11%).
Распределение и выведение
Распределение и выведение инсулина глулизина и растворимого человеческого инсулина после в/в введения являются подобными; Vd составляет 13 л и 22 л, T1/2 — 13 и 18 мин соответственно.
После п/к введения инсулин глулизин выводится быстрее, чем растворимый человеческий инсулин: при этом T1/2 равен 42 мин по сравнению с T1/2 растворимого человеческого инсулина 86 мин. При перекрестном анализе исследований инсулина глулизина, как у здоровых лиц, так и у лиц с сахарным диабетом 1 и 2 типа, T1/2 находился в диапазоне от 37 до 75 мин.
Фармакокинетика в особых клинических случаях
В клиническом исследовании, проведенном у лиц без сахарного диабета с широким диапазоном функционального состояния почек (КК более 80 мл/мин, 30-50 мл/мин, менее 30 мл/мин), быстрота наступления эффекта инсулина глулизина в целом сохранялась. Однако потребность в инсулине при почечной недостаточности может быть снижена.
У пациентов с нарушениями функции печени фармакокинетические показатели не изучались.
Имеются очень ограниченные данные по фармакокинетике инсулина глулизина у пожилых пациентов с сахарным диабетом.
Фармакокинетические и фармакодинамические свойства инсулина глулизина были исследованы у детей (7-11 лет) и подростков (12-16 лет) с сахарным диабетом 1 типа. В обеих возрастных группах инсулин глулизин быстро абсорбируется, при этом время достижения и величина Сmax подобны таковым у взрослых. Как и у взрослых при введении непосредственно перед тестом с приемом пищи инсулин глулизин обеспечивает лучший контроль глюкозы крови после еды, чем растворимый человеческий инсулин. Повышение концентрации глюкозы в крови после еды (AUC0-6 ч) составляло 641 мг×час×дл-1 для инсулина глулизина и 801 мг×час×дл-1 для растворимого человеческого инсулина.
Показания препарата
Апидра®
- сахарный диабет, требующий лечения инсулином, у взрослых, подростков и детей в возрасте старше 6 лет.
Режим дозирования
Препарат Апидра® следует вводить незадолго (за 0-15 мин) до или вскоре после приема пищи.
Препарат Апидра® следует применять в схемах терапии, включающих в себя или инсулин средней продолжительности действия или инсулин или аналог инсулина длительного действия. Препарат можно применять в сочетании с пероральными гипогликемическими средствами.
Режим дозирования препарата Апидра® подбирается индивидуально.
При почечной недостаточности возможно снижение потребности в инсулине.
У пациентов с нарушением функции печени возможно снижение потребности в инсулине из-за сниженной способности к глюконеогенезу и замедлению метаболизма инсулина.
Имеющиеся данные по фармакокинетике у пациентов пожилого возраста с сахарным диабетом, недостаточны. Нарушение функции почек в пожилом возрасте может привести к снижению потребности в инсулине.
Препарат Апидра® можно применять у детей старше 6 лет и подростков. Клиническая информация по применению препарата у детей моложе 6 лет ограничена.
Введение препарата
Препарат Апидра® вводят или путем п/к инъекции или путем непрерывной инфузии в подкожно-жировую клетчатку с помощью помповой системы.
П/к инъекции следует производить в область живота, плеча или бедра, а введение препарата путем непрерывной инфузии в подкожно-жировую клетчатку производится в области живота. Места инъекций и инфузий в вышеупомянутых областях (живот, бедро или плечо) следует чередовать при каждом новом введении препарата. На скорость абсорбции и, соответственно, на начало и продолжительность действия могут влиять место введения, физическая нагрузка и другие изменяющиеся условия. П/к введение в брюшную стенку обеспечивает несколько более быструю абсорбцию, чем введение в другие вышеуказанные участки тела.
Следует соблюдать меры предосторожности для исключения попадания препарата непосредственно в кровеносные сосуды. После введения препарата нельзя производить массаж области введения. Пациенты должны быть обучены правильной технике проведения инъекций.
Смешивание с инсулинами
Препарат Апидра® нельзя смешивать ни с какими другими препаратами, кроме человеческого инсулина-изофана.
Помповое устройство для проведения непрерывной п/к инфузии
При использовании препарата Апидра® с помповой системой для инфузии инсулина его нельзя смешивать с другими лекарственными средствами.
Правила использования препарата
Т.к. препарат Апидра® является раствором, проведения ресуспендирования перед его использованием не требуется.
Смешивание с инсулинами
При смешивании с человеческим инсулином-изофаном препарат Апидра® набирают в шприц первым. Инъекцию следует проводить сразу же после смешивания, т.к. отсутствуют данные по применению смесей, приготовленных задолго до инъекции.
Картриджи
Картриджи следует использовать вместе с инсулиновой шприц-ручкой, такой как ОптиПен Про1, и в соответствии с рекомендациями в инструкции, предоставленной производителем устройства.
Инструкции производителя по использованию шприц-ручки ОптиПен Про1 относительно загрузки картриджа, присоединения иглы и проведения инъекции инсулина должны точно выполняться. Перед использованием картридж следует осмотреть и использовать только в том случае, если раствор является прозрачным, бесцветным, не содержащим видимых твердых частиц. Перед установкой картриджа в шприц-ручку многоразового использования предварительно картридж должен 1-2 ч находиться при комнатной температуре. Перед проведением инъекции из картриджа следует удалить пузырьки воздуха. Пустые картриджи заполнять повторно нельзя. Если шприц-ручка ОптиПен Про1 повреждена, ее нельзя использовать.
Если шприц-ручка неисправна, раствор может быть набран из картриджа в пластиковый шприц, подходящий для инсулина в концентрации 100 МЕ/мл, и введен пациенту.
Для предупреждения инфицирования шприц-ручку многоразового использования следует применять только для одного больного.
Картриджная система ОптиКлик
Картриджная система ОптиКлик представляет собой стеклянный картридж, содержащий 3 мл раствора инсулина глулизина, который фиксирован в прозрачный пластиковый контейнер с присоединенным поршневым механизмом.
Картриджную систему ОптиКлик следует использовать вместе со шприц-ручкой ОптиКлик в соответствии с рекомендациями инструкции, предоставленной производителем устройства.
Инструкции производителя по пользованию шприц-ручкой ОптиКлик (относительно загрузки картриджной системы, подсоединения иглы и проведения инъекции инсулина) следует точно выполнять.
Если шприц-ручка ОптиКлик повреждена или работает неправильно (в результате механического дефекта), ее следует заменить на исправную.
Перед установкой картриджной системы необходимо, чтобы шприц-ручка ОптиКлик в течение 1-2 ч находилась при комнатной температуре. Осмотреть картриджную систему перед установкой. Ее следует использовать только в том случае, если раствор является прозрачным, бесцветным, не содержащим видимых твердых частиц. Перед проведением инъекции из картриджной системы следует удалить пузырьки воздуха. Пустые картриджи заполнять повторно нельзя.
Если шприц-ручка не исправна, раствор можно набирать из картриджной системы в пластиковый шприц, подходящий для инсулина в концентрации 100 МЕ/мл, и введен пациенту.
Для предупреждения инфицирования шприц-ручку многоразового использования следует применять только у одного больного.
Побочное действие
Гипогликемия — наиболее частый нежелательный эффект инсулинотерапии, который может возникать в случае применения слишком высоких доз инсулина, превышающих потребность в нем.
Наблюдавшиеся в клинических исследованиях неблагоприятные реакции, связанные с введением препарата, перечислены ниже по системам органов и в порядке уменьшения частоты возникновения. При описании частоты встречаемости используются следующие критерии: очень часто (> 10%); часто (> 1% и < 10%); иногда (> 0.1% и < 1%); редко (> 0.01% и < 0.1%); очень редко (< 0.01%).
Со стороны обмена веществ: очень часто — гипогликемия. Симптомы развития гипогликемии обычно возникают внезапно. К ним относятся появление холодного пота, бледность кожных покровов, чувство усталости, нервное возбуждение или тремор, беспокойство, слабость, спутанность сознания, затруднение концентрации внимания, сонливость, чрезмерное чувство голода, зрительные расстройства, головная боль, тошнота и выраженное сердцебиение. Гипогликемия может нарастать, что может вести к потере сознания и/или к появлению судорог, а также к временному или постоянному ухудшению функции мозга или даже к летальному исходу.
Местные реакции: часто — местные реакции повышенной чувствительности (гиперемия, отечность и зуд в месте инъекции). Эти реакции обычно являются преходящими и исчезают при продолжении лечения. Редко — липодистрофия (в результате нарушения чередования мест введения инсулина в какую-либо из областей /введение препарата в одно и то же место/).
Аллергические реакции: иногда — крапивница, чувство стесненности в груди, удушье, аллергический дерматит, зуд. Тяжелые случаи генерализованных аллергических реакций (включая анафилактические) могут быть опасными для жизни.
Противопоказания к применению
- гипогликемия;
- повышенная чувствительность к инсулину глулизину или к какому-либо из компонентов препарата.
С осторожностью следует применять при беременности.
Применение при беременности и кормлении грудью
При назначении препарата при беременности следует соблюдать осторожность. Обязателен тщательный мониторинг уровня глюкозы в крови. Клинические данные по применению инсулина глулизина при беременности отсутствуют.
Пациенткам с сахарным диабетом (в т.ч. гестационным) необходимо в течение всей беременности поддерживать оптимальный метаболический контроль. В I триместре беременности потребность в инсулине может уменьшаться, а во II и III триместрах она, как правило, может увеличиваться. Сразу же после родов потребность в инсулине быстро снижается.
Репродуктивные исследования на животных не выявили каких-либо различий между влиянием применения инсулина глулизина и человеческого инсулина на течение беременности, развитие эмбриона и плода, роды и постнатальное развитие.
Неизвестно, выделяется ли инсулин глулизин с грудным молоком, но человеческий инсулин не выделяется с грудным молоком и не абсорбируется при приеме внутрь.
В период лактации (грудного вскармливания) может потребоваться коррекция доз инсулина и диеты.
Применение при нарушениях функции печени
У пациентов с нарушением функции печени возможно снижение потребности в инсулине из-за сниженной способности к глюконеогенезу и замедлению метаболизма инсулина.
Применение при нарушениях функции почек
При почечной недостаточности возможно снижение потребности в инсулине.
Применение у детей
Препарат Апидра® можно применять у детей старше 6 лет и подростков. Клиническая информация по применению препарата у детей моложе 6 лет ограничена.
Применение у пожилых пациентов
Имеющиеся данные по фармакокинетике упациентов пожилого возраста с сахарным диабетом, недостаточны. Нарушение функции почек в пожилом возрасте может привести к снижению потребности в инсулине.
Особые указания
Перевод пациента на новый тип инсулина или инсулин другого производителя должен осуществляться под строгим медицинским наблюдением, т.к. может потребоваться коррекция всей проводимой терапии. Использование неадекватных доз инсулина или прекращение лечения, особенно у пациентов с сахарным диабетом типа 1, может привести к развитию гипергликемии и диабетического кетоацидоза — состояний, которые являются потенциально опасными для жизни.
Время возможного развития гипогликемии зависит от скорости наступления эффекта используемых инсулинов и, в связи с этим, может изменяться при изменении схемы лечения. К условиям, которые могут изменить или сделать менее выраженными предвестники развития гипогликемии, относятся длительное существование сахарного диабета, интенсификация инсулинотерапии, наличие диабетической невропатии, прием некоторых лекарственных препаратов (таких как бета-адреноблокаторы), или перевод пациента с инсулина животного происхождения на человеческий инсулин.
Коррекция доз инсулина может также потребоваться при смене режима двигательной активности или приемов пищи. Физическая нагрузка, выполненная непосредственно после еды, может увеличить риск развития гипогликемии. По сравнению с растворимым человеческим инсулином после инъекции быстродействующих аналогов инсулина гипогликемия может развиться раньше.
Некомпенсированные гипогликемическая или гипергликемическая реакции могут привести к потере сознания, развитию комы или смертельному исходу.
Потребность в инсулине может изменяться при сопутствующих заболеваниях или эмоциональных перегрузках.
Передозировка
Симптомы: отсутствуют специальные данные по передозировке инсулина глулизина; возможно развитие гипогликемии различной степени тяжести.
Лечение: эпизоды легкой гипогликемии могут быть купированы с помощью приема глюкозы или продуктов, содержащих сахар. Поэтому рекомендуется, чтобы пациенты с сахарным диабетом постоянно имели при себе кусочки сахара, конфеты, печенье или сладкий фруктовый сок. Эпизоды тяжелой гипогликемии, во время которых пациент теряет сознание, могут быть купированы в/м или п/к введением 0.5-1 мг глюкагона или в/в введением декстрозы (глюкозы) Если пациент не реагирует на введение глюкагона в течение 10-15 мин, необходимо также вводить декстрозу в/в. После восстановления сознания рекомендуется давать пациенту углеводы внутрь для предотвращения повторения гипогликемии. После введения глюкагона для установления причины этой тяжелой гипогликемии и предотвращения развития других подобных эпизодов пациент должен наблюдаться в стационаре.
Лекарственное взаимодействие
Исследований по фармакокинетическому лекарственному взаимодействию препарата не проводилось. На основании имеющихся эмпирических знаний в отношении других подобных лекарственных препаратов возникновение клинически значимого фармакокинетического взаимодействия маловероятно. Некоторые вещества могут влиять на метаболизм глюкозы, что может потребовать коррекции доз инсулина глулизина и особенно тщательного контроля проводимой терапии и состояния пациента.
При совместном применении пероральные гипогликемические средства, ингибиторы АПФ, дизопирамид, фибраты, флуоксетин, ингибиторы МАО, пентоксифиллин, пропоксифен, салицилаты и сульфаниламидные противомикробные средства могут усиливать гипогликемическое действие инсулина и повышать предрасположенность к гипогликемии.
При совместном применении ГКС, даназол, диазоксид, диуретики, изониазид, производные фенотиазина, соматропин, симпатомиметики (например, эпинефрин /адреналин/, сальбутамол, тербуталин), гормоны щитовидной железы, эстрогены, прогестины (например, пероральные контрацептивы), ингибиторы протеазы и антипсихотические лекарственные средства (например, оланзапин и клозапин) могут уменьшать гипогликемическое действие инсулина.
Бета-адреноблокаторы, клонидин, соли лития или этанол могут или потенцировать или ослаблять гипогликемическое действие инсулина. Пентамидин может вызывать гипогликемию c последующей гипергликемией.
При применении препаратов с симпатолитической активностью (бета-адреноблокаторы, клонидин, гуанетидин и резерпин) симптомы рефлекторной адренергической активации при гипогликемии могут быть менее выраженными или отсутствовать.
Фармацевтическое взаимодействие
В связи с отсутствием исследований совместимости инсулин глулизин не следует смешивать с какими-либо другими препаратами за исключением человеческого инсулина-изофана.
При введении с помощью инфузионной помпы препарат Апидра® не должен смешиваться с другими препаратами.
Условия хранения препарата Апидра®
Картриджи и картриджные системы ОптиКлик следует хранить в недоступном для детей, защищенном от света месте при температуре от 2° до 8°C, не замораживать.
После начала использования картриджи и картриджные системы ОптиКлик следует хранить в недоступном для детей, защищенном от света месте при температуре не выше 25°C.
Для защиты от воздействия света следует хранить картриджи и картриджные системы ОптиКлик в собственной картонной упаковке.
Срок годности препарата Апидра®
Срок годности — 2 года. Срок годности препарата в картридже, картриджной системе ОптиКлик после первого использования — 4 недели. Рекомендуется отмечать на этикетке дату первого забора препарата.
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Состав
1 миллилитр препарата Апидра СолоСтар включает 100 ЕД (3,49 мг) инсулина глулизина.
Дополнительно: хлористоводородная кислота, метакрезол, хлорид натрия, трометамин, полисорбат 20, натрия гидроксид, вода д/ин.
Форма выпуска
Апидра СолоСтар выпускается в форме инъекционного (для п/к введения) раствора в картриджах по 3 мл, вмонтированных в шприц-ручки, по 5 штук во вторичной упаковке.
Фармакологическое действие
Гипогликемическое.
Фармакодинамика и фармакокинетика
Инсулин глулизин, являющийся активным ингредиентом препарата Апидра, по сути — рекомбинантный аналог инсулина человека, по силе своего действия равноценный эндогенному человеческому инсулину. В сравнении с растворимым инсулином человека действие данного аналога развивается быстрее, а продолжительность его влияния несколько короче.
Основополагающим действием инсулина, как и его препаратов аналогов, в том числе и инсулина глулизина, является регулирование глюкозного обмена. Эффекты данной группы препаратов направлены на понижение концентрации плазменной глюкозы, активизации ее усваивания периферическими тканями (в особенности жировой тканью и скелетной мускулатурой), а также на подавление формирования глюкозы в печеночной ткани. В адипоцитах препарат угнетает липолиз, тормозит процесс протеолиза и повышает синтез белков. Проведенные исследования с привлечением больных сахарным диабетом и здоровых добровольцев подтвердили более быстрое наступление эффектов Апидры при п/к введении, а также менее продолжительное ее действие, в сравнении с растворимым человеческим инсулином. При п/к способе введения гипогликемическая эффективность данного препарата наблюдается уже через 10-20 минут. При сравнении в/в инъекций растворимого инсулина человека и инсулина глулизина эффекты обоих препаратов остаются на одном уровне. Глюкозопонижающая активность одной единицы обоих препаратов полностью совпадает.
В 1-ой фазе проводимых исследований с привлечением больных с инсулинозависимым сахарным диабетом была проведена оценка глюкозопонижающих способностей растворимого инсулина человека и инсулина глулизина при п/к инъекциях в дозе 0,15 ЕД/кг, вводимых в различное время в отношении стандартного 15-минутного приема пищи. По итогам исследований было выяснено, что введение Апидры за 2 минуты до еды оказывало такой же гликемический эффект, как и введение человеческого инсулина за полчаса до приема пищи. В случае введения обоих этих препаратов за 2 минуты до еды, лучшие показатели гликемического контроля наблюдались в отношении инсулина глулизина. Инъекция Апидры, проведенная через 15 минут после начала еды давала тот же гликемический результат, что введение человеческого аналога за 2 минуты до приема пищи.
В 1-ой фазе проводимых исследований между инсулином лизпро, инсулином глулизином и растворимым инсулином человека с привлечением пациентов с ожирением было доказано сохранение быстрой эффективности Апидры. В процессе проведения данного исследования, период достижения 20% порога от полного AUC соответственно для инсулина глулизина/инсулина лизпро/человеческого инсулина составлял 114/121/150 минут, a AUC (0-2 часа), также отображающее раннее глюкозопонижающее действие, равнялось соответственно 427мг/кг/354мг/кг/197мг/кг.
В 3-ей фазе проведенного 26-недельного клинического исследования между инсулином глулизином и инсулином лизпро, которые вводились п/к незадолго (0-15 минут) до еды пациентам с ювенильным диабетом, применяющим в качестве фонового препарата – инсулин гларгин, выяснено, что эффекты обоих этих лекарственных средств были сопоставимы в отношении контроля гликемии, оценивающегося по отклонениям содержания HbA1C (гликозилированного гемоглобина) в конечной стадии исследования, сравнительно с начальной стадией. Отмечались сопоставимые параметры плазменной глюкозы, фиксируемые путем самоконтроля. В случае инъекций инсулина глулизин, по сравнению с введением инсулина лизпро, увеличение дозировок фонового препарата не требовалось.
В 3-ей фазе проведенного 12-недельного клинического исследования у больных с инсулинозависимым сахарным диабетом, проходивших фоновое лечение инсулином гларгин, доказана эффективность инсулина глулизина, введенного сразу после еды, не уступающая таковой при его же введении перед самим (0-15 минут) приемом пищи или инъекции растворимого инсулина человека, проведенной за 30-45 минут до еды.
В исследуемой группе пациентов, которая получала инсулин глулизин перед едой, было отмечено более значимое снижение HbA1C, в сравнении с пациентами, находившимися в группе применения человеческого аналога.
В 3-ей фазе проведенного 26-недельного клинического исследования с последующим 26-недельным тестированием безопасности, сравнивали инсулин глулизин, вводимый п/к за 0-15 минут до еды и растворимый инсулин человека, вводимый п/к за 30-45 минут до приема пищи, с привлечением пациентов с инсулинонезависимым диабетом, получавших дополнительно в качестве фонового препарата – инсулин-изофан. Показатели среднего индекса веса пациентов равнялись 34,55 кг/ м2. Более значимое снижение содержания HbA1C (-0,46%) наблюдалось у пациентов из группы инсулин глулизина, в сравнении с группой человеческого инсулина (-0,30%). В данном исследовании большинство больных (79%) непосредственно перед введением комбинировали свой короткодействующий препарат с инсулином-изофаном. 58 исследуемых людей на момент рандомизации принимали пероральные гипогликемические средства и продолжали их прием в неизменной дозе.
В случае проведения непрерывного п/к инфузионного вливания инсулина с использованием помпового устройства (относительно ювенильного диабета) у 59-ти больных, применявших препараты Апидра или Аспарт отмечали невысокую частоту окклюзии катетера, для препарата Апидра – 0,08 окклюзий в 30 суток, для препарата Аспарт – 0,15 окклюзий за тот же период, а также подобную частоту негативных реакций в месте инъекции, соответственно 10,3% и 13,3%.
В детской возрастной группе с инсулинозависимым диабетом, при сравнении безопасности и эффективности введения в качестве фонового препарата – инсулина гларгина (однократно в 24 часа вечером) или инсулин-изофана (дважды в день утром и вечером) с п/к введением инсулина лизпро и инсулина глулизина (за 15 минут до еды), в обеих группах были выявлены сопоставимые показатели гликемического контроля, частоты серьезных гипогликемических эпизодов и частоты формирования гипогликемии, требовавшей постороннего вмешательства. При этом после проведения терапии на протяжении 26 недель, в группе применения Апидры, для получения гликемического контроля требовалось значимо меньшее повышение суточных дозировок быстродействующего инсулина, фонового препарата и суммарной инсулиновой дозы, в сравнении с группой использующей инсулин лизпро.
При проведении клинических тестирований у взрослых пациентов, каких-либо различий в эффективности и безопасности использования Апидры больными разных полов и различных рас выявлено не было.
При применении Апидры процессы замены аминокислоты аспарагин инсулина человека на лизин в позиции ВЗ, а также лизина на глутаминовую кислоту в позиции В29, способствуют быстрейшей абсорбции препарата.
AUC препарата во всех группах пациентов (здоровых добровольцев и больных, страдающих 1 и 2 типом сахарного диабета) показала превосходящую вдвое абсорбцию и Cmax Апидры в сравнении с растворимым инсулином человека.
При проведении исследований с привлечением пациентов с ювенильным диабетом, после п/к инъекции 0,15 ЕД/кг Апидры его Cmax достигалось на протяжении 55-ти минут и равнялась 82±1,3 мкЕД/мл, тогда как данные параметры для человеческого аналога соответственно составляли 46±1,3 мкЕД/мл и 82 минуты. Средняя продолжительность нахождения инсулина глулизина в системном кровотоке была меньше (98 мин), чем у инсулина человека (161 мин).
При проведении исследований с привлечением пациентов с инсулиннезависимым диабетом, после п/к инъекции 0,2 ЕД/кг Апидры, средняя Cmax ее активного ингредиента равнялась 91 мкЕД/мл (в диапазоне 78-104 мкЕД/мл).
Абсорбция препарата, в случае п/к инъекции Апидры, проводимой в область бедра была самой низкой и возрастала при введении препарата в область плеча. Самая высокая абсорбция наблюдалась при инъекционном введении в район передней брюшной стенки. При п/к введении абсолютная биодоступность препарата Апидра равнялась примерно 70% (бедро – 68%; плечо – 71%; брюшная стенка – 73%) и характеризовалась низкой вариабельностью у разных больных.
При в/в введении распределение инсулина глулизина и его последующее выведение схоже с таковыми параметрами для растворимого инсулина человека и составляет соответственно: Vd – 13 литра и 22 литра; T1/2 – 13 минут и 18 минут. При п/к инъекции выведение инсулина глулизина происходит быстрее (с T1/2 – 42 минуты) в сравнении с человеческим аналогом (с T1/2 – 86 минут). При проведении перекрестного анализа результатов исследований и тестирований инсулина глулизина, включая здоровых добровольцев и больных с 1 и 2 типом диабета, кажущийся T1/2 данного препарата находился в интервале 37-75 минут.
Проведенное исследование с привлечением лиц без сахарного диабета, но имеющих почечные патологии различной степени выраженности (при КК больше 80 мл/мин, 30-50 мл/мин и меньше 30 мл/мин) показало сохранение среднего параметра быстроты действия Апидры. Однако при патологиях почек допускают сниженную потребность в применении инсулина.
При патологиях печени изучение фармакокинетических показателей Апидры не проводилось.
Влияние пожилого возраста пациента на фармакокинетические особенности Апидры до конца не изучено.
Фармакодинамику и фармакокинетику Апидры исследовали в детских возрастных группах пациентов с инсулинозависимым диабетом 7-11 лет и 12-16 лет. Показатели абсорбции, Тmax и Cmax препарата в обеих этих группах были сопоставимы с таковыми для взрослых пациентов. При инъекции Апидры непосредственно перед тестированием с приемом пищи, наблюдается лучший контроль плазменной глюкозы после еды в сравнении с человеческим инсулином. Увеличение содержания плазменной глюкозы после еды (AUC0-6 часов) равнялось для Апидры – 641 мг/ч×дл, для растворимого инсулина человека – 801 мг/ч×дл.
Показания к применению
Назначение инсулина Апидра показано пациентам старше 6-ти лет при ювенильном (инсулинозависимом) диабете.
Противопоказания
Применение препарата Апидра Солостар противопоказано при гипогликемии и персональной гиперчувствительности.
Побочные действия
Отмечающиеся негативные проявления при использовании препарата Апидра были реакциями, характерными для данного фармакологического класса препаратов, а значит и для всех существующих инсулинов.
Самым значимым отрицательным проявлением инсулинотерапии, наблюдаемым со стороны системы обмена веществ, является гипогликемия, которая чаще всего возникает при необоснованном использовании завышенных дозировок инсулина.
Симптоматика гипогликемии, как правило, появляется внезапно. Тем не менее, нарушениям психоневрологического характера, образующимся на фоне нейрогликопении (необычная слабость или утомляемость, головные боли, чувство усталости, снижение концентрации, зрительные расстройства, сонливость, судорожный синдром, тошнота, спутанность/потеря сознания) предшествуют проявлению адренергической контррегуляции (раздражительность, чувство голода, нервное возбуждение, бледность кожи, тремор, холодный пот, беспокойство, тахикардия, сильное сердцебиение). Тяжесть данной симптоматики зависит от быстроты и тяжести развивающейся гипогликемии.
Повторяющиеся тяжелые эпизоды гипогликемии могут стать причиной поражения или расстройств нервной системы. Выраженная и продолжительная гипогликемия может быть опасна для жизни пациентов, так как нарастание ее симптомов может привести к смертельному исходу.
Реакции иммунной системы могут проявляться местными явлениями персональной гиперчувствительности к Апидре (включая гиперемию, ощущение зуда и отечность в месте проведения инъекции). Данные явления, как правило, самостоятельно нивелируются по прошествии нескольких суток после проведения инъекции. В некоторых случаях подобная симптоматика проявляется не от влияния инсулина, а от раздражения кожных покровов, вследствие их прединъекционной антисептической обработки, а также по причине неправильного проведения п/к инъекции.
Системные проявления персональной гиперчувствительности на препарат Апидра могут сопровождаться формированием сыпи (возможно с зудом) по всему телу, ощущением стесненности в груди, снижением АД, удушьем, учащением пульса или гипергидрозом. Тяжелые эпизоды генерализованной аллергии, в том числе и анафилактические явления, могут быть опасны для жизни.
Негативные реакции со стороны кожных покровов обычно ограничиваются липодистрофией, способной, тем не менее, снизить абсорбцию инсулина глулизина. К формированию липодистрофии могут привести частые инъекции в одно и то же место, без смены областей введения препарата, в связи с чем рекомендуется частая смена мест проведения инъекции (бедро, брюшная стенка, плечо), с целью предупреждения развития липодистрофии.
Апидра, инструкция по применению (Способ и дозировка)
Инсулин Апидра СолоСтар предназначен для п/к введения, проводимого незадолго до (0-15 минут) или сразу после еды.
Данный препарат должен применяться в терапевтических схемах, включающих совместное использование инсулина длительной (возможно аналога) или средней продолжительной эффективности, а также параллельно с пероральными препаратами гипогликемического действия.
Дозировочный режим Апидры определяется индивидуально.
Введение Апидры СолоСтар осуществляется с помощью проведения п/к инъекции, или посредством непрерывной инфузии, выполняемой в подкожно-жировую клетчатку с использованием помповой системы.
Инъекционное п/к введение проводят в область плеча, брюшной стенки (передней части) или бедра. Инфузионное введение выполняют в подкожно-жировую клетчатку в район брюшной стенки (передней части). Места п/к введения (бедро, брюшная стенка, плечо) следует чередовать при каждой последующей инъекции. На быстроту абсорбции и длительность воздействия препарата могут влиять факторы выполняемой физической нагрузки, прочие изменяющиеся условия, а также место введения. Инъекция в брюшную стенку отличается более быстрым временем абсорбции в сравнении с введением в бедро или плечо.
При проведении инъекции необходимо соблюдать все возможные меры предосторожности с целью исключения введения препарата непосредственно в сосуды кровеносной системы. После проведения инъекции запрещается осуществлять массаж в районах введения. Все пациенты, использующие Апидру СолоСтар, обязаны пройти консультацию по проведению правильной техники введения инсулина.
Смешивание Апидры СолоСтар допускается только с человеческим инсулином-изофаном. В процессе смешивании данных препаратов Апидру необходимо набирать в шприц в первую очередь. П/к введение следует осуществлять сразу же после процесса смешивания. В/в инъекции смешанных препаратов проводить нельзя.
При необходимости раствор препарата можно извлечь из картриджа, включенного в шприц-ручку и использовать в помповом устройстве, предназначенном для непрерывного проведения п/к инфузии. В случае введения Апидры СолоСтар при помощи помповой инфузионной системы, его смешивание с любыми прочими препаратами не допускается.
При использовании инфузионного набор и резервуара, применяемого с препаратом Апидра, их следует менять как минимум через 48 часов с соблюдением всех правил асептики. Данные рекомендации могут быть отличны от прописанных в общих инструкциях к помповым устройствам, тем не менее, их исполнение очень важно для правильного проведения инфузии и предупреждения формирования тяжелых негативных последствий.
Пациенты, проходящие процедуру введения Апидры п/к инфузионным непрерывным путем, должны иметь при себе альтернативные инъекционные системы введения препарата, а также быть обучены правильным методам его применения (на случай повреждения помпового устройства).
При проведении непрерывной инфузии препаратом Апидра, неисправность инфузионного помпового набора, нарушение его работы, а также ошибки в манипуляциях с ними могут очень быстро стать причиной формирования гипергликемии, диабетического кетоацидоза и кетоза. В случае обнаружения данных проявлений необходимо срочно установить причину их развития и устранить ее.
Использование шприц-ручки СолоСтар с препаратом Апидра
Перед первым применением, шприц-ручку СолоСтар необходимо подержать 1-2 часа при комнатной температуре.
Непосредственно перед использованием шприц-ручки следует внимательно осмотреть помещенный в нее картридж, содержимое которого должно быть бесцветным, прозрачным и не включать видимых твердых посторонних включений (напоминать по консистенции воду).
Использованные шприц-ручки СолоСтар не могут применяться повторно и должны быть утилизированы.
Для предупреждения возможного инфицирования одну шприц-ручку может использовать только один человек, не передавая ее другому лицу.
При каждом новом использовании шприц-ручки необходимо осторожно подсоединить к ней новую иглу (исключительно совместимую с СолоСтар) и провести тестирование на безопасность.
При манипуляциях с иглой следует быть предельно осторожным во избежание травмирования и возможности инфекционного переноса.
Следует избегать использования шприц-ручек при наличия у них повреждений, а также в случаях неуверенности в их работе надлежащим образом.
Всегда необходимо иметь в запасе запасную шприц-ручку, на случай потери или повреждения первой.
Шприц-ручка должна быть защищена от грязи и пыли, допустимо протирать ее внешние части влажной тканью. Не рекомендуют погружать шприц-ручку в жидкость, мыть или смазывать, поскольку это может привести к ее повреждению.
Исправная шприц-ручка СолоСтар безопасна в работе, отличается точным дозированием раствора и требует осторожного обращения. При проведении всех манипуляций со шприц-ручкой необходимо избегать любых ситуаций, которые могут привести к ее повреждению. В случае каких-либо подозрений в ее исправности следует использовать другую шприц-ручку.
Непосредственно перед проведением инъекции необходимо удостовериться в соответствии рекомендованного инсулина, проверив маркировку на этикетке шприц-ручки. После удаления колпачка со шприц-ручки нужно провести визуальный контроль ее содержимого, после чего установить иглу. К введению допускается только бесцветный, прозрачный, напоминающий по консистенции воду и не включающий каких-либо посторонних твердых включений раствор инсулина. Для каждого последующего введения следует использовать новую иглу, которая должна быть стерильной и соответствовать шприц-ручке.
Перед проведением инъекции обязательно осуществляют тестирование на безопасность, проверяют правильность работы шприц-ручки и установленной на нее иглы, а также удаляют из раствора пузырьки воздуха (при их наличии).
Для этого при снятом наружном и внутреннем колпачках иглы отмеряют дозу раствора, равную 2 ЕД. Направляя иглу шприц-ручки строго вверх, аккуратно постукивают пальцем по картриджу, стараясь сместить все пузырьки воздуха к установленной игле. Надавливают на кнопку, предназначенную для введения препарата. В случае его появления на кончике иглы можно считать, что шприц-ручка работает как положено. Если этого не происходит, повторяют вышеописанные манипуляции вплоть до достижения желаемого результата.
После проведения тестирования на безопасность дозировочное окошко шприца-ручки должно показывать значение «0», после чего можно установить необходимую дозировку. Вводимая доза препарата должна быть отмерена с точностью до 1 ЕД, в диапазоне дозировок от 1 ЕД (минимальная) до 80 ЕД (максимальная). При необходимости введения дозы сверх 80 ЕД проводят две или больше инъекций.
При проведении инъекции иглу, установленную на шприц-ручку, необходимо аккуратно ввести под кожу. Кнопка шприц-ручки, предназначенная для введения раствора, должна быть полностью нажата и до извлечения иглы оставаться в таком положении на протяжении 10 секунд, что обеспечивает полное введение установленной дозы лекарственного средства.
После проведения инъекции следует удалить и выбросить иглу. Таким образом, обеспечивается предупреждение внесения инфекции и/или загрязнения шприца-ручки, а также утечки препарата и попадания в картридж воздуха. После удаления использованной иглы, шприц-ручку СолоСтар следует закрыть колпачком.
При удалении и утилизации иглы необходимо руководствоваться специальными правилами и методами (например, техникой установки колпачка иглы одной рукой), с целью снижения риска возможных несчастных случаев, а также предотвращения инфицирования.
Передозировка
В случае избыточного введения инсулина может возникнуть гипогликемия.
При легкой гипогликемии, ее негативные проявления можно купировать употреблением в пищу сахаросодержащих продуктов или глюкозы. Пациентам с сахарным диабетом рекомендуют всегда иметь при себе печенье, конфеты, кусочки сахара или сладкий сок.
Тяжелые симптомы гипогликемии (включая неврологические расстройства, судороги, потерю сознания, кому) должны купироваться вторыми (специально обученными) лицами проведением в/м или п/к инъекций глюкагона или в/в введением раствора Декстрозы. Если применение глюкагона не дало результат на протяжении 10-15 минут, переходят на в/в ведение декстрозы.
Пациенту, пришедшему в сознание, рекомендуют принимать пищу богатую углеводами, дыбы избежать повторения гипогликемии.
Для определения причин возникновения тяжелой гипогликемии и предупреждения ее развития в дальнейшем, необходимо наблюдать пациента в стационаре.
Взаимодействие
Целенаправленных исследований фармакокинетического взаимодействия инсулина глулизина не проводилось. Учитывая имеющийся запас эмпирических знаний, накопленный в процессе применения прочих подобных препаратов, формирование каких-либо клинически значимых лекарственных взаимодействий маловероятно. Существуют вещества, которые могут влиять на глюкозный метаболизм и требовать корректировки дозировок инсулина глулизина, а также дальнейшего тщательного контроля над терапией.
К веществам, увеличивающим гипогликемическую эффективность инсулина и повышающим риск возникновения гипогликемии, относятся: фибраты, ингибиторы АПФ, пероральные гипогликемические ЛС, салицилаты, Дизопирамид, Флуоксетин, Пентоксифиллин, ингибиторы моноаминоксидазы, Пропоксифен, сульфаниламиды.
К веществам, снижающим гипогликемические эффекты инсулина, относятся: глюкокортикоиды, Диазоксид, Даназол, диуретики, производные Фенотиазина, Изониазид, Соматропин, гормоны щитовидной железы, симпатомиметики (Сальбутамол, Эпинефрин, Тербуталин), прогестины (оральные контрацептивы), антипсихотические препараты (Клозапин, Оланзапин), эстрогены, ингибиторы протеазы.
Соли лития, бета-адреноблокаторы, этанол, Клонидин могут изменять гипогликемическое действие Апидры в ту или иную сторону. Параллельное применение Пентамидина может привести к гипогликемии, а в дальнейшем к гипергликемии.
Под влиянием лекарственных средств, обладающих симпатолитической активностью (Клонидин, Резерпин, бета-адреноблокаторы, Гуанетидин), проявления адренергической активации (рефлекторной) могут выражаться меньше или отсутствовать полностью.
Из-за отсутствия исследований по совместимости, Апидра не должна смешиваться с какими-либо прочими препаратами кроме инсулина-изофана (человеческого).
При использовании инфузионной помпы не допускается смешивание Апидры с прочими препаратами.
Условия продажи
Все инсулины, включая препарат Апидра, являются рецептурными.
Условия хранения
Диапазон температур долгосрочного хранения инсулина глулизина должен соответствовать 2-8 °C. Используемую шприц-ручку можно хранить при температуре до 25 °C, в темном помещении.
Срок годности
Апидра СолоСтар может сохраняться на протяжении 2-х лет с момента ее изготовления. Срок годности Апидры, в применяемой на данный момент шприц-ручке, равен 4 неделям, в связи с чем рекомендуют наносить на этикетку шприца-ручки дату ее первого использования.
Особые указания
Назначение пациенту инсулина другого завода-производителя или альтернативного инсулина следует осуществлять под строгим наблюдением медицинского персонала, в связи с возможной необходимостью изменения дозировочного режима, вследствие отклонений в концентрации инсулина, его типе (инсулин-изофан, растворимый и пр.), виде (человеческого, животного) и/или методе производства. Также может возникнуть необходимость изменений в параллельно проводимой гипогликемической терапии пероральными формами. Прекращение лечения или применение неадекватных дозировок инсулина, в особенности у больных с ювенильным диабетом, может стать причиной формирования диабетического кетоацидоза и гипергликемии, представляющих опасность для жизни пациента.
Временной промежуток развития гипогликемии обусловлен скоростью формирования инсулинового эффекта используемых препаратов и ввиду этого он может изменяться при корректировке терапевтической схемы. К обстоятельствам, изменяющим предвестники формирования гипогликемии или делающим их менее выраженными, относят: интенсификацию инсулинотерапии, длительное наличия сахарного диабета, существование диабетической нейропатии, изменение самого инсулина, прием некоторых ЛС (например, бета-адреноблокаторов).
Корректировка инсулиновых дозировок может быть необходима при увеличении пациентом физических нагрузок или изменении повседневного режима питания. Физические упражнения, выполняемые сразу после еды, повышают риск возникновения гипогликемии. При использовании быстродействующих инсулинов развитие гипогликемии происходит быстрее.
Некомпенсированные гипер— или гипогликемические проявления могут стать причиной развития комы, потери сознания или даже смерти.
Необходимость в применении инсулина может колебаться при эмоциональных перегрузках или заболеваниях.
При выполнении пациентом точных, опасных работ, а также вождении транспорта следует учитывать возможность формирования гипер— или гипогликемии и соблюдать осторожность.
Аналоги
Совпадения по коду АТХ 4-го уровня:
- Актрапид (НМ, МС);
- Возулим-Р;
- Биосулин Р;
- Генсулин Р;
- Инсулин МК;
- Гансулин Р;
- Инсулин-Ферейн ЧР;
- Моносуинсулин (МК, МП);
- Инсуман Рапид ГТ;
- НовоРапид (Пенфилл, ФлексПен);
- Инсуран Р;
- Пенсулин (СР, ЧР);
- Хумалог;
- Ринсулин Р;
- Хумодар Р;
- Росинсулин Р;
- Хумулин Регуляр;
- Моноинсулин ЧР.
Детям
Препарат Апидра может быть назначен детям только после 6-ти лет.
При беременности (и лактации)
Клинические исследования использования препарата Апидра при беременности отсутствуют. Ограниченные данные применения данного инсулина беременными женщинами не указывают на его негативное влияние на внутриутробное формирование плода, течение беременности или на новорожденного ребенка.
Проведенные репродуктивные тестирования на животных не продемонстрировали каких-либо отличий между инсулином человека и инсулином глулизином по отношению к эмбриональному/фетальному развитию, течению беременности, родовой деятельности и постнатальному развитию.
Назначать Апидру беременным женщинам следует с осторожностью при обязательном постоянном мониторинге плазменного уровня глюкозы и контроле гликемии.
Беременным женщинам с гестационным диабетом следует помнить о возможном снижении потребности в инсулине на протяжении I триместра беременности, увеличении во II и III триместре, а также быстром уменьшении после родов.
Выделение инсулина глулизина с молоком кормящей матери не установлено. При его применении во время кормления грудью может возникнуть необходимость в корректировке дозировочного режима.
Отзывы
Отзывы о препарате Апидра, как впрочем, и обо всех прочих инсулинах, сводятся к одному, подошел или нет данный препарат тому или иному человеку. В случае, когда препарат Апидра полностью подходит пациенту, нареканий на его эффективность и безопасность практически не существует. Также отмечают удобство использования шприц-ручек СолоСтар и точность дозирования в них инсулина.
Цена, где купить
Цена на лекарство Апидра варьируется в пределах 2000-2300 рублей.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Апидра СолоСтар раствор для п/к введ. шприц-ручка 100ЕД/мл 3мл 5штАО Санофи Восток
Аптека Диалог
-
Апидра СолоСтар шприц-ручка 100ЕД/мл раствор для подкожного введения 3мл №5Санофи-Авентис Восток
показать еще
Апидра — инструкция по применению
Синонимы, аналоги
Статьи
В настоящее время препарат не числится в Государственном реестре лекарственных средств или указанный регистрационный номер исключен из реестра.
Регистрационный номер:
ЛС-002064.
Торговое наименование препарата:
Апидра®.
Международное непатентованное наименование:
инсулин глулизин.
Лекарственная форма
раствор для подкожного введения.
Состав
1 мл раствора содержит:
активное вещество: инсулин глулизин — 100 ЕД (3,49 мг);
вспомогательные вещества: метакрезол (м-крезол) — 3,15 мг, трометамол (трометамин) — 6,0 мг, натрия хлорид — 5,0 мг, полисорбат 20 — 0,01 мг, натрия гидроксид до рН 7,3, хлористоводородная кислота до рН 7,3, вода для инъекций до 1,0 мл.
Описание
Прозрачная бесцветная жидкость.
Фармакотерапевтическая группа:
гипогликемическое средство, инсулина короткого действия аналог.
Код АТХ:
A10AB06.
Фармакологические свойства
Фармакодинамика
Инсулин глулизин является рекомбинантным аналогом человеческого инсулина, который по силе действия равен обычному человеческому инсулину. После подкожного (п/к) введения инсулин глулизин начинает действовать быстрее и имеет меньшую продолжительность действия, чем растворимый человеческий инсулин.
Наиболее важным действием инсулина и аналогов инсулина, включая инсулин глулизин, является регуляция метаболизма глюкозы. Инсулин снижает концентрацию глюкозы в крови, стимулируя поглощение глюкозы периферическими тканями, особенно скелетной мускулатурой и жировой тканью, а также ингибируя образование глюкозы в печени. Инсулин подавляет липолиз в адипоцитах, подавляет протеолиз и увеличивает синтез белка. Исследования, проведенные у здоровых добровольцев и пациентов с сахарным диабетом, показали, что при п/к введении инсулин глулизин начинает действовать быстрее и имеет меньшую продолжительность действия, чем растворимый человеческий инсулин. При подкожном введении понижающее концентрацию глюкозы в крови действие инсулина глулизин начинается через 10-20 мин. При внутривенном введении гипогликемическое действие инсулина глулизин и растворимого человеческого инсулина являются равными по силе. Одна единица инсулина глулизин имеет ту же самую глюкозопонижающую активность, что и одна единица растворимого человеческого инсулина.
В исследовании фазы I у пациентов с сахарным диабетом 1 типа оценивались глюкозопонижающие профили инсулина глулизин и растворимого человеческого инсулина, вводившихся подкожно в дозе 0,15 ЕД/кг в разное время по отношению к стандартному 15-минутному приему пищи. Результаты исследования показали, что инсулин глулизин введенный за 2 мин до приема пищи обеспечивал такой же гликемический контроль после еды, что и растворимый человеческий инсулин, введенный за 30 мин до приема пищи. При введении за 2 мин до приема пищи инсулин глулизин обеспечивал лучший гликемический контроль после еды, чем растворимый человеческий инсулин, введенный за 2 мин до приема пищи. Инсулин глулизин, введенный через 15 мин после начала приема пищи давал такой же гликемический контроль после приема пищи, что и растворимый человеческий инсулин, вводимый за 2 мин до приема пищи.
Исследование фазы I, проводившееся с инсулином глулизин, инсулином лизпро и растворимым человеческим инсулином у группы пациентов с ожирением, продемонстрировало, что у этих пациентов инсулин глулизин сохраняет свои характеристики быстрого действия. В этом исследовании время достижения 20% от полного AUC составляло 114 мин для инсулина глулизин, 121 мин для инсулина лизпро и 150 мин для растворимого человеческого инсулина, а AUQ(0-2 ч), отражающее также раннюю глюкозопонижающую активность, соответственно, составляло 427 мг/кг для инсулина глулизин, 354 мг/кг для инсулина лизпро, и 197 мг/кг для растворимого человеческого инсулина.
Клинические исследования
Сахарный диабет 1 типа.
В 26-недельном клиническом исследовании фазы III, в котором проводилось сравнение инсулина глулизин с инсулином лизпро, вводившимися подкожно незадолго до еды (за 0-15 мин) пациентам с сахарным диабетом 1 типа, использующим в качестве базального инсулина инсулин гларгин, инсулин глулизин был сопоставим с инсулином лизпро в отношении гликемического контроля, который оценивался по изменению концентрации гликированного гемоглобина (HbA1с) на момент конечной точки исследования в сравнении с исходным значением. При введении инсулина глулизин, в отличие от лечения инсулином лизпро, не потребовалось повышения дозы базального инсулина.
12-недельное клиническое исследование III фазы, проведенное у пациентов с сахарным диабетом 1 типа, получавших в качестве базальной терапии инсулин гларгин, показало, что эффективность введения инсулина глулизин непосредственно после еды была сопоставима с таковой при введении инсулина глулизин непосредственно перед приемом пищи (за 0-15 мин) или растворимого человеческого инсулина (за 30-45 мин до еды).
В группе пациентов, получавших перед едой инсулин глулизин, наблюдалось достоверно большее снижение HbA1с по сравнению с группой пациентов, получавших растворимый человеческий инсулин.
Сахарный диабет 2 типа
26-недельное клиническое исследование фазы III с последовавшим за ним 26-недельным продолжением в виде исследования безопасности было проведено для сравнения инсулина глулизин (за 0-15 мин до приема пищи) с растворимым человеческим инсулином (за 30-45 мин до приема пищи), которые вводились подкожно у пациентов с сахарным диабетом 2 типа, кроме этого использующих в качестве базального инсулина инсулин-изофан. Инсулин глулизин показал себя сопоставимым с растворимым человеческим инсулином в отношении изменений концентраций HbA1с через 6 мес и через 12 мес лечения по сравнению с исходным значением.
При проведении непрерывной п/к инфузии инсулина с помощью помпового устройства (при сахарном диабете 1 типа) у 59 пациентов, получавших лечение препаратом Апидра® или инсулином аспарт в обеих группах лечения наблюдалась низкая частота окклюзии катетера (0,08 окклюзий в месяц при применении препарата Апидра® и 0,15 окклюзий в месяц при применении инсулина аспарт), а также подобная частота реакций в месте введения (10,3% при применении препарата Апидра® и 13,3% при применении инсулина аспарт).
У детей и подростков с сахарным диабетом 1 типа, которым в качестве базального инсулина один раз в день вечером вводили инсулин гларгин или два раза в день утром и вечером инсулин-изофан, при сравнении эффективности и безопасности лечения инсулином глулизин и инсулином лизпро при их п/к введении за 15 мин до приема пищи было показано, что гликемический контроль, частота развития гипогликемии, потребовавшей вмешательства третьих лиц, а также частота тяжелых гипогликемических эпизодов были сопоставимыми в обеих группах лечения. При этом через 26 недель лечения у пациентов, получавших лечение инсулином глулизин для достижения гликемического контроля, сопоставимого с инсулином лизпро, потребовалось достоверно меньшее увеличение суточных доз базального инсулина, быстро действующего инсулина и суммарной дозы инсулина.
Расовое происхождение и пол
В контролируемых клинических исследованиях у взрослых не было показано различий в безопасности и эффективности инсулина глулизин при анализе подгрупп, выделенных по расовой принадлежности и полу.
Фармакокинетика
В инсулине глулизин замещение аминокислоты аспарагин человеческого инсулина в позиции В3 на лизин и лизина в позиции В29 на глутаминовую кислоту способствует более быстрой абсорбции.
Абсорбция и биодоступность
Фармакокинетические кривые «концентрация-время» у здоровых добровольцев и пациентов с сахарным диабетом 1 и 2 типа продемонстрировали, что абсорбция инсулина глулизин по сравнению с растворимым человеческим инсулином была приблизительно в 2 раза быстрее, а достигаемая максимальная плазменная концентрация (Сmах) была приблизительно в 2 раза больше.
В исследовании, проведенном у пациентов с сахарным диабетом 1 типа, после п/к введения инсулина глулизин в дозе 0,15 ЕД/кг, Тmax (время наступления максимальной плазменной концентрации) составляло 55 минут, а Сmах составляла 82 ± 1,3 мкЕД/мл по сравнению с Tmax, составляющим 82 минуты, и Cmax, составляющей 46 ± 1,3 мкЕД/мл, для растворимого человеческого инсулина. Среднее время пребывания в системном кровотоке у инсулина глулизин было короче (98 минут), чем у растворимого человеческого инсулина (161 минута).
В исследовании у пациентов с сахарным диабетом 2 типа после п/к введения инсулина глулизин в дозе 0,2 ЕД/кг Cmax составляла 91 мкЕД/мл с межквартильной широтой от 78 до 104 мкЕД/мл.
При п/к введении инсулина глулизин в область передней брюшной стенки, бедра или плеча (в область дельтовидной мышцы) абсорбция была более быстрой при введении в область передней брюшной стенки по сравнению с введением препарата в область бедра. Скорость абсорбции из области дельтовидной мышцы была промежуточной. Абсолютная биодоступность инсулина глулизин после п/к введения составляла приблизительно 70% (73% из области передней брюшной стенки, 71 из области дельтовидной мышцы и 68% из области бедра) и имела низкую вариабельность у разных пациентов.
Распределение и выведение
Распределение и выведение инсулина глулизин и растворимого человеческого инсулина после внутривенного введения являются подобными, с объемами распределения, составляющими 13 литров и 21 литр, и периодами полувыведения, составляющими 13 и 17 минут, соответственно. После п/к введения инсулин глулизин выводится быстрее, чем растворимый человеческий инсулин, имея кажущийся период полувыведения, составляющий 42 минуты, по сравнению с кажущимся периодом полувыведения растворимого человеческого инсулина, составляющим 86 минут. При перекрестном анализе исследований инсулина глулизин, как у здоровых лиц, так и у лиц с сахарным диабетом 1 и 2 типа, кажущийся период полувыведения находился в диапазоне от 37 до 75 минут.
Фармакокинентика у особых групп пациентов
Пациенты с почечной недостаточностью
В клиническом исследовании, проведенном у пациентов без сахарного диабета с широким диапазоном функционального состояния почек (клиренс креатинина (КК) > 80 мл/мин, 30-50 мл/мин, < 30 мл/мин), в целом быстрота наступления эффекта инсулина глулизин сохранялась. Однако потребность в инсулине при наличии почечной недостаточности может быть снижена.
Пациенты с печеночной недостаточностью
У пациентов с нарушениями функции печени фармакокинетические показатели не изучались.
Пациенты пожилого возраста
Имеются очень ограниченные данные по фармакокинетике инсулина глулизин у пациентов с сахарным диабетом пожилого возраста.
Дети и подростки
Фармакокинетические и фармакодинамические свойства инсулина глулизин были исследованы у детей (7-11 лет) и подростков (12-16 лет) с сахарным диабетом 1 типа. В обеих возрастных группах инсулин глулизин быстро абсорбируется с Tmax и Cmax подобными таковым у взрослых (здоровых добровольцев и пациентов с сахарным диабетом 1 типа). Как и у взрослых при введении непосредственно перед тестом с приемом пищи инсулин глулизин обеспечивает лучший контроль глюкозы крови после еды, чем растворимый человеческий инсулин. Повышение концентрации глюкозы в крови после еды (AUC 0-6 часов — площадь под кривой «концентрация глюкозы в крови — время» от 0 до 6 часов) составляло 641 мг/(ч*дл) для инсулина глулизин и 801 мг/(ч*дл) для растворимого человеческого инсулина.
Показания к применению
Сахарный диабет, требующий инсулинотерапии, у взрослых, подростков и детей старше 6 лет.
Противопоказания
Гиперчувствительность к инсулину глулизин или к какому-либо из компонентов препарата.
Гипогликемия.
С осторожностью
При беременности.
Применение при беременности и в период грудного вскармливания
Беременность
Отсутствуют контролируемые клинические исследования по применению препарата Апидра® у беременных женщин. Ограниченное количество данных, полученных по применению инсулина глулизин у беременных женщин (сообщалось о менее чем 300 исходах беременностей), не указывает на его неблагоприятное воздействие на течение беременности, внутриутробное развитие плода или на новорожденного ребенка. Репродуктивные исследования на животных не выявили каких-либо различий между инсулином глулизин и человеческим инсулином в отношении течения беременности, эмбрионального/фетального развития, родов и постнатального развития.
Применение препарата Апидра® у беременных требует соблюдения мер предосторожности. Обязателен тщательный мониторинг концентрации глюкозы в крови и поддержание адекватного гликемического контроля.
Пациенткам с имевшимся до беременности или гестационным сахарным диабетом необходимо до зачатия и в течение всей беременности поддерживать адекватный гликемический контроль. Во время первого триместра беременности потребность в инсулине может уменьшаться, а во время второго и третьего триместров она, как правило, может увеличиваться. Сразу же после родов потребность в инсулине быстро снижается.
Пациенткам с сахарным диабетом необходимо информировать своего врача, если они беременны или планируют забеременеть.
Период грудного вскармливания
Неизвестно, проникает ли инсулин глулизин в грудное молоко, но в целом инсулин не проникает в грудное молоко и не всасывается при пероральном введении.
У женщин в период грудного вскармливания может потребоваться коррекция режима дозирования инсулина и диеты.
Способ применения и дозы
Общие рекомендации
Препарат Апидра® следует вводить незадолго (за 0-15 мин) до или вскоре после приема пищи.
Препарат Апидра® должен применяться в схемах лечения, включающих в себя инсулин средней продолжительности действия, или длительно действующий инсулин, или аналог инсулина длительного действия. Кроме этого, препарат Апидра® может применяться в сочетании с пероральными гипогликемическими препаратами (ПГГП).
Режим дозирования препарата Апидра® подбирается индивидуально на основании рекомендаций врача в соответствии с потребностями пациента. Всем пациентам с сахарным диабетом рекомендуется контролировать концентрацию глюкозы в крови.
Применение у особых групп пациентов
Дети и подростки
Препарат Апидра® можно применять у детей старше 6 лет и подростков. Клиническая информация по применению препарата у детей младше 6 лет ограничена.
Пациенты пожилого возраста
Имеющиеся данные по фармакокинетике у пациентов пожилого возраста с сахарным диабетом недостаточны.
Нарушение функции почек в пожилом возрасте может привести к снижению потребности в инсулине.
Пациенты с почечной недостаточностью
Потребность в инсулине при почечной недостаточности может снижаться.
Пациенты с печеночной недостаточностью
У пациентов с нарушением функции печени потребность в инсулине может уменьшаться из-за сниженной способности к глюконеогенезу и замедлению метаболизма инсулина.
Способ применения
Препарат Апидра® предназначен для проведения п/к инъекций или непрерывной п/к инфузии инсулина с помощью помпового устройства, пригодного для введения инсулина.
П/к инъекции препарата Апидра® следует производить в область передней брюшной стенки, плеча или бедра, а введение препарата путем непрерывной п/к инфузии производится в область передней брюшной стенки. Места инъекций в пределах вышеупомянутых областей и места проведения непрерывных п/к инфузий должны чередоваться при каждом новом введении препарата. На скорость абсорбции и, соответственно, на начало и продолжительность действия могут влиять: место введения, физическая нагрузка и другие изменяющиеся условия. П/к введение в область передней брюшной стенки обеспечивает несколько более быструю абсорбцию, чем введение в другие вышеуказанные участки тела (см. раздел Фармакокинетика»).
Следует соблюдать меры предосторожности для исключения попадания препарата непосредственно в кровеносные сосуды. После введения препарата нельзя производить массаж области введения. Пациенты должны быть обучены правильной технике проведения инъекций.
Смешивание с инсулинами при проведении п/к инъекций
Препарат Апидра® может смешиваться с человеческим инсулином-изофан. При смешивании препарата Апидра® с человеческим инсулином-изофан препарат Апидра® должен набираться в шприц первым. П/к инъекция должна производиться сразу же после смешивания.
Смешанные вышеуказанные инсулины нельзя вводить внутривенно.
Применение препарата Апидра® с помповым устройством для проведения непрерывной п/к инфузии инсулина
Препарат Апидра® может также вводиться с помощью помпового устройства для проведения непрерывной п/к инфузии инсулина.
При этом набор для проведения инфузии и резервуар, которые используются с препаратом Апидра®, должны заменяться с соблюдением правил асептики, как минимум, каждые 48 ч. Эти рекомендации могут отличаться от общих инструкций в руководствах по использованию помповых устройств. Важно, чтобы пациенты следовали вышеуказанным специальным инструкциям по применению препарата Апидра®. Несоблюдение этих специальных инструкций по применению препарата Апидра® может привести к развитию серьезных нежелательных явлений.
При применении препарата Апидра® с помповым устройством для проведения непрерывной п/к инфузии инсулина препарат Апидра® нельзя смешивать с другими инсулинами или растворителями.
Пациенты, которым препарат Апидра® вводится путем непрерывной п/к инфузии, должны иметь альтернативные системы для введения инсулина и должны быть обучены введению инсулина путем п/к инъекции (на случай поломки используемого помпового устройства).
При применении препарата Апидра® с помповыми устройствами для проведения непрерывной п/к инфузии инсулина нарушение работы помпового устройства, неисправность набора для проведения инфузии или ошибки в обращении с ними могут быстро привести к развитию гипергликемии, кетоза и диабетического кетоацидоза. В случае развития гипергликемии или кетоза или диабетического кетоацидоза требуется быстрое выявление и устранение причин их развития.
Шприц-ручки, которые должны использоваться с картриджами Апидра®
Картриджи Апидра® используются со шприц-ручками «ОлСтар» (AllStar). Эти картриджи нельзя использовать с другими шприц-ручками для многократного использования, так как точность дозирования препарата была установлена только для шприц-ручек «ОлСтар» (AllStar).
В случае нарушения правильной работы шприц-ручек «ОлСтар» (AllStar) пациент может извлечь раствор из картриджа или картриджной системы в шприц (подходящий для инсулина в концентрации 100 ЕД/мл) и ввести себе нужную дозу препарата.
Для получения дополнительной информации по обращению с препаратом (смотри раздел «Инструкции по использованию и обращению»).
Следует точно выполнять инструкцию производителя шприц-ручек «ОлСтар» (AllStar) по правильному обращению с ними, представленную в соответствующей инструкции по использованию.
Побочное действие
Наблюдавшиеся нежелательные реакции (НР), были реакциями, известными для этого фармакологического класса, и, следовательно, общими для любых инсулинов. Эти НР представлены по системам органов (в соответствии с классификацией Медицинского словаря по нормативно-правовой деятельности (MedDRA)) и в соответствии с рекомендованными Всемирной организацией здравоохранения (ВОЗ) следующими градациями частоты их возникновения: очень часто (≥ 10 %); часто (≥ 1 %; < 10 %); нечасто (≥ 0,1 %; < 1 %); редко (≥ 0,01 %; < 0,1%); очень редко (< 0,01 %), частота неизвестна (определить частоту встречаемости НР по имеющимся данным не представляется возможным).
Нарушения со стороны обмена веществ и питания
Гипогликемия
Гипогликемия, наиболее частый нежелательный эффект инсулинотерапии, может возникать в случае применения слишком высоких доз инсулина, превышающих потребность в нем.
Симптомы развития гипогликемии обычно возникают внезапно. Однако, обычно психоневрологическим нарушениям на фоне нейрогликопении (чувство усталости, необычная утомляемость или слабость, снижение способности к концентрации внимания, сонливость, зрительные расстройства, головная боль, тошнота, спутанность сознания или его потеря, судорожный синдром) предшествуют симптомы адренергической контррегуляции (активации симпато-адреналовой системы в ответ на гипогликемию): чувство голода, раздражительность, нервное возбуждение или тремор, беспокойство, бледность кожных покровов, «холодный» пот, тахикардия, выраженное сердцебиение (чем быстрее развивается гипогликемия и чем она тяжелее, тем сильнее выражены симптомы адренергической контррегуляции).
Эпизоды тяжелой гипогликемии, особенно повторяющиеся, могут приводить к поражению нервной системы. Длительная и выраженная гипогликемия может угрожать жизни пациентов, так как при нарастании гипогликемии возможен даже летальный исход.
Нарушения со стороны иммунной системы
Местные реакции гиперчувствительности на инсулин
Могут возникать местные реакции гиперчувствительности (гиперемия, отечность и зуд в месте инъекции инсулина). Эти реакции обычно исчезают через несколько дней или недель применения препарата. В некоторых случаях эти реакции могут быть не связаны с инсулином, а обусловлены раздражением кожи, вызванным антисептической обработкой ее перед инъекцией или неправильным проведением п/к инъекции (при нарушении правильной техники проведения п/к инъекции).
Системные реакции гиперчувствительности на инсулин
Такие реакции на инсулин (включая инсулин глулизин) могут, например, сопровождаться появлением сыпи по всему телу (в том числе сопровождающейся зудом), чувством стесненности в груди, удушьем, снижением артериального давления, учащением пульса или обильным потоотделением. Тяжелые случаи генерализованной аллергии, включая анафилактические реакции, могут угрожать жизни пациента.
Нарушения со стороны кожи и подкожной клетчатки
Липодистрофия
Как и при применении любых других инсулинов, в месте инъекций может развиться липодистрофия, что может замедлить абсорбцию инсулина. Развитию липодистрофии может способствовать нарушение чередования мест введения инсулина, так как введение препарата в одно и то же место может способствовать развитию липодистрофии.
Постоянное чередование мест инъекции в пределах одной из областей введения (область бедра, плеча, передней поверхности брюшной стенки) может способствовать уменьшению и профилактике развития этой нежелательной реакции.
Прочие
Сообщалось о случайном введении других инсулинов по ошибке, в частности длительно действующих инсулинов, вместо инсулина глулизин.
Передозировка
Симптомы
Гипогликемия может возникать в результате избыточной дозы инсулина относительно приема пищи и расхода энергии. Данных о передозировке инсулина глулизин нет. Однако, при его передозировке возможно развитие гипогликемии.
Лечение
Эпизоды гипогликемии легкой или средней степени тяжести могут быть купированы с помощью приема легкоусвояемых углеводов (продуктов, содержащих фруктозу или сахарозу, шоколадных батончиков, меда и т.д.) или декстрозы (глюкозы).
Эпизоды гипогликемии тяжелой степени, c комой, судорогами и неврологическими расстройствами могут быть купированы внутримышечным или п/к введением 0,5-1 мг глюкагона или внутривенным введением концентрированного (20%) раствора декстрозы (глюкозы) медицинским работником.
После восстановления сознания рекомендуется давать пациенту углеводы внутрь для предотвращения повторения гипогликемии, которое возможно после кажущегося клинического улучшения.
После введения глюкагона, для установления причины этой тяжелой гипогликемии и предотвращения развития других подобных эпизодов пациент должен наблюдаться в стационаре.
Взаимодействие с другими лекарственными средствами
Исследований по фармакокинетическим взаимодействиям не проводилось. На основании имеющихся эмпирических знаний в отношении других подобных лекарственных средств возникновение клинически значимых фармакокинетических взаимодействий маловероятно. Некоторые лекарственные средства могут влиять на метаболизм глюкозы, что может потребовать коррекции доз инсулина глулизин и особенно тщательного контроля за лечением.
Лекарственные средства, которые могут увеличивать гипогликемическое действие инсулина и склонность к развитию гипогликемии
ПГГП, ингибиторы ангиотензинпревращающего фермента, дизопирамид, фибраты, флуоксетин, ингибиторы моноаминооксидазы, пентоксифиллин, пропоксифен, салицилаты и сульфаниламидные противомикробные средства.
Лекарственные средства, которые могут ослабить гипогликемическое действие инсулина
Глюкокортикостероиды, даназол, диазоксид, диуретики, глюкагон, изониазид, производные фенотиазина, соматропин, симпатомиметики (например, эпинефрин [адреналин], сальбутамол, тербуталин), гормоны щитовидной железы, эстрогены, гестагены (например, в гормональных контрацептивах), ингибиторы протеазы и атипичные нейролептики (например, оланзапин и клозапин).
Бета-адреноблокаторы, клонидин, соли лития и этанол могут или потенцировать, или ослаблять гипогликемическое действие инсулина. Пентамидин может вызывать гипогликемию c последующей гипергликемией.
Симпатолитические лекарственные средства — под влиянием лекарственных средств с симпатолитической активностью, таких как бета-адреноблокаторы, клонидин, гуанетидин и резерпин, симптомы рефлекторной адренергической активации в ответ на гипогликемию могут быть менее выраженными или отсутствовать.
Указания по совместимости
В связи с отсутствием исследований по совместимости, инсулин глулизин не следует смешивать с какими-либо другими лекарственными средствами, за исключением человеческого инсулина-изофан.
При введении с помощью инфузионного помпового устройства препарат Апидра® не должен смешиваться с растворителями и другими препаратами инсулина.
Особые указания
В связи с короткой продолжительностью действия препарата Апидра® пациентам с сахарным диабетом для поддержания адекватного гликемического контроля дополнительно требуется или введение инсулинов средней продолжительности действия, или инфузионное введение инсулина с помощью инсулиновой помпы.
Любые изменения инсулинотерапии должны производиться с осторожностью и только под наблюдением врача. Изменение концентрации инсулина, производителя инсулина, типа инсулина (растворимый человеческий инсулин, инсулин-изофан, аналоги инсулина), видовой принадлежности инсулина (инсулин животного происхождения, человеческий инсулин) или способа производства инсулина (инсулин, получаемый методом рекомбинантной ДНК, или инсулин животного происхождения) могут потребовать изменения дозы инсулина. Также может потребоваться изменение доз одновременно принимаемых ПГГП.
Потребность в инсулине может измениться во время интеркуррентных заболеваний, в результате эмоциональных перегрузок или стресса.
Применение неадекватных доз инсулина или прекращение лечения, особенно у пациентов с сахарным диабетом 1 типа, может привести к развитию гипергликемии и диабетического кетоацидоза — состояний, которые являются потенциально опасными для жизни.
Гипогликемия
Время, через которое развивается гипогликемия, зависит от профиля действия применяемых инсулинов и, в связи с этим, изменяется при изменении схемы лечения.
К условиям, которые могут изменить или сделать менее выраженными предвестники развития гипогликемии, относятся: интенсификация инсулинотерапии и значимое улучшение гликемического контроля, постепенное развитие гипогликемии, пожилой возраст пациента, наличие нейропатии вегетативной нервной системы, длительное существование сахарного диабета, прием некоторых лекарственных препаратов (см. раздел «Взаимодействие с другими лекарственными средствами»).
Такие ситуации могут приводить к развитию тяжелой гипогликемии (и возможно к потере сознания) до того, как пациент поймет, что у него развивается гипогликемия.
Коррекция доз инсулина может также потребоваться в случае, если пациенты увеличивают физическую активность или изменяют свой обычный распорядок приема пищи. Физическая нагрузка, выполненная непосредственно после еды, может увеличить риск развития гипогликемии. По сравнению с растворимым человеческим инсулином после инъекции быстро действующих аналогов инсулина гипогликемия может развиваться раньше.
Некомпенсированные гипогликемическая или гипергликемическая реакции могут привести к потере сознания, развитию комы или летальному исходу.
Почечная недостаточность
Потребность в препарате Апидра®, как и во всех других инсулинах, может снижаться по мере прогрессирования почечной недостаточности.
Печеночная недостаточность
У пациентов с печеночной недостаточностью потребность в инсулине снижается из-за снижения способности к глюконеогенезу в печени и замедлению метаболизма инсулина.
Пациенты пожилого возраста
Нарушение функции почек в пожилом возрасте может привести к снижению потребности в инсулине.
У пациентов пожилого возраста могут быть трудности с распознаванием признаков развивающейся гипогликемии.
Дети и подростки
Препарат Апидра® можно применять у детей старше 6 лет и подростков. Клиническая информация по применению препарата у детей младше 6 лет ограничена.
Фармакокинетические и фармакодинамические свойства инсулина глулизин были исследованы у детей (7-11 лет) и подростков (12-16 лет) с сахарным диабетом 1 типа. В обеих возрастных группах инсулин глулизин быстро абсорбировался, и скорость его абсорбции не отличалась от таковой у взрослых (здоровых добровольцев и пациентов с сахарным диабетом 1 типа). Как и у взрослых, в обеих возрастных группах детей и подростков при введении непосредственно перед тестом с приемом пищи инсулин глулизин обеспечивает лучший контроль глюкозы крови после еды, чем растворимый человеческий инсулин.
Влияние на способность управлять транспортными средствами и механизмами
Способность пациента к концентрации внимания и скорость психомоторных реакций могут быть нарушены в результате гипогликемии или гипергликемии, а также в результате зрительных расстройств. Это может представлять определенный риск в ситуациях, когда эти способности важны, например, при управлении транспортными средствами или другими механизмами.
Пациентам следует рекомендовать соблюдать осторожность и избегать развития гипогликемии во время управления транспортными средствами или механизмами. Это особенно важно у пациентов, у которых снижена или отсутствует способность осознавать симптомы, указывающие на развитие гипогликемии, или имеются частые эпизоды гипогликемии. У таких пациентов следует индивидуально решать вопрос о возможности управления ими транспортными средствами или другими механизмами.
Формы выпуска
Раствор для подкожного введения 100 ЕД/мл.
1) По 10 мл препарата во флакон из прозрачного, бесцветного стекла (тип I). Флакон укупорен пробкой, обжат алюминиевым колпачком и покрыт защитной крышечкой. По 1 флакону вместе с инструкцией по применению в картонную пачку.
2) По 3 мл препарата в картридж из прозрачного, бесцветного стекла (тип I). Картридж обжат с одной стороны алюминиевым колпачком с уплотнительным диском и укупорен с другой — плунжером. По 5 картриджей в контурную ячейковую упаковку из ПВХ пленки и фольги алюминиевой. По 1 контурной ячейковой упаковке вместе с инструкцией по применению в картонную пачку.
Условия хранения
Хранить в защищенном от света месте при температуре от 2 °C до 8 °C. Не замораживать.
Хранить в недоступном для детей месте!
Срок годности
2 года. Не применять по истечении срока годности.
Условия отпуска
Отпускается по рецепту.
Юридическое лицо, на имя которого выдано регистрационное удостоверение
Санофи-Авентис Дойчланд ГмбХ, Германия.
Производитель
1) Санофи-Авентис Дойчланд ГмбХ, Германия.
Sanofi-Aventis Deutschland GmbH,
Brueningstrasse 50, D-65926,
Frankfurt (Main), Germany.
2) ЗАО «Санофи-Авентис Восток», Россия.
302516, Россия, Орловская область, Орловский район, с/п
Большекуликовское, ул. Ливенская, д. 1.
Претензии потребителей направлять по адресу в России:
АО «Санофи Россия».
125009, Россия, г. Москва, ул. Тверская, 22.
В случае производства и/или упаковки препарата на ЗАО «Санофи-Авентис Восток», Россия, претензии потребителей направлять по адресу:
302516, Россия, Орловская область, Орловский район,
с/п Большекуликовское, ул. Ливенская, д. 1.
Инструкция по использованию и обращению
Так как препарат Апидра® является раствором, проведения ресуспендирования перед его применением не требуется.
Флаконы
Флаконы препарата Апидра® предназначены для использования с инсулиновыми шприцами с соответствующей шкалой единиц и для использования с помповой инсулиновой системой.
Перед использованием осмотрите флакон. Он должен использоваться только, в том случае, если раствор прозрачен, бесцветен и не содержит видимых твердых частиц.
Непрерывное п/к инфузионное введение с помощью помповой системы.
Препарат Апидра® может применяться для проведения непрерывной п/к инфузии инсулина (НПИИ) с помощью помповой системы, подходящей для проведения инфузии инсулина с соответствующими катетерами и резервуарами.
Инфузионный набор и резервуар должны заменяться каждые 48 часов с соблюдением правил асептики.
Пациенты, получающие препарат Апидра® путем НПИИ, должны иметь в запасе альтернативный инсулин на случай отказа помповой системы.
Картриджи
Картриджи должны использоваться вместе с инсулиновой шприц-ручкой, «ОлСтар» (AllStar), и в соответствии с рекомендациями в Инструкции по использованию производителя этого устройства. Они не должны использоваться с другими шприц-ручками многоразового использования, так как точность дозирования была установлена только с этой шприц-ручкой.
Инструкция производителя по использованию шприц-ручки «ОлСтар» (AllStar) относительно загрузки картриджа, присоединения иглы и проведения инъекции инсулина должны точно выполняться. Осмотрите картридж перед использованием. Его следует использовать только в том случае, если раствор является прозрачным, бесцветным, не содержащим видимых твердых частиц. Перед вставлением картриджа в шприц-ручку многоразового использования картридж должен 1-2 часа находиться при комнатной температуре. Перед проведением инъекции из картриджа следует удались воздушные пузырьки (смотри инструкцию по использованию шприц-ручки). Инструкция по применению шприц-ручки должна строго выполняться. Пустые картриджи заполнять повторно нельзя. Если шприц-ручка «ОлСтар» (AllStar) повреждена, ее использовать нельзя.
Если шприц-ручка работает неправильно, раствор может быть набран из картриджа в пластиковый шприц, подходящий для инсулина в концентрации 100 ЕД/мл, и введен пациенту.
Для предупреждения инфицирования шприц-ручка многоразового использования должна использоваться только у одного и того же пациента.
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Этот товар купили 568 раз
Как сделать заказ?
Добавьте выбранный товар в корзину
Проверьте наличие в аптеках
Выкупите в аптеке прямо сейчас!
Информация производителя
Кратко о товаре Апидра СолоСтар раствор для подкожного введения 100 ЕД/мл шприц-ручка 3 мл 5 шт. в Ростове-на-Дону
Купить Апидра СолоСтар раствор для подкожного введения 100 ЕД/мл шприц-ручка 3 мл 5 шт. в Ростове-на-Дону можно в удобной для вас аптеке, сделав заказ на Мегаптека.ру
Цена на Апидра СолоСтар раствор для подкожного введения 100 ЕД/мл шприц-ручка 3 мл 5 шт. в Ростове-на-Дону – от 2129 рублей
Инструкция по применению для Апидра СолоСтар раствор для подкожного введения 100 ЕД/мл шприц-ручка 3 мл 5 шт.
Цены на Апидра в других городах
Мегаптека,
Москва, Санкт-Петербург, Новосибирск, Екатеринбург, Казань, Нижний Новгород, Челябинск, Омск, Воронеж, Пермь, Волгоград, Краснодар, Тюмень, Саратов, Ижевск, Барнаул, Ульяновск, Махачкала, Белгород, Пенза, Смоленск, Великий Новгород, Тула, Сыктывкар, Салехард, Псков, Нальчик, Курск, Орел, Якутск
Цена зависит от выбранной аптеки и действительна только при заказе через сервис Мегаптека.ру
Состав
Активный ингредиент: инсулин глулизин — 100 ЕД (3,49 мг).
Вспомогательные ингредиенты: метакрезол (м-крезол), трометамол (трометамин), натрия хлорид, полисорбат 20, натрия гидроксид, хлористоводородная кислота, вода для инъекций.
Фармакокинетика
В инсулине глулизин замещение аминокислоты .дспарагин человеческого инсулина в позиции В3 на лизин и лизина в позиции В29 на глутаминовую кислоту способствует более быстрой абсорбции.
Абсорбция и биодоступность
Фармакокинетические кривые концентрация-время у здоровых добровольцев и пациентов с сахарным диабетом 1 и 2 типа продемонстрировали, что абсорбция инсулина глулизин по сравнению с растворимым человеческим инсулином была приблизительно в 2 раза быстрее, а достигаемая максимальная плазменная концентрация (Сmах) была приблизительно в 2 раза больше.
В исследовании, проведенном у пациентов с сахарным диабетом 1 типа, после подкожного введения инсулина глулизин в дозе 0,15 ЕД/кг, Тmах (время достижения максимальной плазменной концентрации) составляло 55 минут, а Сmах составляла 82 ± 1,3 мкЕД/мл по сравнению с Тmах, составляющим 82 минуты, и Сmах, составляющей 46 ± 1,3 мкЕД/мл, для растворимого человеческого инсулина Среднее время пребывания в системном кровотоке у инсулина глулизин было короче (98 минут), чем у растворимого человеческого инсулина (161 минута).
В исследовании у пациентов с сахарным диабетом 2 типа после подкожного введения инсулина глулизин в дозе 0,2 ЕД/кг Сmах составляла 91 мкЕД/мл с межквартильной широтой от 78 до 104 мкЕД/мл.
При подкожном введении инсулина глулизин в область передней брюшной стенки, бедра или плеча (в область дельтовидной мышцы) абсорбция была более быстрой при введении в область передней брюшной стенки по сравнению с введением препарата в область бедра. Скорость абсорбции из области дельтовидной мышцы была промежуточной. Абсолютная биодоступность инсулина глулизин после подкожного введения составляла приблизительно 70% (73% из области передней брюшной стенки, 71 из области дельтовидной мышцы и 68% из области бедра) и имела низкую вариабельность у разных пациентов.
Распределение и выведение
Распределение и выведение инсулина глулизин и растворимого человеческого инсулина после внутривенного введения являются подобными, с объемами распределения, составляющими 13 литров и 22 литра, и периодами полувыведения, составляющими 13 и 18 минут, соответственно.
После подкожного введения инсулин глулизин выводится быстрее чем растворимый человеческий инсулин, имея кажущийся период полувыведения, составляющий 42 минуты, по сравнению с кажущимся периодом полувыведения растворимого человеческого инсулина, составляющим 86 минут. При перекрестном анализе исследований инсулина глулизин, как у здоровых лиц, так и у лиц с сахарным диабетом 1 и 2 типа, кажущийся период полувыведения находился в диапазоне от 37 до 75 минут.
Особые группы пациентов
Пациенты с почечной недостаточностью
В клиническом исследовании, проведенном у лиц без сахарного диабета с широким диапазоном функционального состояния почек (клиренс креатинина (КК) > 80 мл/мин, 30-50 мл/мин, < 30 мл/мин), в целом быстрота наступления эффекта инсулина глулизин сохранялась. Однако потребность в инсулине при наличии почечной недостаточности может быть снижена.
Пациенты с печеночной недостаточностью
У пациентов с нарушениями функции печени фармакокинетические показатели не изучались.
Пациенты пожилого возраста
Имеются очень ограниченные данные по фармакокинетике инсулина глулизин у пациентов пожилого возраста с сахарным диабетом.
Дети и подростки
Фармакокинетические и фармакодинамические свойства инсулина глулизин были исследованы у детей (7-11 лет) и подростков (12-16 лет) с сахарным диабетом 1 типа. В обеих возрастных группах инсулин глулизин быстро абсорбируется с Тmах и Сmах подобными таковым у взрослых. Как и у взрослых, при введении непосредственно перед тестом с приемом пищи инсулин глулизин обеспечивает лучший контроль глюкозы крови после еды, чем растворимый человеческий инсулин. Повышение концентрации глюкозы в крови после еды (AUC0-6 часов — площадь под кривой концентрация глюкозы в крови — время от 0 до 6 часов) составляло 641 мг/(ч х дл) для инсулина глулизин и 801 мг/(ч х дл) для растворимого человеческого инсулина.
Показания к применению
Сахарный диабет, требующий лечение инсулином, у взрослых, подростков и детей старше 6 лет.
Противопоказания
- Гиперчувствительность к инсулину глулизин или к какому-либо из компонентов препарата.
- Гипогликемия.
С осторожностью:
- При беременности
Способ применения и дозы
Препарат Апидра® СолоСтар® следует вводить незадолго (за 0-15 мин) до или вскоре после приема пищи.
Препарат Апидра® СолоСтар® следует применять в схемах лечения, включающих в себя или инсулин средней продолжительности действия, или длительно действующий инсулин, или аналог инсулина длительного действия. Кроме этого, препарат Апидра® СолоСтар® может применяться в сочетании с пероральными гипогликемическими препаратами. Режим дозирования препарата Апидра® СолоСтар® подбирается индивидуально.
Введение препарата
Препарат Апидра® СолоСтар® вводится путем подкожной инъекции. Подкожные инъекции препарата Апидра® СолоСтар® следует делать в область передней брюшной стенки, плеча или бедра. Места инъекций в пределах вышеупомянутых областей (передняя брюшная стенка, бедро или плечо) должны чередоваться при каждом новом введении препарата. На скорость абсорбции и, соответственно, на начало и продолжительность действия могут влиять: место введения, физическая нагрузка и другие изменяющиеся условия. Подкожное введение в брюшную стенку обеспечивает несколько более быструю абсорбцию, чем введение в другие вышеуказанные участки тела (см. раздел «Фармакокинетика»).
Следует соблюдать меры предосторожности для исключения попадания препарата непосредственно в кровеносные сосуды. После введения препарата нельзя массировать место введения. Пациенты должны быть обучены правильной технике проведения инъекций.
Смешивание с инсулинами при проведении подкожных инъекций
Препарат Апидра® может смешиваться с человеческим инсулином-изофаном.
При смешивании препарата Апидра® с человеческим инсулином-изофаном препарат Апидра® должен набираться в шприц первым. Подкожная инъекция должна быть сделана сразу же после смешивания. Смешанные вышеуказанные инсулины нельзя вводить внутривенно.
Применение препарата Апидра® с помповым устройством для проведения непрерывной подкожной инфузии инсулина
Препарат Апидра® может также вводиться с помощью помпового устройства для проведения непрерывной подкожной инфузии инсулина. При необходимости раствор (препарат Апидра®) может быть извлечен из картриджа шприц-ручки Апидра® СолоСтар® и использован для введения с помощью помпового устройства для проведения непрерывной подкожной инфузии инсулина.
При этом набор для проведения инфузии и резервуар, которые используются с препаратом Апидра®, должны заменяться с соблюдением правил асептики, как минимум, каждые 48 ч. Эти рекомендации могут отличаться от общих инструкций в руководствах по использованию помповых устройств. Важно, чтобы пациенты следовали вышеуказанным специальным инструкциям по применению препарата Апидра®. Несоблюдение этих специальных инструкций по применению препарата Апидра® может привести к развитию серьезных нежелательных явлений.
При использовании препарата Апидра® с помповым устройством для проведения непрерывной подкожной инфузии инсулина его нельзя смешивать с другими инсулинами или растворителями.
Пациенты, которым препарат Апидра® вводится путем непрерывной подкожной инфузии, должны иметь альтернативные системы для введения инсулина и должны быть обучены введению инсулина путем подкожной инъекции (на случай поломки используемого помпового устройства).
При использовании препарата Апидра® с помповыми устройствами для проведения непрерывной подкожной инфузии инсулина нарушение работы помпового устройства, неисправность набора для проведения инфузии или ошибки в обращении с ними могут быстро привести к развитию гипергликемии, кетбза и диабетического кетоацидоза. В случае развития гипергликемии или кетоза или диабетического кетоацидоза требуется быстрое выявление и устранение причин их развития.
Следует точно выполнять инструкции по правильному обращению с предварительно заполненной шприц-ручкой СолоСтар® (смотри раздел «Инструкция по использованию и обращению с предварительно заполненной шприц-ручкой СолоСтар®»).
Особые группы пациентов
Пациенты с нарушениями функции почек
Потребность в инсулине при почечной недостаточности может снижаться.
Пациенты с нарушениями функции печени
У пациентов с нарушением функции печени потребность в инсулине может снижаться из-за сниженной способности к глюконеогенезу и замедлению метаболизма инсулина.
Пациенты пожилого возраста
Имеющиеся данные по фармакокинетике у пациентов пожилого возраста с сахарным диабетом недостаточны.
Нарушение функции почек в пожилом возрасте может привести к снижению потребности в инсулине.
Дети и подростки
Препарат Апидра® СолоСтар® можно применять у детей старше 6 лет и подростков. Клиническая информация по применению препарата у детей младше 6 лет ограничена.
Условия хранения
При температуре от 2 °С до 8 °С, в защищенном от света месте. Не замораживать. Хранить в недоступном для детей месте.
Особые указания
Перевод пациента на новый тип инсулина или инсулин другого производителя должен осуществляться под строгим медицинским наблюдением, так как может потребоваться изменение дозировки вследствие изменения концентрации инсулина, торговой марки (производителя), типа инсулина (растворимый, инсулин-изофан и т.д.), вида инсулина (животного происхождения) и/или способа производства. Кроме того, может потребоваться коррекция сопутствующей пероральной гипогликемической терапии. Использование неадекватных доз инсулина или прекращение лечения, особенно у пациентов с сахарным диабетом 1 типа, может привести к развитию гипергликемии и диабетического кетоацидоза — состояний, которые являются потенциально опасными для жизни.
Гипогликемия
Время, через которое развивается гипогликемия, зависит от скорости наступления эффекта используемых инсулинов и, в связи с этим, может изменяться при изменении схемы лечения. К условиям, которые могут изменить или сделать менее выраженными предвестники развития гипогликемии, относятся: длительное существование сахарного диабета, интенсификация инсулинотерапии, наличие диабетической нейропатии, прием некоторых лекарственных препаратов, таких как бета-адреноблокаторы, или перевод пациента С инсулина животного происхождения на человеческий инсулин.
Коррекция доз инсулина может также потребоваться в случае, если пациенты увеличивают физическую активность или изменяют свой обычный распорядок приема пищи. Физическая нагрузка, выполненная непосредственно после еды, может увеличить риск развития гипогликемии. По сравнению с растворимым человеческим инсулином после инъекции быстро действующих аналогов инсулина гипогликемия может развиваться раньше.
Некомпенсированные гипогликемическая или гипергликемическая реакции могут привести к потере сознания, развитию комы или смертельному исходу.
Потребность в инсулине может изменяться при заболеваниях или эмоциональных перегрузках.
Сочетание препарата Апидра® с пиоглитазоном
При применении инсулина в комбинации с пиоглитазоном отмечались случаи возникновения сердечной недостаточности, особенно у пациентов, имевших факторы риска ее развития. Необходимо учитывать этот факт, если планируется совместное назначение пиоглитазона и препарата Апидра®. При применении данной комбинации необходимо вести наблюдение за пациентами в отношении симптомов сердечной недостаточности, увеличения массы тела и отеков. При увеличении выраженности симптомов со стороны сердечно-сосудистой системы пиоглитазон необходимо отменить.
Дополнительная информация
Срок годности препарата в одноразовой шприц-ручке Апидра® СолоСтар® после первого использования — 4 недели. Рекомендуется отмечать на этикетке дату первого введения препарата.
Шприц-ручку Апидра® СолоСтар® нельзя охлаждать перед исподьзованием (инъекция охлажденного раствора является более болезненной).
После начала использования одноразовые шприц-ручки Апидра® СолоСтар® следует хранить при температуре не выше 25 °С в недоступном для детей месте, защищать от воздействия света.
Инструкция по использованию и обращению с предварительно заполненной шприц-ручкой СолоСтар®
Перед первым использованием шприц-ручку необходимо подержать при комнатной температуре 1-2 ч.
Перед использованием следует осмотреть картридж внутри шприц-ручки. Его следует использовать только в случае, если раствор прозрачен, бесцветен, не содержит видимых твердых частиц и по консистенции напоминает воду.
Пустые шприц-ручки СолоСтар® не должны использоваться повторно и подлежат уничтожению.
Для предотвращения инфицирования предварительно заполненная шприц-ручка должна использоваться только одним пациентом и не передаваться другому лицу.
Обращение со шприц-ручкой СолоСтар®
Перед использованием шприц-ручки СолоСтар® внимательно прочитайте информацию по использованию.
Важная информация по использованию шприц-ручки СолоСтар®
Перед каждым использованием необходимо с осторожностью подсоединить новую иглу к шприц-ручке и провести тест на безопасность. Необходима использовать только иглы, совместимые со шприц-ручкой СолоСтар®.
Необходимо принимать специальные меры предосторожности во избежание несчастных случаев, связанных с применением иглы, и возможностью переноса инфекции.
Ни в коем случае не используйте шприц-ручку СолоСтар® при ее повреждении или в том случае, если Вы не уверены, что она будет работать надлежащим образом.
Всегда имейте в наличии запасную шприц-ручку СолоСтар® на случай потери или повреждения Вашего экземпляра шприц-ручки СолоСтар®.
Инструкция по хранению
Пожалуйста, изучите раздел «Условия хранения» в отношении правил хранения шприц- ручки СолоСтар®.
Если шприц-ручка СолоСтар® хранится в холодильнике, извлеките ее оттуда за 1-2 ч до предполагаемой инъекцией, чтобы раствор принял комнатную температуру. Введение охлажденного инсулина является более болезненным.
Использованная шприц-ручка СолоСтар® должна подвергаться уничтожению.
Уход за шприц-ручкой СолоСтар®
Шприц-ручку СолоСтар® необходимо предохранять от пыли и грязи.
Внешнюю сторону шприц-ручки СолоСтар® можно очищать, протирая ее влажной тканью.
Не погружайте в жидкость, не промывайте и не смазывайте шприц-ручку СолоСтар® поскольку этим Вы можете ее повредить.
Шприц-ручка СолоСтар® точно дозирует инсулин и безопасна в работе. Она также требует бережного обращения. Избегайте ситуаций, при которых может произойти повреждение шприц-ручки СолоСтар®. Если Вы подозреваете, что Ваш экземпляр шприц-ручки СолоСтар® мог быть поврежден, используйте новую шприц-ручку.
Стадия 1. Контроль инсулина
Необходимо проверить этикетку на шприц-ручке СолоСтар® для того, чтобы убедиться, что он содержит соответствующий инсулин. Шприц-ручка Апидра® СолоСтар® синего цвета с темно-синей кнопкой с рельефным кольцом для введения инъекции. После снятия колпачка шприца-ручки контролируют внешний вид содержащегося в ней инсулина: раствор инсулина должен быть прозрачен, бесцветен, не содержать видимых твердых частиц и по консистенции напоминать воду.
Стадия 2. Подсоединение иглы
Необходимо использовать только иглы, совместимые со шприц-ручкой СолоСтар®.
Для каждой последующей инъекции всегда применяют новую стерильную иглу. После удаления колпачка иглу необходимо осторожно установить на шприц-ручке.
Стадия 3. Выполнение испытания на безопасность
Перед проведением каждой инъекции необходимо провести тест на безопасность и убедиться, что шприц-ручка и игла хорошо работают и пузырьки воздуха удалены.
- Отмеряют дозу, равную 2 единицам.
- Наружный и внутренний колпачки иглы должны быть сняты.
- Располагая шприц-ручку иглой вверх, осторожно постукивают по картриджу с инсулином пальцем таким образом, чтобы все пузырьки воздуха направились по направлению к игле.
- Полностью нажимают на кнопку введения инъекции.
- Если инсулин появляется на кончике иглы, это означает, что шприц-ручка и игла работают правильно.
- Если появления инсулина на кончике иглы не наблюдается, то стадия 3 может быть повторяться до тех пор, пока инсулин не появится на кончике иглы.
Стадия 4. Выбор дозы
Доза может быть установлена с точностью до 1 единицы от минимальной дозы 1 единица до максимальной дозы 80 единиц. Если необходимо ввести дозу, превышающую 80 единиц, следует провести 2 или более инъекций.
Дозировочное окошко должно показывать “0” после завершения испытания на безопасность. После этого может быть установлена необходимая доза.
Стадия 5. Введение дозы
Пациент должен быть проинформирован о технике проведения инъекции медицинским работником.
Иглу необходимо ввести под кожу.
Кнопка введения инъекции должна быть нажата полностью. Она удерживается в этом положении в течение еще 10 с до момента извлечения иглы. Таким образом, обеспечивается введение выбранной дозы инсулина полностью.
Стадия 6. Извлечение и выбрасывание иглы
Во всех случаях игла после каждой инъекции должна быть удалена и выброшена. Этим обеспечивается профилактика загрязнения и/или внесения инфекции, попадания воздуха в емкость для инсулина и утечки инсулина.
При удалении и выбрасывании иглы должны быть осуществлены специальные меры предосторожности. Соблюдайте рекомендованные меры безопасности для удаления и выбрасывания игл (например, техника надевания колпачка одной рукой) для того, чтобы уменьшить риск несчастных случаев, связанных с применением иглы, а также предотвращения инфицирования.
После удаления иглы следует закрыть шприц-ручку СолоСтар® колпачком.
Описание
Гипогликемическое средство — инсулина короткого действия аналог.
Фармакодинамика
Инсулин глулизин является рекомбинантным аналогом человеческого инсулина, который по силе действия равен обычному человеческому инсулину. После подкожного введения инсулин глулизин начинает действовать быстрее и имеет меньшую продолжительность действия, чем растворимый человеческий инсулин.
Наиболее важным действием инсулина и аналогов инсулина, включая инсулин глулизин, является регуляция обмена глюкозы. Инсулин снижает концентрацию глюкозы в крови, стимулируя поглощение глюкозы периферическими тканями, особенно скелетной мускулатурой и жировоц тканью, а также ингибируя образование глюкозы в печени.
Инсулин подавляет липолиз в адипоцитах, подавляет протеолиз и увеличивает синтез белка.
Исследования, проведенные у здоровых добровольцев и пациентов с сахарным диабетом, показали, что при подкожном введении инсулин глулизин начинает действовать быстрее и имеет меньшую продолжительность действия, чем растворимый человеческий инсулин.
При подкожном введении гипогликемическое действие инсулина глулизин начинается через 10-20 мин. При внутривенном введении гипогликемическое действие инсулина глулизин и растворимого человеческого инсулина являются равными по силе. Одна единица инсулина глулизин имеет ту же самую глюкозопонижающую активность, что и одна единица растворимого человеческого инсулина.
В исследовании фазы I у пациентов с сахарным диабетом 1 типа оценивались глюкозопонижающие профили инсулина глулизин и растворимого человеческого инсулина, вводившихся подкожно в дозе 0,15 ЕД/кг в разное время по отношению к стандартному 15-минутному приему пищи.
Результаты исследования показали, что инсулин глулизин, введенный за 2 мин до приема пищи, обеспечивал такой же гликемический контроль после приема пищи, что и растворимый человеческий инсулин, введенный за 30 мин до приема пищи. При введении за 2 мин до приема пищи инсулин глулизин обеспечивал лучший гликемический контроль после приема пищи, чем растворимый человеческий инсулин, введенный за 2 мин до приема пищи. Инсулин глулизин, введенный через 15 мин после начала приема пищи давал такой же гликемический контроль после приема пищи, что и растворимый человеческий инсулин, вводимый за 2 мин до приема пищи.
Исследование фазы I, проводившееся с инсулином глулизин, инсулином лизпро и растворимым человеческим инсулином у группы пациентов с ожирением, продемонстрировало, что у этих пациентов инсулин глулизин сохраняет свои характеристики быстрого действия. В этом исследовании время достижения 20% от полного AUC составляло 114 мин для инсулина глулизин, 121 мин для инсулина лизпро и 150 мин для растворимого человеческого инсулина, a AUС(0-2ч), отражающее также раннюю глюкозопонижающую активность, соответственно, составляло 427 мг/кг для инсулина глулизин, 354 мг/кг для инсулина лизпро, и 197 мг/кг для растворимого человеческого инсулина.
Клинические исследования
Сахарный диабет 1 типа
В 26-недельном клиническом исследовании фазы III, в котором проводилось сравнение инсулина глулизин с инсулином лизпро, вводившимися подкожно незадолго до приема пищи (за 0-15 мин) пациентам с сахарным диабетом 1 типа, использующим в качестве базального инсулина инсулин гларгин, инсулин глулизин был сопоставим с инсулином лизпро в отношении гликемического контроля, который оценивался по изменению концентрации гликированного гемоглобина (HbA1c) на момент конечной точки исследования в сравнении с исходом. Наблюдались сопоставимые значения концентрации глюкозы в крови, определяемые путем самоконтроля. При введении инсулина глулизин, в отличие от лечения инсулином лизпро, не потребовалось повышения дозы базального инсулина.
12-недельное клиническое исследование III фазы, проведенное у пациентов с сахарным диабетом 1 типа, получавших в качестве базальной терапии инсулин гларгин, показало, что эффективность введения инсулина глулизин непосредственно после еды была сопоставима с таковой при введении инсулина глулизин непосредственно перед приемом пищи (за 0-15 мин) или растворимого человеческого инсулина (за 30-45 мин до приема пищи).
В популяции пациентов, выполнивших протокол исследования, в группе пациентов, получавших перед приемом пищи инсулин глулизин, наблюдалось достоверно большее снижение HbA1c по сравнению с группой пациентов, получавших растворимый человеческий инсулин.
Сахарный диабет 2 типа
26-недельное клиническое исследование фазы III с последовавшим за ним 26-недельным продолжением в виде исследования безопасности было проведено для сравнения инсулина глулизин (за 0-15 мин до приема пищи) с растворимым человеческим инсулином (за 30-45 мин до приема пищи), которые вводились подкожно у пациентов с сахарным диабетом 2 типа, кроме этого использующих в качестве базального инсулина инсулин-изофан. Средний индекс массы тела пациентов составлял 34,55 кг/м2.
Инсулин глулизин показал большее снижение концентрации HbA1c от исходного значения по сравнению с растворимым человеческим инсулином (-0,46% для инсулина глулизин и — 0,30% для растворимого человеческого инсулина, р=0,0029).
В этом исследовании большинство пациентов (79%) смешивали свой инсулин короткого действия с инсулином-изофаном непосредственно перед инъекцией. 58 пациентов на момент рандомизации использовали пероральные гипогликемические препараты и получили инструкции по продолжению их приема в той же самой (неизмененной) дозе.
При проведении непрерывной подкфжной инфузии инсулина с помощью помпового устройства (при сахарном диабете 1 типа) у 59 пациентов, получавших лечение препаратом Апидра® СолоСтар® иди инсулином аспарт в обеих группах лечения наблюдалась низкая частота окклюзии катетера (0,08 окклюзий в месяц при применении препарата Апидра® СолоСтар® и 0,15 окклюзий в месяц при применении инсулина аспарт), а также подобная частота реакций в месте введения (10,3% при применении препарата Апидра® СолоСтар® и 13,3% при применении инсулина аспарт).
У детей и подростков с сахарным диабетом 1 типа, которым в качестве базального инсулина один раз в день вечером вводили инсулин гларгин или два раза в день утром и вечером инсулин-изофан, при сравнении эффективности и безопасности лечения инсулином глулизин и инсулином лизпро при их подкожном введении за 15 мин до приема пищи было показано, что гликемический контроль, частота развития гипогликемии, потребовавшей вмешательства третьих лиц, а также частота тяжелых гипогликемических эпизодов были сопоставимыми в обеих группах лечения. При этом через 26 недель лечения у пациентов, получавших лечение инсулином глулизин для достижения гликемического контроля, сопоставимого с инсулином лизпро, потребовалось достоверно меньшее увеличение суточных доз базального инсулина, быстро действующего инсулина и суммарной дозы инсулина.
Расовое происхождение и пол
В контролируемых клинических исследованиях у взрослых не было показано различий в безопасности и эффективности инсулина глулизин при анализе подгрупп, выделенных по расовой принадлежности полу.
Побочные действия
Наблюдавшиеся нежелательные реакции были реакциями, известными для этого фармакологического класса, и, следовательно, общими для любых инсулинов.
Частота побочных эффектов определялась в соответствии с классификацией Всемирной организации здравоохранения (ВОЗ): очень часто (≥ 10%), часто (≥ 1%, < 10%), нечасто (≥ 0,1%, < 1%), редко (≥ 0,01%, < 0,1%), очень редко, включая отдельные сообщения (< 0,01%), частота неизвестна (по имеющимся данным частоту определить не представляется возможным).
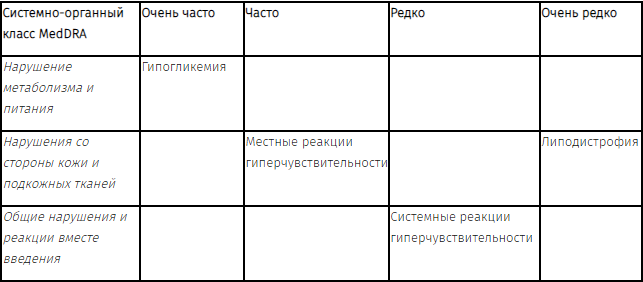
Нарушения метаболизма и питания
Гипогликемия, наиболее частый нежелательный эффект инсулинотерапии, может возникать в случае применения слишком высоких доз инсулина, превышающих потребность в нем.
Симптомы развития гипогликемии обычно возникают внезапно. Однако, обычно психоневрологическим нарушениям на фоне нейрогликопении (чувство усталости, необычная утомляемость или слабость, снижение способности к концентрации внимания, сонливость, зрительные расстройства, головная боль, тошнота, спутанность сознания или его потеря, судорожный синдром) предшествуют симптомы адренергической контррегуляции (активации симпато-адреналовой системы в ответ на гипогликемию): чувство голода, раздражительность, нервное возбуждение или тремор, беспокойство, бледность кожных покровов, «холодный» пот, тахикардия, выраженное сердцебиение (чем быстрее развивается гипогликемия и чем она тяжелее, тем сильнее выражены симптомы адренергической контррегуляции).
Эпизоды тяжелой гипогликемии, особенно повторяющиеся, могут приводить к поражению нервной системы. Длительная и выраженная гипогликемия может угрожать жизни пациентов, так как при нарастании гипогликемии возможен даже смертельный исход.
Нарушения со стороны кожи и подкожных тканей
Могут возникать местные реакции гиперчувствительности (гиперемия, отечность и зуд в месте инъекции инсулина). Эти реакции обычно исчезают через несколько дней или недель применения препарата. В некоторых случаях эти реакции могут быть не связаны с инсулином, а обусловлены раздражением кожи, вызванным антисептической обработкой ее перед инъекцией или неправильным проведением подкожной инъекции (при нарушении правильной техники проведения подкожной инъекции).
Как и при применении любых других инсулинов, в месте инъекций может развиться липодистрофия, что может замедлить абсорбцию инсулина. Развитию липодистрофии может способствовать нарушение чередования мест введения инсулина, так как введение препарата в одно и то же место может способствовать развитию липодистрофии.
Постоянное чередование мест инъекции в пределах одной из областей введения (область бедра, плеча, передней поверхности брюшной стенки) может способствовать уменьшению и профилактике развития этой нежелательной реакции.
Общие расстройства и нарушения в месте введения
Системные реакции гиперчувствительности включают крапивницу, чувство стеснения в груди, одышку, аллергический дерматит и зуд. Тяжелые случаи генерализованных аллергических реакций, включая анафилактические реакции, могут представлять опасность для жизни пациента.
Сообщалось о случайном введении других инсулинов по ошибке, особенно длительно действующих инсулинов, вместо инсулина глулизин.
Применение при беременности и кормлении грудью
Беременность
Отсутствуют контролируемые клинические исследования по применению препарата Апидра® СолоСтар® у беременных женщин.
Ограниченное количество данных, полученных по применению инсулина глулизин у беременных женщин (сообщалось о менее чем 300 исходах беременностей), не указывает на его неблагоприятное воздействие на течение беременности, внутриутробное развитие плода или на новорожденного ребенка.
Репродуктивные исследования на животных не выявили каких-либо различий между инсулином глулизин и человеческим инсулином в отношении течения беременности, эмбрионального/фетального развития, родов и постнатального развития.
Применение препарата Апидра® СолоСтар® у беременных должно проводиться с осторожностью. Обязателен тщательный мониторинг концентрации глюкозы в крови и поддержание гликемического контроля.
Пациенткам с имевшимся до беременности или гестационным сахарным диабетом необходимо в течение всей беременности поддерживать гликемический контроль. Во время первого триместра беременности потребность в инсулине может уменьшаться, а во время второго и третьего триместров она, как правило, может увеличиваться. Сразу же после родов потребность в инсулине быстро снижается.
Период грудного вскармливания
Неизвестно, экскретируется ли инсулин глулизин в грудное молоко. У женщин в период грудного вскармливания может потребоваться коррекция режима дозирования инсулина и диеты.
Взаимодействие
Исследований по фармакокинетическим взаимодействиям не проводилось. На основании имеющихся эмпирических знаний в отношении других подобных лекарственных средств возникновение клинически значимых фармакокинетических взаимодействий маловероятно. Некоторые лекарственные средства могут влиять на метаболизм глюкозы, что может потребовать коррекции доз инсулина глулизин и особенно тщательного контроля за лечением.
К веществам, способным увеличивать гипогликемическое действие инсулина и увеличивать предрасположенность к гипогликемии, относятся: пероральные гипогликемические средства, ингибиторы ангиотензинпревращающего фермента, дизопирамид, фибраты, флуоксетин, ингибиторы моноаминоксидазы, пентоксифиллин, пропоксифен, салицилаты и сульфаниламидные противомикробные средства.
К веществам, способным уменьшать гипогликемическое действие инсулина, относятся: глюкокортикостероиды, даназол, диазоксид, диуретики, глюкагон, изониазид, производные фейотиазина, соматропин, симпатомиметики (например, эпинефрин [адреналин], сальбутамол, тербуталин), гормоны щитовидной железы, эстрогены, гестагены (например, в гормональных контрацептивах), ингибиторы протеазы и атипичные нейролептики (например, оланзапин и клозапин).
Бета-адреноблокаторы, клонидин, соли лития или этанол могут потенцировать или ослаблять гипогликемическое действие инсулина.
Пентамидин может вызывать гипогликемию с последующей гипергликемией.
Кроме того, под влиянием лекарственных средств с симпатолитической активностью, таких как бета-адреноблокаторы, клонидин, гуанетидин и резерпин, симптомы рефлекторной адренергической активации в ответ на гипогликемию могут быть менее выраженными или отсутствовать.
Указания по совместимости
В связи с отсутствием исследований по совместимости, инсулин глулизин не следует смешивать с какими-либо другими лекарственными средствами, за исключением человеческого инсулина-изофана.
При применении препарата с помповым устройством для проведения непрерывной подкожной инфузии инсулина препарат нельзя смешивать с лекарственными препаратами.
Передозировка
При избытке дозы инсулина по отношению к потребности в нем, определяющейся потреблением пищи и энерготратами, может развиться гипогликемия.
Отсутствуют специальные данные относительно передозировки инсулина глулизин. Однако, при его передозировке возможно развитие гипогликемии.
Эпизоды легкой гипогликемии могут быть купированы с помощью приема глюкозы или продуктов, содержащих сахар. Поэтому рекомендуется, чтобы пациенты с сахарным диабетом постоянно имели при себе кусочки сахара, конфеты, печенье или сладкий фруктовый сок.
Эпизоды тяжелой гипогликемии с комой, судорогами и неврологическими расстройствами могут быть купированы внутримышечным или подкожным введением 0,5-1 мг глюкагона или внутривенным введением концентрированного (20%) раствора декстрозы (глюкозы) медицинским работником.
После восстановления сознания рекомендуется давать пациенту углеводы внутрь для предотвращения повторения гипогликемии, которое возможно после кажущегося клинического улучшения.
После введения глюкагона, для установления причины этой тяжелой гипогликемии и предотвращения развития других подобных эпизодов пациент должен наблюдаться в стационаре.
Влияние на способность к вождению автотранспорта и управлению механизмами
Гипергликемия и гипогликемия, а также зрительные расстройства, возникающие при их развитии, могут ухудшить способность к концентрации и замедлить психомоторные реакции пациента. Это может представлять риск при управлении им транспортными средствами и занятии другими потенциально опасными видами деятельности. Это особенно опасно у пациентов, у которых ослаблены или отсутствуют симптомы, предвещающие развитие гипогликемии, или у которых имеются частые эпизоды гипогликемии. Это следует учитывать в каждом конкретном случае для принятия решения о возможности или невозможности для пациента управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности. Пациентам следует рекомендовать во время управления транспортными средствами принимать меры предосторожности для того, чтобы избежать возможности развития гипогликемии.