Бравадин (Bravadin)
💊 Состав препарата Бравадин
✅ Применение препарата Бравадин
Описание активных компонентов препарата
Бравадин
(Bravadin)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.04.10
Владелец регистрационного удостоверения:
Лекарственные формы
| Бравадин |
Таб., покр. пленочной оболочкой, 5 мг: 14, 28, 30, 56, 60, 84, 90 или 98 шт. рег. №: ЛП-(001660)-(РГ-RU) |
|
|
Таб., покр. пленочной оболочкой, 7.5 мг: 14, 28, 30, 56, 60, 84, 90 или 98 шт. рег. №: ЛП-(001660)-(РГ-RU) |
Форма выпуска, упаковка и состав
препарата Бравадин
Таблетки, покрытые пленочной оболочкой бледно-оранжевого цвета, овальные, двояковыпуклые, с риской на одной стороне; вид на изломе — белая шероховатая масса с пленочной оболочкой бледно-оранжевого цвета.
Вспомогательные вещества: лактозы моногидрат — 64.636 мг, целлюлоза микрокристаллическая — 20 мг, повидон К30 — 6 мг, кроскармеллоза натрия — 2 мг, кремния диоксид коллоидный — 0.5 мг, магния стеарат — 1 мг.
Состав пленочной оболочки: Опадрай оранжевый 03H32599 — 3 мг (гипромеллоза — 71.714%, титана диоксид (Е171) — 15.936%, тальк — 6.972%, пропиленгликоль — 4.98%, краситель железа оксид желтый (Е172) — 0.332%, краситель железа оксид красный (Е172) — 0.066%).
14 шт. — упаковки ячейковые контурные (1) — пачки картонные.
14 шт. — упаковки ячейковые контурные (2) — пачки картонные.
14 шт. — упаковки ячейковые контурные (4) — пачки картонные.
14 шт. — упаковки ячейковые контурные (6) — пачки картонные.
14 шт. — упаковки ячейковые контурные (7) — пачки картонные.
15 шт. — упаковки ячейковые контурные (2) — пачки картонные.
15 шт. — упаковки ячейковые контурные (4) — пачки картонные.
15 шт. — упаковки ячейковые контурные (6) — пачки картонные.
Таблетки, покрытые пленочной оболочкой бледно-оранжевого цвета, круглые, слегка двояковыпуклые, с фаской; вид на изломе — белая шероховатая масса с пленочной оболочкой бледно-оранжевого цвета.
Вспомогательные вещества: лактозы моногидрат — 96.954 мг, целлюлоза микрокристаллическая — 30 мг, повидон К30 — 9 мг, кроскармеллоза натрия — 3 мг, кремния диоксид коллоидный — 0.75 мг, магния стеарат — 1.5 мг.
Состав пленочной оболочки: Опадрай оранжевый 03H32599 — 4.5 мг (гипромеллоза — 71.714%, титана диоксид (Е171) — 15.936%, тальк — 6.972%, пропиленгликоль — 4.98%, краситель железа оксид желтый (Е172) — 0.332%, краситель железа оксид красный (Е172) — 0.066%).
14 шт. — упаковки ячейковые контурные (1) — пачки картонные.
14 шт. — упаковки ячейковые контурные (2) — пачки картонные.
14 шт. — упаковки ячейковые контурные (4) — пачки картонные.
14 шт. — упаковки ячейковые контурные (6) — пачки картонные.
14 шт. — упаковки ячейковые контурные (7) — пачки картонные.
15 шт. — упаковки ячейковые контурные (2) — пачки картонные.
15 шт. — упаковки ячейковые контурные (4) — пачки картонные.
15 шт. — упаковки ячейковые контурные (6) — пачки картонные.
Фармакологическое действие
Антиангинальное средство. Механизм действия заключается в селективном и специфическом ингибировании If каналов синусового узла, контролирующих спонтанную диастолическую деполяризацию в синусовом узле и регулирующих ЧСС.
Ивабрадин оказывает селективное воздействие на синусовый узел, не влияя на время проведения импульсов по внутрипредсердным, предсердно-желудочковым и внутрижелудочковым проводящим путям, а также сократительную способность миокарда и реполяризацию желудочков.
Основным фармакодинамическим свойством ивабрадина является специфическое, дозозависимое уменьшение ЧСС. Анализ зависимости величины уменьшения ЧСС при дозе более 20 мг 2 раза/сут выявил тенденцию к достижению эффекта плато, что снижает риск развития тяжелой, плохо переносимой брадикардии (ЧСС менее 40 уд./мин).
При применении в рекомендуемых дозах уменьшение ЧСС составляет примерно 10-15 уд./мин в покое и при физической нагрузке. В результате снижается работа сердца и уменьшается потребность миокарда в кислороде.
Ивабрадин также способен взаимодействовать с Ih каналами сетчатки глаза, сходными с If каналами сердца. Ih канал участвует в возникновении временного изменения разрешающей способности зрительной системы, т.к. сокращает реакцию сетчатки на яркие световые стимулы. При провоцирующих обстоятельствах (например, быстрая смена яркости) ивабрадин частично ингибирует электрический импульс Ih, что иногда у некоторых пациентов приводит к возникновению световых ощущений (фосфенов), которые описываются как кратковременное ощущение повышенной яркости в ограниченной части поля зрения.
На фоне применения ивабрадина у пациентов с ХСН II-IV функционального класса по классификации NYHA с ФВЛЖ менее 35% показано клинически и статистически значимое снижение относительного риска наступления осложнений (частоты летальных исходов от сердечно-сосудистых заболеваний и снижение частоты госпитализаций в связи с усилением симптомов течения ХСН) на 18%. Абсолютное снижение риска составило 4.2%. Выраженный терапевтический эффект наблюдался через 3 мес от начала терапии.
Фармакокинетика
Фармакокинетика ивабрадина в дозе от 0.5 до 24 мг является линейной.
После приема внутрь ивабрадин быстро и практически полностью абсорбируется из ЖКТ. Cmax в плазме крови достигается примерно через 1 ч после приема внутрь натощак. Биодоступность составляет приблизительно 40%, что обусловлено эффектом «первого прохождения» через печень. Прием пищи увеличивает время абсорбции приблизительно на 1 ч и повышает концентрацию в плазме крови на 20-30%. Связывание с белками плазмы крови — около 70%.Vd составляет около 100 л. Cssmax в плазме крови после длительного применения в рекомендуемой дозе по 5 мг 2 раза/сут составляет приблизительно 20 нг/мл (CV=29%). Средняя Css в плазме крови составляет 10 нг/мл (CV=38%).
Ивабрадин в значительной степени метаболизируется в печени и кишечнике путем окисления в присутствии изофермента CYP3A4. Основным активным метаболитом является N-десметилированное производное (S18982), его часть составляет 40% дозы исходного соединения. Метаболизм активного метаболита ивабрадина также происходит в присутствии изофермента CYP3A4.
T1/2 ивабрадина составляет 2 ч (70-75% AUC) и эффективный T1/2 составляет 11 ч. Общий клиренс составляет примерно 400 мл/мин, почечный — около 70 мл/мин. Экскреция метаболитов происходит с одинаковой скоростью с мочой и калом. Около 4% принятой внутрь дозы выводится с мочой в неизменном виде.
У пациентов с почечной недостаточностью (КК 15-60 мл/мин) изменения фармакокинетических показателей минимальны в связи с низким участием почечного клиренса (около 20%) в общем выведении ивабрадина и его основного метаболита S18982.
У пациентов с легкой степенью печеночной недостаточности (до 7 баллов по шкале Чайлд-Пью) AUC ивабрадина и его активного метаболита на 20% больше, чем при нормальной функции печени.
Показания активных веществ препарата
Бравадин
Лечение стабильной стенокардии у пациентов с нормальным синусовым ритмом: при непереносимости или противопоказаниях к применению бета-адреноблокаторов; в комбинации с бета-адреноблокаторами при неадекватном контроле стабильной стенокардии на фоне оптимальной дозы бета-адреноблокатора.
Хроническая сердечная недостаточность: для снижения частоты развития сердечно-сосудистых осложнений у пациентов с хронической сердечной недостаточностью, с синусовым ритмом и ЧСС не менее 70 уд./мин.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Средняя рекомендуемая начальная доза ивабрадина составляет 5 мг 2 раза/сут (10 мг/сут). В зависимости от терапевтического эффекта через 3-4 недели применения доза может быть повышена до 7.5 мг 2 раза/сут (15 мг/сут).
Если на фоне терапии величина ЧСС снижается до значений менее 50 уд./мин или возникают симптомы, связанные с брадикардией (такие как головокружение, усталость или артериальная гипотензия), следует подобрать более низкую дозу; при необходимости доза может быть снижена до 2.5 мг 2 раза/сут. Если ЧСС остается менее 50 уд./мин и симптомы брадикардии не проходят, то лечение прекращают.
У пациентов пожилого возраста рекомендуется начинать лечение с начальной дозы 2.5 мг 2 раза/сут. В дальнейшем возможно увеличение суточной дозы в зависимости от состояния пациента.
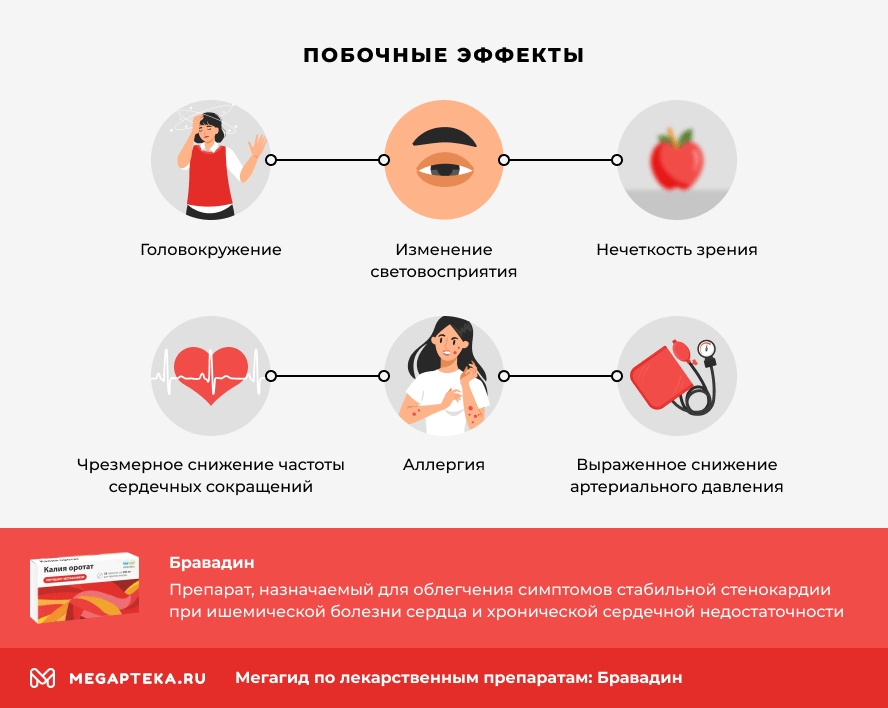
Побочное действие
Со стороны органов чувств: очень часто — изменения световосприятия (фотопсия); часто — нечеткость зрения; нечасто — вертиго; неуточненной частоты — диплопия, нарушение зрения.
Со стороны сердечно-сосудистой системы: часто — брадикардия, AV-блокада I степени, желудочковая экстрасистолия, кратковременное повышение АД; нечасто — ощущение сердцебиения, наджелудочковая экстрасистолия; очень редко — фибрилляция предсердий, AV-блокада II и III степени, СССУ; неуточненной частоты — выраженное снижение АД, возможно, связанное с брадикардией.
Со стороны пищеварительной системы: нечасто — тошнота, запор, диарея.
Со стороны ЦНС: часто — головная боль (особенно в первый месяц терапии), головокружение, возможно связанное с брадикардией; неуточненной частоты — обморок, возможно связанный с брадикардией.
Со стороны дыхательной системы: нечасто — одышка.
Противопоказания к применению
Брадикардия (ЧСС в покое ниже 60 уд./мин до начала лечения); кардиогенный шок; острый инфаркт миокарда; тяжелая артериальная гипотензия (систолическое АД ниже 90 мм рт.ст. и диастолическое АД ниже 50 мм рт.ст.); тяжелая печеночная недостаточность (более 9 баллов по шкале Чайлд-Пью); СССУ; синоатриальная блокада; хроническая сердечная недостаточность III и IV функционального класса по классификации NYHA; наличие искусственного водителя ритма, работающего в режиме постоянной стимуляции; нестабильная стенокардия; AV-блокада III степени; беременность; период лактации (грудного вскармливания); детский и подростковый возраст до 18 лет; одновременное применение с сильными ингибиторами изофермента CYP3A4, такими как противогрибковые средства группы азолов (кетоконазол, итраконазол), антибиотиками группы макролидов (кларитромицин, эритромицин для приема внутрь, джозамицин, телитромицин), ингибиторами ВИЧ-протеазы (нелфинавир, ритонавир) и нефазодон; повышенная чувствительность к ивабрадину.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Применение при нарушениях функции печени
Противопоказан при тяжелой печеночной недостаточности. С осторожностью следует применять у пациентов с умеренной печеночной недостаточностью.
Применение при нарушениях функции почек
С осторожностью следует применять у пациентов с КК ниже 15 мл/мин.
Применение у детей
Не рекомендуется применять у детей и подростков в возрасте до 18 лет.
Особые указания
С осторожностью следует применять при умеренно выраженной печеночной недостаточности (менее 9 баллов по шкале Чайлд-Пью); почечной недостаточности тяжелой степени (КК<15 мл/мин); врожденном удлинении интервала QT; одновременно с приемом лекарственных средств, удлиняющих интервал QT (риск развития тяжелой желудочковой аритмии типа «пируэт»); одновременно с приемом умеренных ингибиторов и индукторов изоферментов CYP3A4 и грейпфрутового сока; при AV-блокаде II степени; недавно перенесенном инсульте; пигментной дегенерации сетчатки (retinitis pigmentosa); артериальной гипотензии; хронической сердечной недостаточности IV функционального класса по классификации NYHA; одновременно с приемом блокаторов медленных кальциевых каналов, урежающих ЧСС, таких как верапамил или дилтиазем; одновременно с приемом некалийсберегающих диуретиков.
Ивабрадин не эффективен для лечения или профилактики аритмий. Его эффективность падает на фоне развития тахиаритмии (например, желудочковой или наджелудочковой пароксизмальной тахикардии).
Не рекомендуется применять у пациентов с фибрилляцией предсердий (мерцательной аритмией) или другими типами аритмий, связанных с функцией синусового узла.
Во время терапии ивабрадином рекомендуется проводить регулярный контроль состояния пациента на предмет развития фибрилляции предсердий (пароксизмальной или постоянной). При клинических показаниях (например, ухудшение течения стенокардии, появление ощущения сердцебиения, нерегулярность сердечного ритма) следует регулярно контролировать ЭКГ.
Риск развития фибрилляции предсердий может быть выше у пациентов с хронической сердечной недостаточностью, принимающих ивабрадин. Фибрилляция предсердий чаще встречалась среди пациентов, которые одновременно с ивабрадином принимали амиодарон или антиаритмические препараты I класса.
Перед решением вопроса о применении ивабрадина течение сердечной недостаточности должно быть стабильным. Пациентам с хронической сердечной недостаточностью и нарушениями внутрижелудочковой проводимости (блокада левой или правой ножки пучка Гиса) и желудочковой диссинхронией требуется постоянный медицинский контроль.
Не доказано увеличение риска развития выраженной брадикардии на фоне приема ивабрадина при восстановлении синусового ритма во время фармакологической кардиоверсии. Тем не менее, из-за отсутствия достаточного количества данных, при возможности отсрочить плановую электрическую кардиоверсию, прием ивабрадина следует прекратить за 24 ч до ее проведения.
Снижение ЧСС вследствие приема ивабрадина может усугубить удлинение интервала QT, что, в свою очередь, может спровоцировать развитие тяжелой формы аритмии, в частности, полиморфной желудочковой тахикардии типа «пируэт».
Влияние на способность к управлению транспортными средствами и механизмами
В период лечения пациенту следует проявлять осторожность при занятии потенциально опасными видами деятельности, требующими высокой скорости психомоторных реакций в ситуациях, когда могут произойти внезапные изменения освещенности, особенно в ночное время.
Лекарственное взаимодействие
При совместном применении с ивабрадином лекарственных средств, увеличивающих интервал QT (хинидин, дизопирамид, бепридил, соталол, ибутилид, амиодарон, пимозид, зипрасидон, сертиндол, мефлохин, галофантрин, пентамидин, цизаприд, эритромицин в/в), возможно усиление урежения ЧСС и дополнительное удлинение интервала QT. При необходимости одновременной терапии следует тщательно контролировать показатели ЭКГ (такие комбинации не рекомендуются).
Ивабрадин метаболизируется в печени при участии изофермента CYP3A4 и является очень слабым ингибитором данного изофермента. Ивабрадин не оказывает существенного влияния на метаболизм и концентрацию в плазме крови других субстратов (сильных, умеренных и слабых ингибиторов) цитохрома CYP3A4. В то же время, ингибиторы и индукторы изофермента CYP3A4 могут вступать во взаимодействие с ивабрадином и оказывать клинически значимое влияние на его метаболизм и фармакокинетические свойства. Было установлено, что ингибиторы изофермента CYP3A4 повышают, а индукторы изофермента CYP3A4 уменьшают плазменные концентрации ивабрадина. Повышение концентрации ивабрадина в плазме крови может увеличивать риск развития выраженной брадикардии.
Противопоказано одновременное применение с сильными ингибиторами изофермента CYP3A4, такими как противогрибковые средства группы азолов (кетоконазол, итраконазол), антибиотики макролиды (кларитромицин, эритромицин пероральный, джозамицин, телитромицин), ингибиторы ВИЧ-протеаз (нелфинавир, ритонавир, нефазодон) из-за повышения концентрации ивабрадина в плазме крови и риска развития чрезмерной брадикардии.
Одновременное применение ивабрадина и умеренных ингибиторов изофермента CYP3A4 дилтиазема или верапамила (средств, урежающих сердечный ритм) у здоровых добровольцев и пациентов сопровождалось увеличением AUC ивабрадина в 2-3 раза и дополнительным урежением ЧСС на 5 уд./мин. Данные комбинации не рекомендуются.
Индукторы изофермента CYP3A4, такие как рифампицин, барбитураты, фенитоин и растительные препараты, содержащие зверобой продырявленный (Hypericum perforatum), при совместном применении с ивабрадином могут привести к снижению концентрации в крови и активности ивабрадина (может потребоваться применение препарата в более высокой дозе). При совместном применении ивабрадина и препаратов, содержащих зверобой продырявленный, было отмечено двукратное уменьшение AUC ивабрадина. В период применения ивабрадина следует уменьшить прием растительных препаратов, содержащих зверобой продырявленный.
Применение ивабрадина в комбинации с прочими умеренными ингибиторами изофермента CYP3A4 (например, флуконазолом) возможно при условии, что ЧСС в покое составляет более 60 уд./мин. Рекомендуемая начальная доза ивабрадина — по 2.5 мг 2 раза/сут. Необходим контроль ЧСС.
Следует с осторожностью применять ивабрадин с некалийсберегающими диуретиками (тиазидные и «петлевые» диуретики), т.к. гипокалиемия может повысить риск развития аритмии. Поскольку ивабрадин может вызывать брадикардию, сочетание гипокалиемии и брадикардии является предрасполагающим фактором для развития тяжелой формы аритмии, особенно у пациентов с синдромом удлинения интервала QT, как врожденным, так и вызванным воздействием каких-либо веществ.
При употреблении грейпфрутового сока на фоне применения ивабрадина отмечалось повышение концентрации ивабрадина в крови в 2 раза. В период терапии ивабрадином прием грейпфрутового сока необходимо сократить.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
на 1 таблетку 5 мг
Ядро
Действующее вещество:
Ивабрадина гидробромид 5,864 мг, что соответствует ивабрадину 5 мг
Вспомогательные вещества: лактозы моногидрат 64,636 мг, целлюлоза микрокристаллическая 20,000 мг, повидон 6,000 мг, кроскармеллоза натрия 2,000 мг, кремния диоксид коллоидный 0,500 мг, магния стеарат 1,000 мг
Оболочка пленочная: Опадрай оранжевый 03Н325991 3,000 мг
на 1 таблетку 7,5 мг
Ядро
Действующее вещество:
Ивабрадина гидробромид 8,796 мг, что соответствует ивабрадину 7,5 мг
Вспомогательные вещества: лактозы моногидрат 96,954 мг, целлюлоза микрокристаллическая 30,000 мг, повидон 9,000 мг, кроскармеллоза натрия 3,000 мг, кремния диоксид коллоидный 0,750 мг, магния стеарат 1,500 мг
Оболочка пленочная: Опадрай оранжевый 03Н325991 4,500 мг
1Состав Опадрая оранжевого 03Н32599:
гипромеллоза 71.714 %. титана диоксид (Е171) 15,936 %, тальк 6,972 %, пропиленгликоль 4,980 %, краситель железа оксид желтый (Е 172) 0,332 %, краситель железа оксид красный (Е 172) 0,066 %.
Таблетки 5 мг. Овальные, двояковыпуклые таблетки, покрытые пленочной оболочкой бледно-оранжевого цвета, с риской на одной стороне. Вид на изломе: белая шероховатая масса с пленочной оболочкой бледно-оранжевого цвета.
Таблетки 7,5 мг. Круглые, слегка двояковыпуклые таблетки, покрытые пленочной оболочкой бледно-оранжевого цвета, с фаской. Вид на изломе: белая шероховатая масса с пленочной оболочкой бледно-оранжевого цвета.
антиангинальное средство
КодАТХ
С01ЕВ17
Фармакодинамика
Ивабрадин — препарат, замедляющий ритм сердца, механизм действия которого заключается в селективном и специфическом ингибировании If каналов синусового узла, контролирующего спонтанную диастолическую деполяризацию синусового узла и регулирующего частоту сердечных сокращений (ЧСС). Ивабрадин оказывает селективное воздействие на синусовый узел, не влияя на время проведения импульсов по внутрипредсердным, предсердно-желудочковым и внутрижелудочковым проводящим путям, а также на сократительную способность миокарда и реполяризацию желудочков. Ивабрадин также может взаимодействовать с Ih каналами сетчатки глаза, сходными с If каналами сердца, участвующими в возникновении временного изменения системы зрительного восприятия за счет изменения реакции сетчатки глаза на яркие световые стимулы. В провоцирующих условиях (резкое изменение яркости освещения) происходит частичное ингибирование ивабрадином Ih каналов, которое вызывает преходящее изменение яркости в ограниченной области зрительного поля (фотопсия). Основным фармакодинамическим свойством ивабрадина является дозозависимое урежение ЧСС. Анализ зависимости величины урежения ЧСС от дозы ивабрадина проводился при постепенном увеличении дозы до 20 мг два раза в сутки и выявил тенденцию к достижению эффекта «плато», когда не происходит нарастания терапевтического эффекта при дальнейшем увеличении дозы, что снижает риск развития тяжелой брадикардии (ЧСС менее 40 уд/мин).
В рекомендуемых дозах урежение ЧСС составляет около 10-15 уд/мин в покое и при физической нагрузке. Это приводит к снижению нагрузки на миокард в связи с уменьшением потребности миокарда в кислороде. Ивабрадин не влияет на внутрисердечную проводимость, сократительную способность миокарда (отсутствие отрицательного инотропного действия) либо желудочковую реполяризацию:
- в электрофизиологических исследованиях ивабрадин не оказывал влияния на время проведения импульсов по предсердно-желудочковым или внутрижелудочковым путям, а также на скорректированный интервал QT;
- у пациентов с дисфункцией левого желудочка (фракция выброса левого желудочка (ФВЛЖ) от 30 до 45 %) ивабрадин не оказывал негативного влияния на ФВЛЖ.
Фармакокинетика
Ивабрадин является S-энантиомером, не демонстрирующим биологического преобразования в исследованиях in vivo. N-десметилированное производное ивабрадина является основным активным метаболитом.
Всасывание и биодоступность
Ивабрадин быстро и почти полностью всасывается в желудочно-кишечном тракте после приема внутрь натощак с достижением максимальной концентрации (Сmах) в плазме крови приблизительно через 1 час. Абсолютная биодоступность составляет около 40 % и обусловлена эффектом «первичного прохождения» через печень.
Прием пищи увеличивает время абсорбции ивабрадина приблизительно на 1 час и повышает концентрацию в плазме крови с 20 до 30 %. Рекомендуется принимать таблетки во время приема пищи с целью понижения вариабельности концентрации.
Распределение
Ивабрадин связывается с белками плазмы крови приблизительно на 70 %, объем распределения у пациентов в равновесном состоянии составляет около 100 л. Сmах ивабрадина в плазме крови после длительного применения внутрь дозы 5 мг два раза в сутки составляет 22 нг/мл (коэффициент вариации (КВ)=29 %). Средняя равновесная концентрация в плазме крови составляет 10 нг/мл (КВ=38 %).
Метаболизм
Ивабрадин в значительной степени подвергается метаболизму в печени и кишечнике путем окисления с помощью цитохрома Р450 ЗА4 (изофермента CYP3A4). Основным активным метаболитом является N-десметилированное производное (S 18982) с концентрацией около 40 % по отношению к концентрации исходного вещества. Метаболизм данного активного метаболита также происходит при участии изофермента CYP3A4. Ивабрадин имеет низкую степень сродства к изоферменту CYP3A4, не демонстрирует клинически значимой индукции или ингибирования изофермента CYP3A4, поэтому изменение метаболизма или концентрации субстратов изофермента CYP3A4 в плазме крови под действием ивабрадина является маловероятным. Наоборот, сильные ингибиторы и индукторы цитохрома Р450 могут значительно влиять на концентрацию ивабрадина в плазме крови.
Выведение
Период полувыведения (Т1/2) ивабрадина составляет, в среднем, 2 часа (70-75 % по отношению к площади под кривой «концентрация/время» (AUC) в плазме крови), эффективный T Т1/2 — 11 часов. Общий клиренс составляет около 400 мл/мин, почечный клиренс — около 70 мл/мин. Выведение метаболитов происходит в одинаковой степени через кишечник и почками. Около 4 % принятой внутрь дозы выводится в неизмененном виде почками.
Линейность/нелинейность
Фармакокинетика ивабрадина является линейной в диапазоне доз 0,5-24 мг.
Особые группы пациентов
Пациенты пожилого и старческого возраста
Фармакокинетические показатели (AUC и Cmax) существенно не отличаются у пациентов 65 лет и старше, 75 лет и старше и общей популяции пациентов.
Нарушение функции почек
Изменение кинетики ивабрадина у пациентов с почечной недостаточностью (клиренс креатинина (КК) 15-60 мл/мин) минимально, так как лишь около 20 % ивабрадина и его активного метаболита S 18982 выводится почками.
Нарушение функции печени
У пациентов с легкой степенью печеночной недостаточности (до 7 баллов по шкале Чайлд-Пью) AUC ивабрадина и его метаболита на 20 % больше, чем у пациентов с нормальной функцией печени. Данные о применении ивабрадина у пациентов с умеренной печеночной недостаточностью (7-9 баллов по шкале Чайлд-Пью) ограничены и не позволяют сделать вывод об особенностях фармакокинетики ивабрадина у данной группы пациентов, а у пациентов с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пью) отсутствуют.
Взаимосвязь между фармакокинетическими и фармакодинамическими свойствами
Урежение ЧСС имеет прямую пропорциональную зависимость от увеличения в плазме крови концентраций ивабрадина и активного метаболита S 18982 при приеме в дозах 15-20 мг два раза в сутки. При более высоких дозах препарата урежение сердечного ритма не имеет пропорциональной зависимости от концентрации ивабрадина в плазме крови и характеризуется тенденцией к достижению эффекта «плато».
Высокие концентрации ивабрадина в плазме крови, которые можно достичь при одновременном применении ивабрадина с сильными ингибиторами изофермента CYP3A4, могут приводить к выраженному урежению ЧСС, однако этот риск снижается при одновременном применении с умеренными ингибиторами изофермента CYP3А4.
Стабильная стенокардия
Терапия стабильной стенокардии у взрослых пациентов с нормальным синусовым ритмом:
- при непереносимости или наличии противопоказаний к применению бета-адреноблокаторов;
- в комбинации с бета-адреноблокаторами при неадекватном контроле стабильной стенокардии на фоне оптимальной дозы бета-адреноблокатора.
Хроническая сердечная недостаточность
Для снижения частоты развития сердечно-сосудистых осложнений (смертность от сердечно-сосудистых заболеваний и госпитализации в связи с усилением симптомов хронической сердечной недостаточности (ХСН)) у пациентов с ХСН, с синусовым ритмом и ЧСС не менее 70 уд/мин.
- Повышенная чувствительность к ивабрадину или любому из вспомогательных компонентов препарата.
- Брадикардия (ЧСС в покое менее 60 уд/мин (до начала лечения)).
- Кардиогенный шок.
- Острый инфаркт миокарда.
- Тяжелая артериальная гипотензия (систолическое артериальное давление (АД) менее 90 мм рт.ст. и диастолическое АД менее 50 мм рт.ст.).
- Тяжелая печеночная недостаточность (более 9 баллов по шкале Чайлд-Пью).
- Синдром слабости синусового узла.
- Синоатриальная блокада.
- Нестабильная или острая сердечная недостаточность.
- Наличие искусственного водителя ритма, работающего в режиме постоянной стимуляции.
- Нестабильная стенокардия.
- Атриовентрикулярная блокада (AV) III степени.
- Одновременное применение с сильными ингибиторами изоферментов системы цитохрома Р450 ЗА4, такими как противогрибковые средства группы азолов (кетоконазол, итраконазол), антибиотики из группы макролидов (кларитромицин, эритромицин для приема внутрь, джозамицин, телитромицин), ингибиторы ВИЧ-протеазы (нелфинавир, ритонавир) и нефазодон.
- Беременность и период грудного вскармливания.
- Возраст до 18 лет (эффективность и безопасность препарата в данной возрастной группе не изучалась).
- Дефицит лактазы, непереносимость лактозы, синдром глюкозо-галактозной мальабсорбции.
С осторожностью: умеренно выраженная печеночная недостаточность (менее 9 баллов по шкале Чайлд-Пью), тяжелая почечная недостаточность (КК менее 15 мл/мин), врожденное удлинение интервала QT, одновременное применение лекарственных средств (ЛС), удлиняющих интервал QT, одновременное применение умеренных ингибиторов и индукторов изофермента CYP3A4 и грейпфрутового сока, бессимптомная дисфункция левого желудочка, AV блокада II степени, недавно перенесенный инсульт, пигментная дегенерация сетчатки (retinitis pigmentosa), артериальная гипотензия, ХСН IV функционального класса по классификации NYHA, одновременное применение с блокаторами «медленных» кальциевых каналов (БМКК), урежающими ЧСС (верапамил или дилтиазем), одновременное применение с некалийсберегающими диуретиками.
Применение при беременности и в период грудного вскармливания
Беременность
Исследования на животных продемонстрировали присутствие репродуктивной токсичности, эмбриотоксичности и тератогенного действия.
Препарат Бравадин® противопоказан для применения при беременности в связи с недостаточным количеством данных по безопасности.
Период грудного вскармливания
Применение препарата Бравадин® в период грудного вскармливания противопоказано.
Неизвестно проникает ли ивабрадин в грудное молоко.
При необходимости применения препарата Бравадин в период лактации грудное вскармливание следует прекратить.
Способ применения и дозировка
Внутрь, два раза в сутки (утром и вечером) во время приема пищи. 6
Стабильная стенокардия
Рекомендуемая начальная доза составляет 10 мг в сутки (по 1 таблетке 5 мг два раза в сутки). Через 3-4 недели терапии доза может быть увеличена до 15 мг в
сутки (по 1 таблетке 7,5 мг два раза в сутки) в зависимости от терапевтического эффекта. Если во время применения препарата Бравадин® ЧСС в покое урежается менее 50 уд/мин, или у пациента возникают симптомы, связанные с брадикардией (головокружение, повышенная утомляемость или выраженное снижение АД), дозу препарата Бравадин® необходимо уменьшить до 2,5 мг (по 1Л таблетки 5 мг) два раза в сутки.
Терапию препаратом Бравадин следует прекратить, если при снижении дозы препарата Бравадин ЧСС остается менее 50 уд/мин или сохраняются симптомы выраженной брадикардии.
Хроническая сердечная недостаточность
Рекомендуемая начальная доза составляет 10 мг в сутки (по 1 таблетке 5 мг два раза в сутки).
Через 2 недели терапии доза может быть увеличена до 15 мг в сутки (по 1 таблетке 7,5 мг два раза в сутки), если ЧСС в покое стабильно более 60 уд/мин, или уменьшена до 2,5 мг (по 1Л таблетки 5 мг) два раза в сутки, если ЧСС стабильно менее 50 уд/мин или у пациента возникают симптомы, связанные с брадикардией (головокружение, повышенная утомляемость или выраженное снижение АД).
Если значение ЧСС находится в диапазоне 50-60 уд/мин, рекомендуется применять препарат Бравадин в дозе 5 мг два раза в сутки.
Если во время применения препарата Бравадин ЧСС в покое урежается менее 50 уд/мин или у пациента возникают симптомы, связанные с брадикардией, для пациентов, получающих препарат Бравадин® в дозе 5 мг два раза в сутки или 7,5 мг два раза в сутки, доза препарата должна быть снижена.
Если у пациентов, получающих препарат Бравадин® в дозе 2,5 мг (по 1/2 таблетки 5 мг) два раза в сутки или 5 мг два раза в сутки, ЧСС в покое стабильно более 60 уд/мин, доза препарата Бравадин может быть увеличена.
Если ЧСС остается менее 50 уд/мин или у пациента сохраняются симптомы, связанные с брадикардией, терапию препаратом Бравадин® следует прекратить.
Пациенты старше 75 лет
Пациентам в возрасте 75 лет и старше лечение следует начинать с более низкой дозы.
Рекомендуемая начальная доза составляет 2,5 мг (по 1/2 таблетки 5 мг) два раза в сутки.
В дальнейшем доза может быть увеличена. 7
Нарушение функции почек
Пациентам с нарушением функции почек (КК более 15 мл/мин) коррекции дозы не требуется.
Рекомендуемая начальная доза — 10 мг в сутки (по 1 таблетке 5 мг два раза в сутки). Через 3-4 недели терапии доза может быть увеличена до 15 мг в сутки (по 1 таблетке 7,5 мг два раза в сутки).
В связи с недостаточностью клинических данных препарат Бравадин следует применять с осторожностью у пациентов с КК менее 15 мл/мин.
Нарушение функции печени
Коррекции дозы не требуется у пациентов с легкой степенью печеночной недостаточности (до 7 баллов по шкале Чайлд-Пью). Следует соблюдать осторожность при применении препарата Бравадин у пациентов с умеренной печеночной недостаточностью (7- 9 баллов по шкале Чайлд-Пью). Пациентам с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пью) применение препарата Бравадин» противопоказано.
Дети и подростки
Безопасность и эффективность ивабрадина у детей и подростков в возрасте до 18 лет не установлены.
Применение ивабрадина изучалось в клинических исследованиях с участием почти 14000 пациентов. Наиболее часто побочные эффекты носили дозозависимый характер и были связаны с механизмом действия ивабрадина.
Классификация частоты развития побочных эффектов Всемирной организации здравоохранения (ВОЗ):
очень часто ? 1/10
часто от ? 1/100 до нечасто от ? 1/1000 до редко от? 1/10000 до очень редко от частота неизвестна — не может быть оценена на основе имеющихся данных.
В каждой группе нежелательные эффекты представлены в порядке уменьшения их серьезности.
Нарушения со стороны органа зрения:
очень часто: изменение световосприятия (фотопсия)*;
часто: нечеткость зрения.
Нарушения со стороны органа слуха и лабиринтные нарушения:
нечасто: вертиго.
Нарушения со стороны сердца и сосудов:
часто: неконтролируемое АД, брадикардия**, AV блокада I степени (удлиненный интервал PQ на электрокардиограмме (ЭКГ)), желудочковая экстрасистолия;
нечасто: ощущение сердцебиения, наджелудочковая экстрасистолия, выраженное снижение АД, возможно, связанное с брадикардией;
очень редко: фибрилляция предсердий, AV блокада II и III степени, синдром слабости синусового узла.
Нарушения со стороны нервной системы:
часто: головная боль (особенно в первый месяц терапии), головокружение, возможно, связанное с брадикардией;
частота неизвестна: обморок, возможно связанный с брадикардией.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
нечасто: одышка.
Нарушения со стороны кожи и подкожных тканей:
нечасто: ангионевротический отек, кожная сыпь;
редко: кожный зуд, эритема, крапивница.
Нарушения со стороны желудочно-кишечного тракта:
нечасто: тошнота, запор, диарея.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
нечасто: мышечные спазмы.
Общие расстройства и нарушения в месте введения:
нечасто: астения, повышенная утомляемость, возможно, связанные с брадикардией;
редко: недомогание, возможно, связанное с брадикардией.
Лабораторные и инструментальные данные:
нечасто: гиперурикемия, эозинофилия, повышение концентрации креатинина в плазме крови, удлинение интервала QT на ЭКГ.
* Изменение световосприятия (фотопсия) отмечалось у 14,5 % пациентов и описывалось как преходящее изменение яркости в ограниченной зоне зрительного поля. Как правило, подобные явления провоцировались резким изменением интенсивности освещения в зоне зрительного поля. В основном, фотопсия появлялась в первые два месяца терапии с последующим повторением. Выраженность фотопсии, как правило, была слабой или умеренной. Фотопсия прекращалась на фоне продолжения терапии (77,5 % случаев) или после ее завершения. Менее чем у 1 % пациентов появление фотопсии явилось причиной отказа от терапии.
** Брадикардия отмечалась у 3,3 % пациентов, особенно в первые 2-3 месяца терапии, у 0,5 % пациентов развивалась тяжелая брадикардия с ЧСС менее или равной 40 уд/мин.
Симптомы
Передозировка препарата Бравадин может приводить к тяжелой и продолжительной брадикардии.
Лечение
Лечение тяжелой брадикардии симптоматическое и должно осуществляться в условиях специализированных отделений стационара. В случае сочетания брадикардии с нарушением показателей гемодинамики необходимо применение бета-адреномиметиков (изопреналин). При необходимости — установка искусственного водителя ритма.
Фармакодинамическое взаимодействие Одновременное применение не рекомендуется
ЛС, удлиняющие интервал QT:
— антиаритмические средства, удлиняющие интервал QT (например, хинидин, дизопирамид, бепридил, соталол, ибутилид, амиодарон);
— ЛС, удлиняющие интервал QT, не относящиеся к антиаритмическим средствам (например, пимозид, зипрасидон, сертиндол, мефлохин, галофантрин, пентамидин, цизаприд, эритромицин для внутривенного введения).
Одновременное применение ивабрадина и ЛС, удлиняющих интервал QT, не рекомендуется, поскольку урежение ЧСС может вызвать дополнительное удлинение интервала QT. При необходимости одновременного применения требуется тщательный контроль ЭКГ.
Одновременное применение, требующее осторожности
Некалийсберегающие диуретики (тиазидные и «петлевые»)
Гипокалиемия может повысить риск развития аритмии. Поскольку применение ивабрадина может вызывать брадикардию, сочетание гипокалиемии и брадикардии является предрасполагающим фактором для развития тяжелой формы аритмии, особенно у пациентов с синдромом удлиненного интервала QT, как врожденным, так и вызванным применением ЛС.
Фармакокинетическое взаимодействие
Цитохром Р450 ЗА4 (изофермент CYP3A4)
Ивабрадин подвергается метаболизму в печени с участием только изофермента CYP3A4 и является очень слабым ингибитором данного цитохрома. Не воздействует на метаболизм и концентрацию в плазме крови других субстратов (сильных, умеренных и слабых ингибиторов) изофермента CYP3A4. Ингибиторы и индукторы изофермента CYP3A4 могут вступать во взаимодействие с ивабрадином и оказывать клинически значимое влияние на его метаболизм и фармакокинетические свойства.
Ингибиторы изофермента CYP3A4 повышают, а индукторы изофермента CYP3A4 снижают концентрацию ивабрадина в плазме крови. Повышение концентрации ивабрадина в плазме крови может вызывать риск развития тяжелой брадикардии (см. раздел «Особые указания»).
Одновременное применение противопоказано
Одновременное применение с сильными ингибиторами изофермента CYP3A4, такими как противогрибковые средства группы азолов (кетоконазол, итраконазол), антибиотики из группы макролидов (кларитромицин, эритромицин для приема внутрь, джозамицин, телитромицин), ингибиторы ВИЧ-протеазы (нелфинавир, ритонавир) и нефазодон противопоказано (см. раздел «Противопоказания»). Сильные ингибиторы изофермента CYP3A4 — кетоконазол (200 мг один раз в сутки) или джозамицин (1 г два раза в сутки) повышают среднюю концентрацию ивабрадина в плазме крови в 7-8 раз.
Одновременное применение не рекомендуется
Умеренные ингибиторы изофермента CYP3A4
Одновременное применение ивабрадина и дилтиазема или верапамила (ЛС, урежающих сердечный ритм) у здоровых добровольцев и пациентов сопровождалось увеличением AUC в 2-3 раза и дополнительным урежением ЧСС на 5 уд/мин.
Одновременное применение, требующее осторожности
Умеренные ингибиторы изофермента CYP3A4
Одновременное применение ивабрадина с другими умеренными ингибиторами изофермента CYP3A4 (например, флуконазол) возможно, если ЧСС в покое составляет более 60 уд/мин. Рекомендуемая начальная доза ивабрадина 2,5 мг два раза в сутки.
Необходим контроль ЧСС.
Грейпфрутовый сок
При одновременном применении с грейпфрутовым соком отмечалось повышение концентрации ивабрадина в плазме крови в два раза. Во время применения ивабрадина употребление грейпфрутового сока не рекомендуется.
Индукторы изофермента CYP3A4
11 Индукторы изофермента CYP3A4 (например, рифампицин, барбитураты, фенитоин и ЛС, содержащие Зверобой продырявленный) могут снижать концентрацию в плазме крови и активность ивабрадина и потребовать подбора более высокой дозы ивабрадина. Одновременное применение ивабрадина в дозе 10 мг два раза в сутки и ЛС, содержащих Зверобой продырявленный, снижает AUC ивабрадина в 2 раза. Одновременное применение ЛС, содержащих Зверобой продырявленный, и ивабрадина не рекомендуется.
Одновременное применение с другими ЛС
Отсутствует клинически значимое влияние на фармакодинамику и фармакокинетику ивабрадина при одновременном применении с ингибиторами протонной помпы (омепразол, лансопразол), ингибиторами фосфодиэстеразы-5 (силденафил), ингибиторами ГМГ-КоА редуктазы (симвастатин), БМКК (амлодипин, лацидипин), дигоксином и варфарином.
Ивабрадин не оказывает клинически значимого влияния на фармакокинетику симвастатина, амлодипина, лацидипина, фармакокинетику и фармакодинамику дигоксина, варфарина и на фармакодинамику ацетилсалициловой кислоты.
Одновременное применение ивабрадина и ингибиторов ангиотензинпревращающего фермента, антагонистов рецепторов ангиотензина II, бета-адреноблокаторов, диуретиков, антагонистов альдостерона, нитратов короткого и пролонгированного действия, ингибиторов ГМГ-КоА редуктазы, фибратов, ингибиторов протонной помпы, гипогликемических средств для приема внутрь, ацетилсалициловой кислоты и других антиагрегантных средств не сопровождалось изменением профиля безопасности проводимой терапии.
Нарушения сердечного ритма
Препарат Бравадин® неэффективен при лечении или для профилактики аритмии, его эффективность снижается при возникновении тахиаритмии (например, желудочковой или наджелудочковой тахикардии). Применение препарата Бравадин не рекомендуется у пациентов с фибрилляцией предсердий (мерцательная аритмия) или другими видами аритмий, связанных с функцией синусового узла.
При применении препарата Бравадин® рекомендуется проводить клиническое наблюдение за пациентами на предмет выявления фибрилляции предсердий (пароксизмальная или постоянная форма), включающее исследование ЭКГ при наличии клинических показаний (например, ухудшение течения стенокардии, появление ощущения сердцебиения, нерегулярность сердечного ритма).
Риск развития фибрилляции предсердий может повышаться у пациентов с ХСН, принимающих препарат Бравадин . Фибрилляция предсердий чаще встречалась среди пациентов, одновременно принимающих ивабрадин с амиодароном или антиаритмическими препаратами I класса.
Пациенты с ХСН и нарушениями внутрижелудочковой проводимости (блокада левой или правой ножки пучка Гиса) и желудочковой диссинхронией должны находиться под тщательным наблюдением.
АV блокада II степени
Применение препарата Бравадин® не рекомендуется у пациентов с AV блокадой II степени.
Применение у пациентов с брадикардией
Применение препарата Бравадин противопоказано пациентам с ЧСС менее 60 уд/мин в состоянии покоя до начала терапии.
Если при применении препарата Бравадин® ЧСС в покое урежается менее 50 уд/мин или у пациента отмечаются симптомы, связанные с брадикардией (головокружение, повышенная утомляемость или выраженное снижение АД), дозу препарата необходимо уменьшить.
Если при снижении дозы препарата Бравадин® ЧСС остается менее 50 уд/мин или сохраняются симптомы, связанные с брадикардией, терапию препаратом Бравадин следует прекратить.
Комбинированное применение в составе антиангиналъной терапии
Одновременное применение препарата Бравадин® с БМКК, урежающими пульс (верапамил, дилтиазем) не рекомендуется. При одновременном применении с нитратами или БМКК, производными дигидропиридина (амлодипин), изменения профиля безопасности проводимой терапии не отмечалось. Не установлено, что одновременное применение с БМКК, производными дигидропиридина, повьппает эффективность ивабрадина.
Хроническая сердечная недостаточность
Возможность применения препарата Бравадин® рассматривается только у пациентов со стабильным течением ХСН. При применении препарата Бравадин» у пациентов с ХСН IV функционального класса по классификации NYHA следует соблюдать осторожность в связи с ограниченным количеством данных по применению у этой группы пациентов.
Инсульт
Не рекомендуется применение препарата Бравадин сразу после перенесенного инсульта в виду отсутствия данных по эффективности и безопасности в данный период. 13
Зрительные функции
Препарат Бравадин® влияет на функцию сетчатки глаза. В настоящее время не было выявлено токсического воздействия на сетчатку глаза, однако влияние препарата
Бравадин на сетчатку глаза при длительном применении (свыше 1 года) на данный момент неизвестно.
При возникновении каких-либо нарушений зрительного восприятия, не описанных в настоящей инструкции, применение препарата Бравадин® следует прекратить. При применении препарата Бравадин» у пациентов с пигментной дегенерацией сетчатки следует соблюдать осторожность.
Артериальная гипотензия
Препарат Бравадин следует применять с осторожностью у пациентов с артериальной гипотензией (недостаточное количество клинических данных).
Применение препарата Бравадин противопоказано у пациентов с тяжелой артериальной гипотензией (систолическое АД менее 90 мм рт.ст. и диастолическое АД менее 50 мм рт.ст.).
Фибрилляция предсердий (мерцательная аритмия) — нарушения сердечного ритма
Не доказано увеличение риска развития тяжелой брадикардии на фоне применения препарата Бравадин при восстановлении синусового ритма во время фармакологической кардиоверсии. Тем не менее, в связи с отсутствием достаточного количества данных, при возможности отсрочить плановую электрическую кардиоверсию, применение препарата Бравадин следует прекратить за 24 часа до ее проведения.
Применение у пациентов с врожденным синдромом удлинённого интервала QT или у пациентов, принимающих ЛС, удлиняющие интервал QT
Препарат Бравадин® не применяется у пациентов с врожденным синдромом удлинённого интервала QT, а также у пациентов, принимающих ЛС, удлиняющие интервал QT. При необходимости одновременного применения требуется строгий контроль ЭКГ.
Урежение ЧСС вследствие применения препарата Бравадин» может усугубить удлинение интервала QT и спровоцировать развитие тяжелой формы аритмии, в частности, полиморфной желудочковой тахикардии типа «пируэт».
Пациенты с артериальной гипертензией, которым требуется изменение гипотензивной терапии
В клиническом исследовании случаи повышения АД встречались чаще в группе пациентов, принимавших ивабрадин (7,1 %), в сравнении с группой плацебо (6,1 %).
Такие случаи встречались особенно часто непосредственно после изменения гипотензивной терапии, носили временный характер и не влияли на эффективность 14 терапии ивабрадином. При изменении гипотензивной терапии у пациентов с ХСН, принимающих препарат Бравадин®, следует контролировать АД через определенные интервалы времени.
Умеренная печеночная недостаточность
Следует соблюдать осторожность при применении препарат Бравадин® у пациентов с умеренной печеночной недостаточностью (менее 9 баллов по шкале Чайлд-Пью).
Тяжелая почечная недостаточность
Следует соблюдать осторожность при применении препарат Бравадин» у пациентов с тяжелой почечной недостаточностью (КК менее 15 мл/мин).
Специальная информация по вспомогательным веществам
Препарат Бравадин® содержит лактозу, поэтому препарат противопоказан пациентам с дефицитом лактазы, непереносимостью лактозы, синдромом глюкозо-галактозной мальабсорбции.
Влияние на способность управления автотранспортом и другими техническими устройствами
Было проведено исследование с целью оценить возможное влияние ивабрадина на способность управлять автомобилем с участием здоровых добровольцев, по результатам которого способность управлять автомобилем не изменялась. Однако в постмаркетинговом периоде сообщалось о случаях ухудшения способности управлять автотранспортом вследствие симптомов, связанных с нарушением зрения. Препарат Бравадин может вызывать временное изменение световосприятия (преимущественно в виде фотопсии), что должно приниматься во внимание при управлении автотранспортом или другими механизмами при резком изменении интенсивности света, особенно в ночное время.
Таблетки, покрытые пленочной оболочкой, 5 мг, 7,5 мг.
По 14 или 15 таблеток в контурную ячейковую упаковку из комбинированного материала ПВХ/ПЭ/ПВДХ и фольги алюминиевой.
1, 2, 4, 6, 7 контурных ячейковых упаковок по (14 таблеток) или 2, 4, 6 контурных ячейковых упаковок по (15 таблеток) вместе с инструкцией по применению помещают в пачку из картона.
При температуре не выше 25 °С, в оригинальной упаковке.
Хранить в недоступном для детей месте.
3 года
Не использовать препарат после истечения срока годности.
Отпускают по рецепту.
Производитель
ООО «КРКА-РУС», 143500, Россия, Московская обл., г. Истра, ул. Московская, д. 50
в сотрудничестве с АО «КРКА, д.д., Ново место», Шмарьешка цеста 6, 8501 Ново место, Словения
Представительство АО «КРКА, д.д., Ново место» в РФ / Организация, принимающая претензии потребителей
123022, Российская Федерация, г. Москва, ул.2-я Звенигородская, д. 13, стр. 41.
Форма выпуска, состав и упаковка
таб., покр. пленочной оболочкой, 5 мг: 28 или 56 шт.
Рег. №: 10445/15/20/21 от 09.12.2020 — Срок действия рег. уд. не ограничен
Таблетки, покрытые пленочной оболочкой светло-оранжевого цвета, овальные, двояковыпуклые, с насечкой на одной стороне; таблетка может быть поделена на две равные дозы.
| 1 таб. | |
| ивабрадин | 5 мг |
| в виде ивабрадина гидробромида | 5.864 мг |
Вспомогательные вещества: лактозы моногидрат — 61.403 мг лактозы в таблетке, целлюлоза микрокристаллическая, повидон, кроскармеллоза натрия, кремния диоксид коллоидный безводный, магния стеарат.
Опадрай оранжевый (Opadry Orange) 03H32599: готовая к применению смесь, состоящая из гипромеллозы, титана диоксида (E171), талька, пропиленгликоля, железа оксида желтого (E172), железа оксида красного (E172).
14 шт. — блистеры ПВХ/ПЭ/ПВДХ пленка и алюминиевая фольга (2) — короба картонные.
14 шт. — блистеры ПВХ/ПЭ/ПВДХ пленка и алюминиевая фольга (4) — коробки картонные.
таб., покр. пленочной оболочкой, 7.5 мг: 28 или 56 шт.
Рег. №: 10445/15/20/21 от 09.12.2020 — Срок действия рег. уд. не ограничен
Таблетки, покрытые пленочной оболочкой светло-оранжевого цвета, круглые, слегка двояковыпуклые, со скошенными краями.
| 1 таб. | |
| ивабрадин | 7.5 мг |
| в виде ивабрадина гидробромида | 8.796 мг |
Вспомогательные вещества: лактозы моногидрат — 92.105 мг лактозы в одной таблетке, целлюлоза микрокристаллическая, повидон, кроскармеллоза натрия, кремния диоксид коллоидный безводный, магния стеарат.
Опадрай оранжевый (Opadry Orange) 03H32599: готовая к применению смесь, состоящая из гипромеллозы, титана диоксида (E171), талька, пропиленгликоля, железа оксида желтого (E172), железа оксида красного (E172).
14 шт. — блистеры ПВХ/ПЭ/ПВДХ пленка и алюминиевая фольга (2) — коробки картонные.
14 шт. — блистеры ПВХ/ПЭ/ПВДХ пленка и алюминиевая фольга (4) — короба картонные.
Описание лекарственного препарата БРАВАДИН® основано на официально утвержденной инструкции по применению препарата и сделано в 2023 году. Дата обновления: 07.05.2023 г.
Фармакологическое действие
Ивабрадин — препарат, замедляющий ритм сердца, механизм действия которого заключается в селективном и специфическом ингибировании If-каналов синусового узла, контролирующего спонтанную диастолическую деполяризацию синусового узла и регулирующего ЧСС. Ивабрадин оказывает селективное воздействие на синусовый узел, не влияя на время проведения импульсов по внутрипредсердным, предсердно-желудочковым и внутрижелудочковым проводящим путям, а также на сократительную способность миокарда и реполяризацию желудочков. Ивабрадин также может взаимодействовать с Ih-каналами сетчатки глаза, сходными с If-каналами сердца, участвующими в возникновении временного изменения системы зрительного восприятия за счет изменения реакции сетчатки глаза на яркие световые стимулы. В провоцирующих условиях (резкое изменение яркости освещения) происходит частичное ингибирование ивабрадином Ih-каналов, которое вызывает преходящее изменение яркости в ограниченной области зрительного поля (фотопсия) (см. раздел «Побочное действие»).
Основным фармакодинамическим свойством ивабрадина является дозозависимое урежение ЧСС. Анализ зависимости величины снижения ЧСС от дозы ивабрадина проводился при постепенном увеличении дозы до 20 мг 2 раза/сут и выявил тенденцию к достижению эффекта «плато», когда не происходит нарастания терапевтического эффекта при дальнейшем увеличении дозы, что снижает риск развития тяжелой брадикардии (ЧСС менее 40 уд./мин) (см. раздел «Побочное действие»).
В рекомендуемых дозах снижение ЧСС составляет около 10 уд./мин в покое и при физической нагрузке. Это приводит к снижению нагрузки на миокард в связи с уменьшением потребности миокарда в кислороде. Ивабрадин не влияет на внутрисердечную проводимость, сократительную способность миокарда (отсутствие отрицательного инотропного действия) либо желудочковую реполяризацию:
— в электрофизиологических исследованиях ивабрадин не оказывал влияния на время проведения импульсов по предсердно-желудочковым или внутрижелудочковым путям, а также на скорректированный интервал QT;
— у пациентов с дисфункцией левого желудочка (фракция выброса левого желудочка (ФВЛЖ) от 30 до 45%)) ивабрадин не оказывал негативного влияния на ФВЛЖ.
Клиническая эффективность и безопасность
Противоангинальное и противоишемическое действие ивабрадина изучалось в ходе пяти двойных слепых рандомизированных испытаний (три в сравнении с плацебо и по одному в сравнении с атенололом и амлодипином). Всего в этих испытания принимали участие 4 111 пациентов, страдающих стабильной стенокардией, 2 617 из них получали ивабрадин.
Ивабрадин в дозе 5 мг дважды в день показал эффективность, судя по параметрам проведенных тестов с физической нагрузкой, которая проявляется в течение 3-4 недель после начала лечения. Также подтвердилась эффективность дозы 7.5 мг при приеме два раза в день. В частности, в сравнительном исследовании с использованием препарата сравнения атенолол было установлено дополнительное преимущество перед дозой 5 мг два раза в день: при самой низкой активности препарата общая продолжительность физической нагрузки увеличивалась приблизительно на минуту после одного месяца приема дозы 5 мг два раза в день, последующее увеличение продолжительности почти на 25 секунд происходило после дополнительного трехмесячного периода с форсированным титрованием до 7.5 мг два раза в день. В ходе этого исследования противоангинальные и противоишемические преимущества ивабрадина подтвердились на пациентах в возрасте 65 лет и старше. Эффективность доз 5 мг и 7.5 мг два раза в сутки наблюдалась во время всех исследований с тестированием с физической нагрузкой (общая продолжительность нагрузки, время до наступления ограниченной стенокардии, время до наступления стенокардии и время до появления депрессии сегмента ST на мм). Эта эффективность сопровождалась снижением частоты приступов стенокардии приблизительно на 70%. При приеме ивабрадина два раза в день обеспечивается равномерная эффективность действия в течение 24 часов.
В ходе рандомизированного плацебо-контролируемого исследования с участием 889 пациентов, при приеме ивабрадина в комбинации с атенололом 50 мг один раз в день, было продемонстрировано его дополнительное действие на параметры теста переносимости физической нагрузки при минимальной активности препарата (через 12 часов после приема внутрь).
В ходе рандомизированного плацебо-контролируемого исследования с участием 725 пациентов не было выявлено дополнительной эффективности ивабрадина по сравнению с амлодипином при самой низкой активности препарата (12 часов после перорального приема дозы), при этом дополнительная эффективность была показана при пиковой активности препарата (через 34 часа после перорального приема дозы).
В ходе рандомизированного плацебо-контролируемого исследования с участием 1277 пациентов ивабрадин демонстрировал статистически значимую дополнительную эффективность в ответе на лечение (определяемую как снижение, по крайней мере, 3-х приступов стенокардии в неделю и/или увеличение времени депрессии ST сегмента на 1 мм, по крайней мере, на 60 с в течение тредмил-теста) на фоне приема амлодипина 5 мг/сут или нифедипина GITS 30 мг/сут (через 12 часов приема ивабрадина внутрь) после 6 недельного периода лечения (ОR=l.3, 95% ДИ (1.0 – 1.7) p=0.012). Ивабрадин не показал дополнительной эффективности на вторичные конечные точки ЕЕТ параметров в течение всего периода действия препарата, в то время как на пике (3-4 часа после приема ивабрадина внутрь) была продемонстрирована дополнительная эффективность.
В ходе исследований эффективности ивабрадин полностью сохранял свою эффективность в течение 3-4 месячных курсов лечения. Признаков развития фармакологической неэффективности во время лечения или синдрома отмены при внезапном прекращении лечения не наблюдалось. Противоангинальное и противоишемическое действие ивабрадина было вызвано дозозависимым снижением ЧСС и значимым уменьшением двойного произведения (частота сердечных сокращений, умноженная на систолическое артериальное давление) в состоянии покоя и при физической нагрузке. Влияние препарата на артериальное давление и периферическое сопротивление сосудов было ничтожно малым и не являлось клинически значимым.
Продолжительное снижение частоты сердечных сокращений было показано у пациентов, которые получали ивабрадин в течение не менее года (п = 713). Влияния на метаболизм глюкозы или жиров не наблюдалось.
Противоангинальная и противоишемическая эффективность ивабрадина сохранялась у пациентов с диабетом (п = 457), профиль безопасности при этом был аналогичен профилю безопасности всей популяции.
Было проведено крупное исследование BEAUTIFUL с участием 10 917 пациентов с коронарной болезнью сердца и дисфункцией левого желудочка (ФВЛЖ <40%), получавших оптимальную исходную терапию, включавшую бета-блокаторы у 86.9% пациентов. Основным критерием эффективности было сочетание сердечно-сосудистой смертности, госпитализации по поводу острого инфаркта миокарда, госпитализации по поводу нового случая или усугубления сердечной недостаточности. Исследование не показало разницы в достижении первичного комбинированного критерия в группе ивабрадина и в группе плацебо (относительный риск ивабрадин/плацебо 1.00 при р=0.945).
При апостериорном анализе подгруппы пациентов с симптомами стенокардии при рандомизации (n=1507) не было получено сигналов по безопасности касательно сердечно-сосудистой смертности, госпитализации по поводу острого инфаркта миокарда или сердечной недостаточности (ивабрадин 12.0% по сравнению с плацебо 15.5%, р=0.05).
Крупное исследование SIGNIFY было проведено с участием 19102 пациентов с болезнью коронарных артерий и без клинических проявлений сердечной недостаточности (ФВЛЖ > 40%), получавших оптимальную базовую терапию. Терапевтическая схема с применением более чем утвержденного режима дозирования (начальная доза 7.5 мг дважды в день (5 мг дважды в день, если возраст >75 лет) и титрация до 10 мг дважды в день). Основным критерием эффективности была комбинация кардиоваскулярной смертности и нефатального инфаркта миокарда. Исследование не показало различий в первичной комбинированной конечной точке (РСЕ) в группе ивабрадина по сравнению с группой плацебо (относительный риск ивабрадин/плацебо 1.08, р=0.197). О брадикардии сообщалось у 17.994 пациентов в группе ивабрадина (у 2.1% — в группе плацебо). 7.1% пациентов в исследовании получали верапамил, дилтиазем или сильные ингибиторы СУР ЗА4.
Небольшое статистически значимое увеличение РСЕ было обнаружено в заранее определенной подгруппе пациентов со стенокардией класса II или выше по CCS исходно (n=12049) (ежегодная частота 3.4% против 2.9%, относительный риск ивабрадин/плацебо 1.18, р=0.018), но не в подгруппе общей стенокардии с классом > I (n=14286) (относительный риск ивабрадин/плацебо 1.11, р=0.110).
Использование в исследовании дозы выше одобренной не полностью объясняет эти результаты.
Исследование SHIFT было большим мультицентровым, международным, рандомизированным двойным слепым плацебо контролируемым исследованием с участием 6505 взрослых пациентов со стабильной ХСН (в течение > 4 недель), с сердечной недостаточностью класса II-IV по классификации NYHA, со сниженной фракцией выброса левого желудочка (ФВЛЖ <З5%) и с частотой сердечных сокращений ≥ 70 ударов/мин.
Пациенты получали стандартное лечение, включая бета-блокаторы (89%), ингибиторы АПФ и/или ангиотензин II антагонисты (91%), диуретики (83%) и антиальдостероновые агенты (60%). В группе ивабрадина 67% пациентов получали лечение 7.5 мг дважды в день. Средняя последующая продолжительность лечения составляла 22.9 месяцев. Лечение ивабрадином ассоциировалось со снижением количества сердечных сокращений в среднем на 15 ударов/мин от базового значения 80 ударов/мин. Разница в сердечных сокращениях между ивабрадином и плацебо составила 10.8 уд/мин на 28 день, 9.8 уд/мин на 12 месяц и 8.3 уд/мин на 24 месяц.
Исследование продемонстрировало клинически и статистически значимое снижение риска на 18% по отношению к первичной комбинированной точке сердечно-сосудистой смертности и госпитализации по поводу ухудшения сердечной недостаточности (относительный риск: 0.82, 95% ДИ (0.75;0.90) — р < 0.0001), что было очевидно после 3-х месяцев лечения от начала терапии. Снижение абсолютного риска составило 4.2%. Результат первичной конечной точки в основном был зависим от конечной точки сердечной недостаточности, госпитализации по поводу ухудшения сердечной недостаточности (абсолютный риск снизился на 4.7%) и смертности от сердечной недостаточности (абсолютный риск снизился на 1.1%).
Влияние лечения на первичную комбинированную конечную точку, её составляющие и вторичные конечные точки
| Ивабрадин (N=3241) n (%) |
Плацебо (N=3264) n (%) |
Относительный риск (95% ДИ) |
Значение р | |
| Первичная комбинированная конечная точка | 793 (24.47) | 937 (28.71) | 0.82 [0.75; 0.90] | < 0.0001 |
| Составляющие комбинации: — СС смертность — Госпитализация из-за ухудшения СН |
449 (13.85) | 491 (15.04) | 0.91 [0.80; 1.03] | 0.128 |
| 514 (15.86) | 672 (20.59) | 0.74 [0.66; 0.83] | < 0.0001 | |
| Другие вторичные конечные точки | ||||
| — Все причины смерти | 503 (15.52) | 552 (16.91) | 0.90 [0.80; 1.02] | 0.092 |
| — Смерть от СН | 113 (3.49) | 151 (4.63) | 0.74 [0.58; 0.94] | 0.014 |
| — Госпитализация по любой причине — Госпитализация по СС причине |
1231 (37.98) | 1356 (41.54) | 0.89 [0.82; 0.96] | 0.003 |
| 977 (30.15) | 1122 (34.38) | 0.85 [0.78; 0.92] | 0.0002 |
Снижение в первичной точке наблюдалось одинаково, независимо от пола, NYHA класса, ишемической или неишемической этиологии сердечной недостаточности, наличия диабета или гипертензии в анамнезе.
В подгруппе пациентов с ЧСС >75 уд/мин (n=4150) наблюдалось большее снижение в первичной комбинированной точке на 24% (относительный риск: 0.76, 95% ДИ [0.68; 0.85] – р <0.0001), и в других вторичных точках, включая смертность по всем причинам (относительный риск: 0.83, 95% ДИ [0.72; 0.96] – р = 0.0109) и СС смерть (относительный риск: 0.83, 95% ДИ [0.71; 0.97] – р = 0.0166). В этой подгруппе пациентов профиль безопасности ивабрадина был в соответствии с данным профилем в других популяциях.
Наблюдалось значительное улучшение по первичной комбинированной конечной точке во всех группах пациентов, получающих бета-блокаторы (относительный риск: 0.85, 95% ДИ [0.76; 0.94]), В подгруппе пациентов с ЧСС>75 уд/мин и на рекомендуемых целевых дозах бетаблокаторов не наблюдалось статистически значимой пользы на первичную конечную точку (относительный риск: 0.97, 95% ДИ [0.74; 1.28]) и на другие вторичные конечные точки, включая госпитализацию из-за ухудшения сердечной недостаточности (относительный риск: 0.79, 95% ДИ [0.56; 1.10]) или смерть от сердечной недостаточности (относительный риск: 0.69, 95% ДИ [0.31; 1.53]).
Наблюдалось значительное улучшение класса NYHA в последнем значении, у 887 (28%) пациентов на ивабрадине было улучшение по сравнению с 776 (24%) пациентами, принимавших плацебо (р=0.001).
В ходе рандомизированного плацебо-контролируемого исследования с участием 97 пациентов были проведены специфические офтальмологические исследования, с целью задокументировать функцию систем колбочек и палочек, а также афферентных зрительных путей (т.е. электроретинограмма, статическое и кинетическое зрительные поля, цветовосприятие, острота зрения). У пациентов, принимающих ивабрадин для лечения хронической стабильной стенокардии более 3 лет, ивабрадин не показал ретинальной токсичности.
Педиатрическая популяция
Рандомизированное, двойное слепое, плацебо-контролируемое исследование было проведено на 116 пациентах педиатрической популяции с хронической сердечной недостаточностью и дилатационной кардиомиопатией (ДКМП) (из них 17 в возрасте 6-12 месяцев, 36 — 1-3 года и 63 — 3-18 лет) при оптимальном предварительном лечении. 74 пациента получали ивабрадин (соотношение 2:1). Начальная доза составляла 0.02 мг/кг два раза в день в возрастной подгруппе 6-12 месяцев, 0.05 мг/кг два раза в день в возрастной подгруппе 1-3 года и 3-18 лет менее 40 кг, а также 2,5 мг два раза в день в возрастной подгруппе 3-18 лет и > 40 кг. Доза была адаптирована в зависимости от терапевтического ответа с максимальными дозами 0.2 мг/кг два раза в день, 0.3 мг/кг два раза в день и 15 мг два раза в день, соответственно. В этом исследовании ивабрадин применяли перорально в жидкой лекарственной форме или таблетках два раза в день.
Отсутствие фармакокинетической разницы между двумя формами было показано в открытом рандомизированном исследовании с перекрестным дизайном с оценкой двух периодов у 24 взрослых здоровых добровольцев.
В течение периода титрования в срок от 2 до 8 недели достигнуто снижение частоты сердечных сокращений на 20% без брадикардии у 69.9% пациентов в группе ивабрадина, по сравнению с 12.2% в группе плацебо (Отношение рисков: Е = 17.24; ДИ 95% ДИ [5.91; 50.30]).
Средние дозы ивабрадина, позволяющие достичь урежения сердечного ритма на 20%, составили 0.13 ± 0.04 мг/кг два раза в день, 0.10 ± 0.04 мг/кг два раза в день и 4.1 ± 2.2 мг два раза в день для возрастных субпопуляций 1-3 года, 3-18 лет с массой тела менее 40 кг, 3-18 лет и с массой тела > 40 кг, соответственно.
Через 12 месяцев наблюдения средняя фракция выброса левого желудочка возросла с 31.8% до 45.3=% в группе ивабрадина по сравнению с динамикой с 35.4% до 42.3% в группе плацебо. Наблюдалось улучшение класса NYHA у 37.7% пациентов в группе ивабрадина по сравнению с 25.094 пациентов в группе плацебо. Различия не были статистически значимыми.
Профиль безопасности в течение одного года наблюдения был аналогичен описанному у взрослых пациентов с застойной сердечной недостаточностью.
Долгосрочные эффекты ивабрадина на рост, половое созревание и общее развитие, а также долгосрочная эффективность терапии ивабрадином в детском возрасте для уменьшения сердечно-сосудистой заболеваемости и смертности не были изучены.
Европейское Медицинское Агентство отклонило обязательную подачу результатов исследований эталонного препарата, содержащего ивабрадин, при лечении стенокардии во всех субпопуляциях педиатрических популяций.
Европейское Медицинское Агентство отклонило обязательную подачу результатов исследований эталонного препарата, содержащего ивабрадин, при лечении хронической сердечной недостаточности у детей в возрасте от 0 до 6 месяцев.
Фармакокинетика
При попадании в организм ивабрадин быстро высвобождается из таблетки и хорошо растворяется в воде (>l0 мг/мл). Ивабрадин является S-энантиомером, не демонстрирующим биологического преобразования в исследованиях in vivo. N-десметилированное производное ивабрадина является основным активным метаболитом.
Всасывание и биодоступность
Ивабрадин быстро и почти полностью всасывается в желудочно-кишечном тракте после приема внутрь натощак с достижением Cmax в плазме крови приблизительно через 1 час. Абсолютная биодоступность составляет около 40% и обусловлена эффектом «первичного прохождения» через печень.
Прием пищи увеличивает время абсорбции ивабрадина приблизительно на 1 час и повышает концентрацию в плазме крови с 20 до 30 %. Рекомендуется принимать таблетки во время приема пищи с целью понижения вариабельности концентрации (см. раздел «Режим дозирования»).
Распределение
Ивабрадин связывается с белками плазмы крови приблизительно на 70%, объем распределения у пациентов в равновесном состоянии составляет около 100 л. Cmax ивабрадина в плазме крови после длительного применения внутрь дозы 5 мг два раза в сутки составляет 22 нг/мл (коэффициент вариации (КВ)=29 %). Средняя равновесная концентрация в плазме крови составляет 10 нг/мл (КВ=38 %).
Метаболизм
Ивабрадин в значительной степени подвергается метаболизму в печени и кишечнике путем окисления с помощью цитохрома Р450 ЗА4 (изофермента CYP3A4). Основным активным метаболитом является N-десметилированное производное (S 18982) с концентрацией около 40 % по отношению к концентрации исходного вещества. Метаболизм данного активного метаболита также происходит при участии изофермента CYP3A4. Ивабрадин имеет низкую степень сродства к изоферменту CYP3A4, не демонстрирует клинически значимой индукции или ингибирования изофермента CYP3A4, поэтому изменение метаболизма или концентрации субстратов изофермента CYP3A4 в плазме крови под действием ивабрадина является маловероятным. Наоборот, сильные ингибиторы и индукторы цитохрома Р450 могут значительно влиять на концентрацию ивабрадина в плазме крови (см. раздел «Лекарственное взаимодействие»).
Выведение
Период полувыведения (T1/2) ивабрадина составляет, в среднем, 2 часа (70-75% по отношению к площади под кривой «концентрация/время» (AUC) в плазме крови), эффективный T1/2 — 11 часов. Общий клиренс составляет около 400 мл/мин, почечный клиренс — около 70 мл/мин. Выведение метаболитов происходит в одинаковой степени через кишечник и почками. Около 4% принятой внутрь дозы выводится в неизмененном виде почками.
Линейность/нелинейность
Фармакокинетика ивабрадина является линейной в диапазоне доз 0.5-24 мг.
Особые группы пациентов
Пациенты пожилого возраста
Фармакокинетические показатели (AUC и Cmax) существенно не отличаются у пациентов 65 лет и старше, 75 лет и старше и общей популяции пациентов (см. раздел «Режим дозирования»).
Нарушение функции почек
Изменение кинетики ивабрадина у пациентов с почечной недостаточностью (клиренс креатинина (КК) 15-60 мл/мин) минимально, так как лишь около 20 % ивабрадина и его активного метаболита S 18982 выводится почками (см. раздел «Режим дозирования»).
Нарушение функции печени
У пациентов с легкой степенью печеночной недостаточности (до 7 баллов по шкале Чайлд-Пью) AUC ивабрадина и его метаболита на 20 % больше, чем у пациентов с нормальной функцией печени. Данные о применении ивабрадина у пациентов с умеренной печеночной недостаточностью (7-9 баллов по шкале Чайлд-Пью) ограничены и не позволяют сделать вывод об особенностях фармакокинетики ивабрадина у данной группы пациентов, а у пациентов с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пью) отсутствуют (см. разделы «Режим дозирования» и «Противопоказания»).
Дети
Фармакокинетический профиль ивабрадина у детей с хронической сердечной недостаточностью в возрасте 6 мес – 18 лет такой же, как у взрослых, когда схема титрования основывается на возрасте и весе.
Взаимосвязь между фармакокинетическими и фармакодинамическими свойствами
Анализ взаимосвязи фармакодинамических и фармакокинетических параметров (ФД/ФК) показал уменьшение ЧСС имеет прямую пропорциональную зависимость от увеличения в плазме крови концентраций ивабрадина и активного метаболита S 18982 при приеме в дозах 15 — 20 мг два раза в сутки. При более высоких дозах препарата урежение сердечного ритма не имеет пропорциональной зависимости от концентрации ивабрадина в плазме крови и характеризуется тенденцией к достижению эффекта «плато». Высокие концентрации ивабрадина в плазме крови, которые можно достичь при одновременном применении ивабрадина с сильными ингибиторами изофермента CYP3A4, могут приводить к выраженному урежению ЧСС, однако этот риск снижается при одновременном применении с умеренными ингибиторами изофермента CYP3A4 (см. разделы «Противопоказания», «Особые указания» и «Лекарственное взаимодействие»). Взаимосвязь параметров ФД/ФК ивабрадина у педиатрических пациентов в возрасте от 6 месяцев до 18 лет с хронической сердечной недостаточностью похожа на взаимосвязь параметров ФД/ФК, описанных у взрослых.
Данные доклинической безопасности
Согласно доклиническим данным, основанным на традиционных исследованиях фармакологической безопасности, токсичности повторных доз, потенциала генотоксичности и канцерогенности, специфический риск для человека отсутствует. Исследования токсичности в отношении репродуктивной системы не выявили влияния ивабрадина на фертильность самцов и самок крыс. Когда во время вынашивания в период органогенеза животные получали препарат в дозах, близких к терапевтическим, это приводило к более частому развитию дефектов сердца у плода крыс и небольшому количеству случаев развития плодов с эктродактилией у кроликов.
Когда собаки получали ивабрадин (в дозах 2.7 или 24 мг/кг/день) в течение одного года, у них наблюдались обратимые изменения функции сетчатки, которые, однако, не сопровождались нарушениями зрительных структур. Эти данные совпадают с фармакологическим эффектом ивабрадина, что связано с его взаимодействием с гиперполяризированными токами Ih в сетчатке, которые по своим характеристикам во многом сходны с током водителя сердечного ритма If.
Другие долгосрочные исследования повторного применения и исследования канцерогенности не выявили никаких клинически релевантных изменений.
Оценка риска для окружающей среды
Оценка риска ивабрадина для окружающей среды проводилась в соответствии с Европейскими руководящими указаниями.
Результаты этих оценок говорят об отсутствии риска ивабрадина для окружающей среды и о том, что ивабрадин не представляет собой угрозы для окружающей среды.
Показания к применению
Стабильная стенокардия
Симптоматическое лечение хронической стабильной стенокардии у взрослых пациентов, страдающих коронарной болезнью сердца, с нормальным синусовым ритмом и частотой сердечных сокращений ≥ 70 уд/мин:
- взрослым пациентам при непереносимости или наличии противопоказаний к применению бета-блокаторов;
- в комбинации с бета-адреноблокаторами у пациентов при неадекватном контроле стабильной стенокардии на фоне оптимальной дозы бета-адреноблокатора.
- лечение хронической сердечной недостаточности (ХСН) NYHA II-IV класса с систолической дисфункцией у пациентов с синусовым ритмом и частотой сердечных сокращений ≥ 75 уд/мин, в комбинации со стандартной терапией, включая терапию бета-блокаторами, или при противопоказаниях или непереносимости бета-блокаторов.
Хроническая сердечная недостаточность
Реклама
Режим дозирования
Принимают внутрь, 2 раза/сут (утром и вечером) во время приема пищи (см. раздел «Фармакокинетика»).
Стабильная стенокардия
Решение о начале лечения или изменении дозы рекомендовано принимать при наличии возможности мониторирования ЧСС, ЭКГ или в условиях 24-часового амбулаторного наблюдения.
У пациентов в возрасте младше 75 лет рекомендуемая начальная доза ивабрадина составляет 5 мг 2 раза/сут. Если после 3-4 недель лечения сохраняются симптомы заболевания, начальные дозы 2.5 мг или 5 мг 2 раза/сут хорошо переносятся, а ЧСС в покое составляет более 60 уд./мин, то доза может быть увеличена. Поддерживающая доза не должна превышать 7.5 мг 2 раза/сут.
Если после 3 месяцев лечения у пациента сохраняются симптомы, связанные со стенокардией, то прием препарата рекомендуется прекратить. Также необходимо рассмотреть вопрос о прекращении лечения в случае незначительного уменьшения симптомов и отсутствия клинически значимого снижения ЧСС в течение 3 месяцев лечения.
Если во время применения препарата Бравадин® ЧСС в покое уменьшается до менее 50 уд./мин, или у пациента возникают симптомы, связанные с брадикардией (головокружение, повышенная утомляемость или выраженное снижение АД), то дозу препарата необходимо уменьшить до 2.5 мг (по 1/2 таб. 5 мг) 2 раза/сут.
После снижения дозы необходимо контролировать частоту сердечных сокращений (см. раздел «Особые указания»).
Если при снижении дозы препарата Бравадин® ЧСС остается менее 50 уд./мин или сохраняются симптомы выраженной брадикардии, то лечение следует прекратить.
Хроническая сердечная недостаточность
Лечение может быть начато только у пациентов со стабильной сердечной недостаточностью. Рекомендуется, чтобы лечащий врач имел опыт ведения таких пациентов.
Рекомендуемая начальная доза ивабрадина составляет 5 мг 2 раза/сут.
Через 2 недели терапии доза может быть увеличена до 7.5 мг 2 раза/сут, если ЧСС стабильно выше 60 уд./мин, или уменьшена до 2.5 мг (по 1/2 таб. 5 мг) 2 раза/сут, если ЧСС стабильно менее 50 уд./мин или у пациента возникают симптомы, связанные с брадикардией (головокружение, повышенная утомляемость или выраженное снижение АД).
Если значение ЧСС находится в диапазоне 50-60 уд./мин, рекомендуется применять препарат Бравадин® в дозе 5 мг 2 раза/сут.
Если во время применения препарата Бравадин® ЧСС в покое урежается менее 50 уд./мин или у пациента возникают симптомы, связанные с брадикардией, для пациентов, получающих Бравадин® в дозе 5 мг 2 раза/сут или 7.5 мг 2 раза/сут, дозу препарата следует уменьшить.
Если у пациентов, получающих Бравадин® в дозе 2.5 мг (по 1/2 таб. 5 мг) 2 раза/сут или 5 мг 2 раза/сут, ЧСС стабильно более 60 уд./мин, доза препарата Бравадин® может быть увеличена.
Если ЧСС в покое не превышает 50 уд./мин или у пациента сохраняются симптомы, связанные с брадикардией, терапию препаратом Бравадин® следует прекратить (см. раздел «Особые указания»).
Особые категории пациентов
Пациенты пожилого возраста
У пациентов в возрасте 75 лет и старше лечение следует начинать с более низкой дозы. Рекомендуемая начальная доза составляет 2.5 мг (по 1/2 таб. 5 мг) 2 раза/сут. В дальнейшем доза может быть увеличена.
Нарушение функции почек
Пациентам с нарушением функции почек (КК более 15 мл/мин) коррекции дозы не требуется (см. раздел «Фармакокинетика»).
В связи с недостаточностью клинических данных Бравадин® следует применять с осторожностью у пациентов с КК менее 15 мл/мин.
Нарушение функции печени
У пациентов с легкой степенью печеночной недостаточности коррекция дозы не требуется. Следует соблюдать осторожность при применении ивабрадина у пациентов с умеренной печеночной недостаточностью. При тяжелой печеночной недостаточности применение ивабрадина противопоказано, т.к. исследований с участием этой популяции не проводилось, но не исключено увеличение системного воздействия (см. разделы «Противопоказания» и «Фармакокинетика»).
Дети и подростки
Безопасность и эффективность ивабрадина при лечении хронической сердечной недостаточности у детей и подростков в возрасте до 18 лет не установлены.
Доступные данные представлены в разделах «Фармакологическое действие» и «Фармакокинетика», но рекомендации по режиму дозирования не могут сделаны.
Побочные действия
Были проведены клинические исследования ивабрадина с участием около 45 000 человек. Наиболее частые побочные эффекты препарата, изменение световосприятия (фотопсия) и брадикардия, носили дозозависимый характер и были связаны с его механизмом действия.
Следующие нежелательные эффекты наблюдались во время проведения клинических испытаний, были классифицированы по следующей частоте: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10 000 до <1/1000), очень редко (от <1/10 000), частота неизвестна (не может быть оценена на основе имеющихся данных).
| Частота | Побочный эффект |
| Со стороны системы кроветворения и лимфатической системы | |
| Нечасто | Эозинофилия |
| Со стороны обмена веществ | |
| Нечасто | Гиперурикемия |
| Со стороны нервной системы | |
| Часто | Головная боль, как правило, в течение первого месяца лечения |
| Головокружение, возможно связанное с брадикардией | |
| Нечасто* | Обморок, возможно связанный с брадикардией |
| Со стороны органа зрения | |
| Очень часто | Изменение световосприятия (фотопсия) |
| Часто | Нечеткость зрения |
| Нечасто* | Диплопия |
| Ухудшение зрения | |
| Со стороны органа слуха и лабиринтные нарушения | |
| Нечасто | Вертиго |
| Со стороны сердечно-сосудистой системы | |
| Часто | Брадикардия |
| AV-блокада I степени (удлиненный интервал PQ на ЭКГ) | |
| Желудочковая экстрасистолия | |
| Фибрилляция предсердий | |
| Неконтролируемое АД | |
| Нечасто | Ощущение сердцебиения, наджелудочковая экстрасистолия; артериальная гипотензия*, возможно, связанная с брадикардией |
| Очень редко | AV-блокада II и III степени |
| СССУ | |
| Со стороны дыхательной системы | |
| Нечасто | Одышка |
| Со стороны пищеварительной системы | |
| Нечасто | Тошнота |
| Запор | |
| Диарея | |
| Боль в животе * | |
| Со стороны кожи и подкожных тканей | |
| Нечасто * | Ангионевротический отек, кожная сыпь |
| Редко * | Эритема |
| Кожный зуд, крапивница | |
| Со стороны костно-мышечной системы | |
| Нечасто | Мышечные спазмы |
| Общие реакции | |
| Нечасто * | Астения, возможно связанная с брадикардией |
| Повышенная утомляемость, возможно связанная с брадикардией | |
| Редко * | Недомогание, возможно связанное с брадикардией |
| Лабораторные показатели | |
| Нечасто | Повышение концентрации креатинина в плазме крови |
| Удлинение интервала QT на ЭКГ |
*Частота рассчитана на основе спонтанных сообщений для побочных реакций, полученных в ходе клинических исследований.
Описание отдельных побочных реакций
Изменение световосприятия (фотопсия) отмечалось у 14.5% пациентов и описывалось как преходящее изменение яркости в ограниченной зоне зрительного поля. Фотопсию можно описать как ореол, разложение изображения (стробоскопические или калейдоскопические эффекты), цветные яркие огни или множественность изображения. Как правило, подобные явления провоцировались резким изменением интенсивности освещения. В основном, фотопсия появлялась в первые 2 месяца терапии с последующим повторением. Выраженность фотопсии, как правило, была слабой или умеренной. Фотопсия прекращалась на фоне продолжения терапии (77.5% случаев) или после ее завершения. Менее чем у 1% пациентов появление фотопсии явилось причиной отказа от терапии.
Брадикардия отмечалась у 3.3% пациентов, особенно в первые 2-3 месяца терапии, у 0.5% пациентов развивалась тяжелая брадикардия с ЧСС менее или равной 40 уд./мин.
В исследовании SIGNIFY фибрилляция предсердий наблюдалась у 5.3% пациентов, принимавших ивабрадин, и у 3.8% — принимавших плацебо. В совокупном анализе группы двойных слепых контролируемых исследований фаз II / III продолжительностью не менее 3 месяцев, включавших более 40 000 пациентов, фибрилляция предсердий наблюдалась у 4.86% пациентов, принимавших ивабрадин, и у 4.08% — в контрольной группе, что соответствует степени риска 1.26, 95% ДИ [1.15-1.39].
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного препарата. Просим медицинских работников сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях.
Противопоказания к применению
- повышенная чувствительность к ивабрадину или любому из вспомогательных компонентов препарата;
- ЧСС в покое менее 70 уд./мин до начала лечения;
- кардиогенный шок;
- острый инфаркт миокарда;
- тяжелая артериальная гипотензия (90/50 мм рт.ст.);
- тяжелая печеночная недостаточность;
- синдром слабости синусового узла (СССУ);
- синоатриальная блокада;
- AV-блокада III степени;
- нестабильная или острая сердечная недостаточность;
- наличие искусственного водителя ритма, работающего в режиме постоянной стимуляции;
- нестабильная стенокардия;
- одновременное применение с сильными ингибиторами изоферментов системы CYP3А4, такими как противогрибковые средства группы азолов (кетоконазол, итраконазол), антибиотики из группы макролидов (кларитромицин, эритромицин для приема внутрь, джозамицин, телитромицин), ингибиторы ВИЧ-протеазы (нелфинавир, ритонавир) и нефазодон (см. разделы «Лекарственное взаимодействие» и «Фармакокинетика»);
- одновременное применение с верапамилом или дилтиаземом, которые являются умеренными ингибиторами CYP3A4 и обладают свойствами снижения ЧСС (см. раздел «Лекарственное взаимодействие»);
- беременность;
- период лактации (грудного вскармливания);
- женщины репродуктивного возраста, не использующие надежные методы контрацепции (см. раздел «Беременность и лактация»).
Применение при беременности и кормлении грудью
Беременность
Данные о применении препарата беременными женщинами ограничены или отсутствуют.
Исследования на животных продемонстрировали наличие репродуктивной токсичности, эмбриотоксичности и тератогенного действия (см. раздел «Данные доклинической безопасности»). Потенциальный риск при применении человеком не известен, поэтому прием ивабрадина во время беременности противопоказан (см. раздел «Противопоказания»).
Период лактации
Исследования на животных показывают, что ивабрадин выделяется в молоко, поэтому применение препарата в период грудного вскармливания противопоказано (см. раздел «Противопоказания»).
При необходимости применения препарата в период лактации грудное вскармливание следует прекратить.
Женщины репродуктивного возраста
Женщины репродуктивного возраста должны принимать надежные контрацептивные меры во время приема препарата (см. раздел «Противопоказания»).
Репродуктивная функция
В исследованиях у крыс обоего пола влияния на репродуктивную функцию выявлено не было (см. раздел «Данные доклинической безопасности»).
Применение при нарушениях функции печени
Коррекции дозы не требуется у пациентов с легкой степенью печеночной недостаточности. Следует соблюдать осторожность при применении препарата Бравадин® у пациентов с умеренной печеночной недостаточностью.
Пациентам с тяжелой печеночной недостаточностьюприменение препарата Бравадин® противопоказано.
Применение при нарушениях функции почек
Пациентам с нарушением функции почек (КК более 15 мл/мин) коррекция дозы не требуется.
В связи с недостаточностью клинических данных Бравадин® следует применять с осторожностью у пациентов с КК менее 15 мл/мин.
Применение у пожилых пациентов
Пациентам в возрасте 75 лет и старше лечение следует начинать с более низкой дозы. Рекомендуемая начальная доза составляет 2.5 мг (по 1/2 таблетки 5 мг) 2 раза/сут. В дальнейшем доза может быть увеличена.
Применение у детей
Безопасность и эффективность ивабрадина у детей и подростков в возрасте до 18 лет не установлены.
Особые указания
Недостаточная эффективность с точки зрения клинического результата у пациентов с симптоматической хронической стабильной стенокардией
Ивабрадин показан только для симптоматического лечения хронической стабильной стенокардии, поскольку не оказывает положительного эффекта на сердечно-сосудистые исходы (например, инфаркт миокарда или смертность от сердечно-сосудистых заболеваний) (см. раздел «Фармакологическое действие»).
Контроль ЧСС
Принимая во внимание значительные колебания ЧСС во времени, перед началом лечения или титрованием дозы рекомендуется контролировать ЧСС, ЭКГ или установить 24-часовое амбулаторное наблюдение. Данные меры предосторожности относятся также к пациентам с низкой ЧСС, особенно, ниже 50 уд./мин, или после снижения дозы препарата (см. раздел «Режим дозирования»).
Нарушения сердечного ритма
Ивабрадин неэффективен при лечении или для профилактики аритмии, его эффективность снижается при возникновении тахиаритмии (например, желудочковой или наджелудочковой тахикардии). Применение препарата не рекомендуется у пациентов с фибрилляцией предсердий (мерцательная аритмия) или другими видами аритмий, связанных с функцией синусового узла.
При применении ивабрадина риск развития фибрилляции предсердия повышен (см. раздел «Побочное действие»). Фибрилляция предсердий была более частой у пациентов, совместно принимающих амиодарон и сильные антиаритмические препараты I класса. Рекомендуется проводить регулярное клиническое наблюдение за пациентами на предмет выявления фибрилляции предсердий (пароксизмальная или постоянная форма), включающее исследование ЭКГ при наличии клинических показаний (например, ухудшение течения стенокардии, ощущение сердцебиения, нерегулярность сердечного ритма).
Пациентов следует проинформировать о признаках и симптомах фибрилляции предсердий, а также предупредить о необходимости обратиться к врачу в случае их появления.
При выявлении фибрилляции предсердий на фоне лечения следует оценить соотношение польза/риск для его продолжения.
Пациенты с ХСН и нарушениями внутрижелудочковой проводимости (блокада левой или правой ножки пучка Гиса) и желудочковой диссинхронией должны находиться под тщательным медицинским наблюдением.
АV-блокада II степени
Применение ивабрадина не рекомендуется у пациентов с AV-блокадой II степени.
Применение у пациентов с брадикардией
Применение ивабрадина противопоказано пациентам с ЧСС менее 70 уд./мин в состоянии покоя до начала терапии (см. раздел «Противопоказания»).
Если при применении препарата Бравадин® ЧСС в покое урежается менее 50 уд./мин и сохраняется на этом уровне, или у пациента отмечаются симптомы, связанные с брадикардией (головокружение, повышенная утомляемость или выраженное снижение АД), дозу препарата необходимо уменьшить. Если при снижении дозы препарата ЧСС остается менее 50 уд./мин или сохраняются симптомы, связанные с брадикардией, терапию препаратом Бравадин® следует прекратить (см. раздел «Режим дозирования»).
Комбинированная терапия с блокаторами кальциевых каналов
Одновременное применение ивабрадина и блокаторов кальциевых каналов, снижающих ЧСС (верапамил, дилтиазем), не рекомендуется (см. разделы «Противопоказания» и «Лекарственное взаимодействие»). При одновременном применении ивабрадина с нитратами или блокаторами кальциевых каналов, производными дигидропиридина (амлодипин), изменения профиля безопасности проводимой терапии не отмечалось. Не установлено, что одновременное применение с блокаторами кальциевых каналов, производными дигидропиридина, повышает эффективность ивабрадина (см. раздел «Фармакологическое действие»).
Хроническая сердечная недостаточность
Возможность применения ивабрадина рассматривается только у пациентов со стабильным течением ХСН. При применении ивабрадина у пациентов с ХСН IV функционального класса по классификации NYHA следует соблюдать осторожность в связи с ограниченным количеством данных по применению у этой группы пациентов.
Инсульт
Не рекомендуется применение ивабрадина сразу после перенесенного инсульта ввиду отсутствия данных по эффективности и безопасности в данный период.
Зрительная функция
Ивабрадин влияет на функцию сетчатки глаза. В настоящее время не было выявлено токсического воздействия на сетчатку, однако влияние ивабрадина на сетчатку глаза при длительном применении (свыше 1 года) на данный момент неизвестно. При возникновении каких-либо нарушений зрительного восприятия, не описанных выше, применение ивабрадина следует прекратить. При применении ивабрадина у пациентов с пигментной дегенерацией сетчатки следует соблюдать осторожность.
Меры предосторожности при приеме
Артериальная гипотензия
Ивабрадин следует применять с осторожностью у пациентов с артериальной гипотензией (недостаточное количество клинических данных).
Ивабрадин противопоказан у пациентов с тяжелой артериальной гипотензией (АД <90/50 мм рт.ст.) (см. раздел «Противопоказания»).
Фибрилляция предсердий (мерцательная аритмия) — нарушения сердечного ритма
Не доказано увеличение риска развития тяжелой брадикардии на фоне применения препарата Бравадин® при восстановлении синусового ритма во время фармакологической кардиоверсии. Тем не менее, в связи с отсутствием достаточного количества данных, при возможности отсрочить плановую электрическую кардиоверсию, применение препарата следует прекратить за 24 ч до ее проведения.
Применение у пациентов с врожденным синдромом удлиненного интервала QT или у пациентов, принимающих лекарственные средства, удлиняющие интервал QT
Следует избегать назначения ивабрадина пациентам с врожденным синдромом удлинённого интервала QT или принимающим лекарственные средства, удлиняющие интервал QT (см. раздел «Лекарственное взаимодействие»). При необходимости одновременного применения требуется строгий контроль работы сердца.
Снижение ЧСС вследствие применения ивабрадина может усугубить удлинение интервала QT и спровоцировать развитие тяжелой формы аритмии, в частности, желудочковой тахикардии типа «пируэт».
Пациенты с артериальной гипертензией, которым требуется изменение гипотензивной терапии
В клиническом исследовании SHIFT случаи повышения АД встречались чаще в группе пациентов, принимавших ивабрадин (7.1%), в сравнении с группой плацебо (6.1%). Такие случаи встречались особенно часто непосредственно после изменения гипотензивной терапии, носили временный характер и не влияли на эффективность терапии ивабрадином. При изменении гипотензивной терапии у пациентов с ХСН, принимающих ивабрадин, следует контролировать АД через определенные интервалы времени (см. раздел «Побочное действие»).
Специальная информация по вспомогательным веществам
Препарат Бравадин® содержит лактозу, поэтому препарат противопоказан пациентам с дефицитом лактазы, непереносимостью лактозы, синдромом глюкозо-галактозной мальабсорбции.
Влияние на способность к вождению автотранспорта и управлению механизмами
Было проведено специальное исследование с участием здоровых добровольцев с целью оценить возможное влияние на способность управлять автомобилем. Доказательств влияния ивабрадина на способность управлять автомобилем получено не было. Однако в пострегистрационном периоде были сообщения о влиянии на способность к вождению из-за нарушения световосприятия. Ивабрадин может вызывать временное изменение световосприятия, преимущественно в виде фотопсии (см. раздел «Побочное действие»), что должно приниматься во внимание при управлении автотранспортом или при работе с механизмами, в ситуациях при резком изменении интенсивности света, особенно при вождении автомобиля в ночное время.
Ивабрадин не оказывает влияния на способность управления механизмами.
Передозировка
Симптомы: возможна тяжелая и продолжительная брадикардия (см. раздел «Побочное действие»).
Лечение: при тяжелой брадикардии проводится симптоматическое лечение в условиях специализированных отделений стационара. В случае сочетания брадикардии с нарушением показателей гемодинамики необходимо в/в введение бета-адреномиметиков (изопреналин). При необходимости может быть назначена временная электрокардиостимуляция.
Лекарственное взаимодействие
Фармакодинамическое взаимодействие
Одновременное применение не рекомендуется
Препараты, удлиняющие интервал QT:
— антиаритмические средства, удлиняющие интервал QT (например, хинидин, дизопирамид, бепридил, соталол, ибутилид, амиодарон);
— препараты, удлиняющие интервал QT, не предназначенные для лечения сердечно-сосудистых заболеваний (например, пимозид, зипрасидон, сертиндол, мефлохин, галофантрин, пентамидин, цизаприд, эритромицин для в/в введения).
Следует избегать одновременного применения ивабрадина и лекарственных средств, удлиняющих интервал QT, поскольку урежение ЧСС может вызвать дополнительное удлинение интервала QT. При необходимости одновременного применения требуется тщательный контроль ЭКГ (см. раздел «Особые указания»).
Одновременное применение, требующее осторожности
Некалийсберегающие диуретики (тиазидные и «петлевые»): гипокалиемия может повысить риск развития аритмии. Применение ивабрадина может вызывать брадикардию, тогда как сочетание гипокалиемии и брадикардии является предрасполагающим фактором для развития тяжелой формы аритмии, особенно у пациентов с синдромом удлиненного интервала QT, как врожденным, так и вызванным применением лекарственных средств.
Фармакокинетическое взаимодействие
Цитохром P450 3A4 (изофермент CYP3A4)
Ивабрадин подвергается метаболизму в печени с участием только изофермента CYP3A4 и является очень слабым ингибитором данного цитохрома. Не воздействует на метаболизм и концентрацию в плазме крови других субстратов (сильных, умеренных и слабых ингибиторов) изофермента CYP3A4. Ингибиторы и индукторы изофермента CYP3A4 могут вступать во взаимодействие с ивабрадином и оказывать клинически значимое влияние на его метаболизм и фармакокинетические свойства. Ингибиторы изофермента CYP3A4 повышают, а индукторы изофермента CYP3A4 снижают концентрацию ивабрадина в плазме крови. Повышение концентрации ивабрадина в плазме крови может вызывать риск развития тяжелой брадикардии (см. раздел «Особые указания»).
Одновременное применение противопоказано
Одновременное применение с сильными ингибиторами изофермента CYP3A4, такими как противогрибковые средства группы азолов (кетоконазол, итраконазол), антибиотики из группы макролидов (кларитромицин, эритромицин для приема внутрь, джозамицин, телитромицин), ингибиторы ВИЧ-протеазы (нелфинавир, ритонавир) и нефазодон, противопоказано (см. раздел «Противопоказания»). Сильные ингибиторы изофермента CYP3A4 — кетоконазол (200 мг 1 раз/сут) или джозамицин (1 г 2 раза/сут) повышают среднюю концентрацию ивабрадина в плазме крови в 7-8 раз.
Умеренные ингибиторы изофермента CYP3A4: специальные исследования взаимодействия с участием здоровых добровольцев и пациентов показали, что одновременное применение ивабрадина с препаратами, уменьшающими ЧСС (дилтиазем или верапамил), сопровождалось увеличением AUC ивабрадина в 2-3 раза и дополнительным урежением ЧСС на 5 уд./мин. Одновременное применение ивабрадина и перечисленных препаратов противопоказано (см. раздел «Противопоказания»).
Одновременное применение не рекомендуется
При одновременном применении с грейпфрутовым соком отмечалось повышение концентрации ивабрадина в плазме крови в 2 раза. Во время применения ивабрадина употребление грейпфрутового сока не рекомендуется.
Одновременное применение, требующее осторожности
Одновременное применение ивабрадина с другими умеренными ингибиторами изофермента CYP3A4 (например, флуконазол) возможно, если ЧСС в покое составляет более 60 уд./мин. Рекомендуемая начальная доза ивабрадина — 2.5 мг 2 раза/сут. Необходим контроль ЧСС.
Индукторы изофермента CYP3A4 (например, рифампицин, барбитураты, фенитоин и препараты, содержащие зверобой продырявленный) могут снижать концентрацию в плазме крови и активность ивабрадина и потребовать подбора его дозы. Одновременное применение ивабрадина в дозе 10 мг 2 раза/сут и лекарственных средств, содержащих зверобой продырявленный, уменьшает AUC ивабрадина в 2 раза. Поэтому применение препаратов, содержащих зверобой продырявленный, во время терапии ивабрадином следует ограничить.
Одновременное применение с другими лекарственными средствами
Специальные исследования лекарственного взаимодействия подтвердили отсутствие клинически значимого влияния перечисленных далее препаратов на фармакодинамику и фармакокинетику ивабрадина: ингибиторы протоновой помпы (омепразол, лансопразол), силденафил, ингибиторы ГМГ-КоА-редуктазы (симвастатин), дигидропиридиновые блокаторы кальциевых каналов (амлодипин, лацидипин), дигоксин и варфарин. Ивабрадин не оказывает клинически значимого влияния на фармакокинетику симвастатина, амлодипина, лацидипина, на фармакокинетику и фармакодинамику дигоксина, варфарина и на фармакодинамику ацетилсалициловой кислоты.
В опорных клинических испытаниях III фазы отсутствовали ограничения по приему следующих препаратов, которые, поэтому, применялись в комбинации с ивабрадином в обычном порядке без изменения профиля безопасности проводимой терапии: ингибиторы АПФ, антагонисты рецепторов ангиотензина II, бета-адреноблокаторы, диуретики, нитраты короткого и пролонгированного действия, ингибиторы ГМГ-КоА-редуктазы, фибраты, ингибиторы протонной помпы, гипогликемические средства для приема внутрь, ацетилсалициловая кислота и другие антиагрегантные средства.
Дети
Исследования проводились только с участием взрослых.
Срок годности препарата
Срок годности — 5 лет.
Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата или работы с ним
Нет особых требований к утилизации. Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
Контакты для обращений
КРКА д.д., представительство, (Словения)
Представительство АО «KRKA, d.d., Novo mesto» (Словения) в Беларуси
220114 Минск, ул. Филимонова 25Г, оф. 315, 3 этаж
Тел/факс: (375-740) 740-92-30
E-mail: info.by@krka.biz

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.АритмияДля сердца и сосудовСердечная недостаточностьТаблеткиТаблетки
Автор статьи
Ибраева Екатерина Анатольевна
,
Диплом о фармацевтическом образовании: 105924 3510869 рег. номер 31955
Все авторы
Содержание статьи
- Бравадин: РЛС
- Бравадин: действующее вещество
- Бравадин: от чего помогает
- Бравадин: через сколько действует
- Бравадин: противопоказания
- Бравадин: побочные эффекты
- Кораксан (Ивабрадин) или Бравадин: что лучше
- Бравадин или Конкор (Бисопролол): что лучше
- Краткое содержание
- Задайте вопрос эксперту по теме статьи
Смертность от сердечно-сосудистых заболеваний в России планомерно снижается начиная с 2010 года. Тем не менее несмотря на проводимые медико-профилактические мероприятия, патологии сердца и сосудов по-прежнему занимают лидирующую позицию по заболеваемости и летальному исходу. Такую статистику подтверждает Министерство здравоохранения Российской Федерации. Наиболее опасным «сердечным» заболеванием считается ишемическая болезнь сердца и ее проявление – стенокардия.
Провизор расскажет о препарате Бравадин: ознакомит с его действующим веществом, показаниями к применению, противопоказаниями и побочными действиями, а также сравнит с аналогами.
Бравадин: РЛС
Бравадин – лекарство, зарегистрированное в Государственном реестре лекарственных средств России (ГРЛС). Медикамент также входит в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП). В номенклатуре аптеки числятся:
- таблетки Бравадин 5 мг;
- таблетки Бравадин 7,5 мг.
Бравадин: действующее вещество
Действующее вещество Бравадин – ивабрадин. Активное соединение замедляет частоту сердечных сокращений, в результате чего снижает работу сердца и уменьшает потребность миокарда (сердечной мышцы) в кислороде.
Бравадин: от чего помогает
Многие пациенты ошибочно полагают, что Бравадин – это антиаритмический препарат. Однако назначение Бравадин от тахикардии нецелесообразно, поскольку цель приема медикамента другая.
В норме доставка кислорода к сердцу всегда соответствует его потребности. Под действием неблагоприятных факторов (повышения частоты сердечных сокращений, сужения или закупорки коронарных сосудов), происходит дисбаланс между поставляемым кислородом и потребностью сердца в нем. В результате развивается приступ стенокардии – давящей боли в груди. В таком случае на помощь приходят таблетки Бравадин. В показания Бравадин входит:
- облегчение симптомов стабильной стенокардии при ишемической болезни сердца (при неэффективности или непереносимости лекарств первой линии);
- лечение хронической сердечной недостаточности (при неэффективности или непереносимости лекарств первой линии).
Бравадин снижает давление?
Согласно инструкции, влияние Бравадина на артериальное давление незначительное. Тем не менее прием препарата противопоказан при тяжелой артериальной гипотензии и может провоцировать чрезмерное снижение артериального давления.
Бравадин: через сколько действует
Максимальная концентрация Бравадина в крови определяется через час после приема. Стойкий терапевтический эффект развивается не сразу. Установлено, что показатели нагрузочных проб у пациентов со стенокардией улучшаются через 3-4 недели терапии.
Бравадин: противопоказания
Часто людей интересует применение Бравадин при беременности. Прием препарата для женщин в период вынашивания ребенка и планирования беременности ограничен, в связи с токсичностью лекарства для плода. К другим противопоказаниям относятся:
- повышенная чувствительность к компонентам препарата;
- кардиогенный шок;
- острый инфаркт миокарда;
- сниженное артериальное давление;
- нарушение функции печени;
- слабость синусового узла сердца;
- нарушение сердечной проводимости;
- нестабильная или острая сердечная недостаточность;
- нестабильный тип стенокардии;
- одновременный прием с некоторыми группами лекарств;
- наследственная непереносимость галактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция;
- грудное вскармливание;
- возраст до 18 лет.
Совместимы ли Бравадин и алкоголь?
На время лечения рекомендуется воздержаться от употребления алкоголя. Спиртные напитки снижают эффективность терапии, провоцируя приступы стенокардии и повышая риск развития побочных действий таблеток Бравадин.
Бравадин: побочные эффекты
- головная боль, преимущественно в первый месяц лечения;
- головокружение;
- изменение световосприятия;
- нечеткость зрения;
- чрезмерное снижение частоты сердечных сокращений;
- выраженное снижение артериального давления;
- одышка;
- тошнота;
- запор и диарея;
- аллергия;
- другие.
Кораксан (Ивабрадин) или Бравадин: что лучше
Кораксан – оригинальное лекарственное средство на основе ивабрадина. Препарат первым введен в медицинскую практику, являясь научной разработкой французской компании «Лаборатории Сервье».
Сегодня на фармацевтическом рынке содержится ряд аналогов, к числу которых относятся лекарства с торговыми наименованиями Ивабрадин и Бравадин. Основная разница между медикаментами заключается в компании производства и вспомогательных компонентах, использованных для изготовления таблеток.
- Бравадин – ивабрадин от российского подразделения международной компании «КРКА»;
- Ивабрадин выпускается четырьмя отечественными фармацевтическими компаниями: «Биоком» (Ставропольский край), «Атолл» (Жигулевск), «Канонфарма продакшн» (Московская область) и «Медисорб» (Пермский край).
Нельзя однозначно сказать, что лучше: Кораксан, Бравадин или Ивабрадин. Препараты – прямые аналоги и взаимозаменяемые лекарственные средства. При выборе в первую очередь рекомендуется следовать назначениям врача.
Бравадин или Конкор (Бисопролол): что лучше
Конкор (Бисопролол) – лекарство из группы под названием бета-адреноблокаторы. Спектр терапевтического действия препарата шире: Конкор (Бисопролол) не только снижает потребность миокарда в кислороде, но также снижает артериальное давление и проявляет антиаритмическое действие.
Бета-адреноблокаторы – препараты первой линии для лечения стабильной стенокардии. При их неэффективности или непереносимости, пациентам назначают Бравадин или его аналоги. Решение о необходимости добавления или замены лекарства принимает врач, учитывая результаты обследования, историю болезни и общее состояние пациента.
Краткое содержание
- Бравадин – лекарство, зарегистрированное в Государственном реестре лекарственных средств России (ГРЛС).
- Действующее вещество Бравадин – ивабрадин.
- В показания Бравадин входит облегчение симптомов стабильной стенокардии при ишемической болезни сердца и лечение хронической сердечной недостаточности.
- Стойкий терапевтический эффект развивается не сразу.
- Ивабрадин имеет противопоказания и побочные действия.
- Нельзя однозначно сказать, что лучше: Кораксан, Бравадин или Ивабрадин.
- Конкор (Бисопролол) не только снижает потребность миокарда в кислороде, но также снижает артериальное давление и проявляет антиаритмическое действие.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда