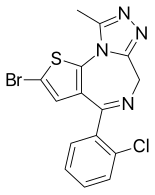
Бротизолам
Brotizolam
Фармакологическое действие
Снотворное средство из группы производных бензодиазепина. Увеличивает общую продолжительность сна, уменьшает частоту пробуждений. Оказывает также седативное, центральное миорелаксирующее и противосудорожное действие.
Показания
Расстройства засыпания и сна, в частности, связанные с внутренним беспокойством и напряжением.
Противопоказания
- Повышенная чувствительность к производным бензодиазепина;
- цирроз печени;
- миастения;
- беременность;
- лактация.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и хорошо контролируемых исследований о возможности применения бротизолама у беременных женщин не проведено.
Противопоказано применение при беременности.
Применение в период грудного вскармливания
Специальных исследований о возможности применения бротизолама в период грудного вскармливания не проведено.
На время лечения следует прекратить грудное вскармливание.
Способ применения и дозы
При приёме внутрь разовая доза составляет 250 мкг перед сном, в отдельных случаях — 500 мкг. Для пожилых пациентов разовая доза — 125 мкг.
Побочные действия
Возможно
Ощущение усталости на следующее утро после приёма бротизолама, головная боль, головокружение.
Редко
сухость во рту, тошнота, отсутствие аппетита.
Передозировка
Данные по передозировке бротизоламом не описаны.
Возможно усиление побочных эффектов.
Лечение симптоматическое.
Взаимодействие
Угнетающее влияние бротизолама на центральную нервную систему усиливается при одновременном применении препаратов с депрессивным действием на центральную нервную систему, а также содержащих этанол.
Особые указания
Учитывая возможность развития лекарственной зависимости при длительном применении бротизолама, вопрос о целесообразности продолжительного лечения, превышающего несколько недель, следует решать индивидуально. При завершении курса лечения дозу следует уменьшать постепенно, учитывая возможность развития синдрома отмены.
Опыт применения бротизолама у детей и подростков до 18 лет отсутствует.
Влияние на способность к вождению автотранспорта и управлению механизмами
Пациентам, принимающим бротизолам, необходимо воздерживаться от потенциально опасных видов деятельности, требующих повышенного внимания и быстрых психомоторных реакций.
Классификация
-
АТХ
N05CD09
-
Фармакологическая группа
-
Код МКБ 10
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Бротизолам предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Бротизолам, содержатся в инструкции производителя, прилагаемой к упаковке.
From Wikipedia, the free encyclopedia
 |
|
 |
|
| Clinical data | |
|---|---|
| Trade names | Lendormin |
| AHFS/Drugs.com | International Drug Names |
| Routes of administration |
Oral |
| ATC code |
|
| Legal status | |
| Legal status |
|
| Pharmacokinetic data | |
| Bioavailability | 48–95% |
| Metabolism | Hepatic |
| Elimination half-life | 4.4 hours (range, 2.6–6.9 h) |
| Excretion | Renal |
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEMBL |
|
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.055.404 |
| Chemical and physical data | |
| Formula | C15H10BrClN4S |
| Molar mass | 393.69 g·mol−1 |
| 3D model (JSmol) |
|
|
SMILES
|
|
|
InChI
|
|
| |
Brotizolam[3] (marketed under brand name Lendormin) is a sedative-hypnotic[4] thienotriazolodiazepine[5] drug which is a benzodiazepine analog.[6] It possesses anxiolytic, anticonvulsant, hypnotic, sedative and skeletal muscle relaxant properties, and is considered to be similar in effect to other short-acting hypnotic benzodiazepines such as triazolam or midazolam.[7] It is used in the short-term treatment of severe insomnia. Brotizolam is a highly potent and short-acting hypnotic, with a typical dose ranging from 0.125 to 0.25 milligrams, which is rapidly eliminated with an average half-life of 4.4 hours (range 3.6–7.9 hours).[8]
It was patented in 1974[9] and came into medical use in 1984.[10] Brotizolam is not approved for sale in the UK, United States or Canada. It is approved for sale in the Netherlands, Germany, Spain, Belgium, Luxembourg, Austria, Portugal, Israel, Italy, Taiwan and Japan.
Medical uses[edit]
Brotizolam is prescribed for the short-term treatment, 2–4 weeks only of severe or debilitating insomnia. Insomnia can be described as a difficulty falling asleep, frequent awakening, early awakenings or a combination of each. Brotizolam is a short-acting benzodiazepine and is sometimes used in patients who have difficulty in maintaining sleep or getting to sleep. Hypnotics should only be used on a short-term basis or in those with chronic insomnia on an occasional basis.[11]
Brotizolam, in a dose of 0.25 mg can be used as a premedication prior to surgery, this dose was found to be comparable in efficacy to 2 mg flunitrazepam as a premedicant prior to surgery.[12]
Side effects[edit]
Common side effects of brotizolam are typical of hypnotic benzodiazepines and are related to CNS depression, and include somnolence, ataxia, headache, anterograde amnesia, dizziness, fatigue, impairment of motor functions, slurred speech, confusion, and clumsiness.
Less common side effects include hypotension, respiratory depression, hallucinations, nausea and vomiting, palpitations, and paradoxical reactions (i.e. aggression, anxiety, violent behavior, etc.).
Brotizolam can cause residual side effects the next day such as impaired cognitive and motor functions as well as drowsiness. Disruption of sleep patterns may also occur such as suppression of REM sleep. These side effects are more likely at higher doses (above 0.5–1 mg).[13]
In clinical trials brotizolam 0.125 to 0.5 mg improved sleep in insomniacs similarly to nitrazepam 2.5 and 5 mg, flunitrazepam 2 mg and triazolam 0.25 mg, whilst brotizolam 0.5 mg was shown to be superior to flurazepam 30 mg, but inferior to temazepam 30 mg in some studies. Brotizolam at dosages below 0.5 mg at night usually produced minimal morning drowsiness; no residual impairment of psychomotor performance occurs following dosages within the recommended range of 0.125 to 0.25 mg. No serious side effects have been reported to date and the most frequently observed adverse experiences are drowsiness, headache and dizziness. Mild rebound insomnia may occur in some patients when treatment is stopped.[8]
Contraindications and special caution[edit]
Thienodiazepines and benzodiazepines require special precaution if used in the elderly, during pregnancy, in children, alcohol or drug-dependent individuals and individuals with comorbid psychiatric disorders.[14]
Pharmacology[edit]
Brotizolam has been shown in animal studies to be a very high potency thienodiazepine. The elimination half-life of brotizolam is 3–6 hours. It is absorbed rapidly after administration; after administration, it is metabolized into active metabolites, one of which is far less potent than brotizolam and the other is only present in very small amounts in the blood and thus the metabolites of brotizolam do not have significant pharmacological effect in humans.[6] Brotizolam induces impairment of motor function and has hypnotic properties.[15]
Brotizolam increases the slow wave light sleep (SWLS) in a dose-dependent manner whilst suppressing deep sleep stages. Less time is spent in stages 3 and 4, which are the deep sleep stages, when GABAergics such as brotizolam are used. Benzodiazepines and thienodiazepines are therefore not ideal hypnotics in the treatment of insomnia. The suppression of deep sleep stages by either may be especially problematic to the elderly as they naturally spend less time in the deep sleep stage.[16]
Abuse[edit]
Brotizolam is a drug with a potential for abuse. Drug misuse is defined as taking the drug to achieve a ‘high’, or continuing to take the drug in the long term against medical advice.[17]
Abuse of brotizolam, although not widespread, was a problem in Hong Kong back in the late 1980s and 1990s. To control benzodiazepine abuse in Hong Kong, the Government’s Pharmacy and Poisons Board reclassified benzodiazepines as Dangerous Drugs in October 1990. Apart from formal prescriptions, detailed records were then required for the supply and dispensing of these drugs. These regulations were applied initially only to brotizolam, triazolam and flunitrazepam as they were the major benzodiazepines of abuse. The impact of these regulatory changes on benzodiazepine use has been studied by analyzing the sales patterns of seven benzodiazepines between 1990–1993. In 1991, the sales of flunitrazepam and triazolam fell, but the sales of five unrestricted benzodiazepines increased.[18] Particular problems arose with the trafficking and abuse of nimetazepam and the abuse of temazepam within that same year in 1991. The regulations that were originally only applied to brotizolam, triazolam and flunitrazepam were now being extended to include all benzodiazepines by January 1992. A regulation requiring the use of proper prescriptions and detailed records for the supply and dispensing of benzodiazepines, appears to have curbed, at least partially, their abuse in Hong Kong. There are still some problems with temazepam, nimetazepam, triazolam, and brotizolam, but they are not major.
Commercial names[edit]
| Name | Countries |
| Bondormin, Brotizolam | Israel |
| Dormex | Chile |
| Lendorm | Austria, Denmark |
| Lendormin | South Africa, Belgium, Germany, Hungary, Italy, Japan, Netherlands, Portugal, Taiwan |
| Lendormine | Switzerland |
| Lindormin | Mexico |
| Noctilan | Chile |
| Sintonal | Spain |
See also[edit]
- Benzodiazepines
- Thienodiazepines
- Benzodiazepine dependence
- Benzodiazepine withdrawal syndrome
- Long-term effects of benzodiazepines
- Midazolam
- Triazolam
- Loprazolam
- Flubrotizolam
- Fluclotizolam
- Flurazepam
- Responsible drug use, recreational drug use
- GABA
References[edit]
- ^ Anvisa (2023-03-31). «RDC Nº 784 — Listas de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial» [Collegiate Board Resolution No. 784 — Lists of Narcotic, Psychotropic, Precursor, and Other Substances under Special Control] (in Brazilian Portuguese). Diário Oficial da União (published 2023-04-04). Archived from the original on 2023-08-03. Retrieved 2023-08-16.
- ^ «DEA Diversion Control Division» (PDF). Archived from the original (PDF) on 2019-10-17. Retrieved 2015-12-10.
- ^ US 4094984 6-Phenyl-8-bromo-4H-s-triazolo-[3,4C]-thieno-[2,3E]-1,4-diazepines and salts thereof
- ^ Fink M, Irwin P (September 1981). «Pharmacoelectroencephalographic study of brotizolam, a novel hypnotic». Clinical Pharmacology and Therapeutics. 30 (3): 336–42. doi:10.1038/clpt.1981.169. PMID 7273596. S2CID 30788171.
- ^ Catabay A, Taniguchi M, Jinno K, Pesek JJ, Williamsen E (1 March 1998). «Separation of 1,4-Benzodiazepines and Analogues Using Cholesteryl-10-Undecenoate Bonded Phase in Microcolumn Liquid Chromatography». Journal of Chromatographic Science. 36 (3): 113. doi:10.1093/chromsci/36.3.111.
- ^ a b Jochemsen R, Wesselman JG, van Boxtel CJ, Hermans J, Breimer DD (1983). «Comparative pharmacokinetics of brotizolam and triazolam in healthy subjects». British Journal of Clinical Pharmacology. 16 (Suppl 2): 291S–297S. doi:10.1111/j.1365-2125.1983.tb02303.x. PMC 1428224. PMID 6140948.
- ^ Mandrioli R, Mercolini L, Raggi MA (October 2008). «Benzodiazepine metabolism: an analytical perspective». Current Drug Metabolism. 9 (8): 827–44. doi:10.2174/138920008786049258. PMID 18855614.
- ^ a b Langley MS, Clissold SP (February 1988). «Brotizolam. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy as an hypnotic». Drugs. 35 (2): 104–22. doi:10.2165/00003495-198835020-00002. PMID 3281819. S2CID 243228878.
- ^ US4094984 6-Phenyl-8-bromo-4H-s-triazolo-[3,4C]-thieno-[2,3E]-1,4-diazepines and salts thereof
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 539. ISBN 9783527607495.
- ^ Rickels K (1986). «The clinical use of hypnotics: indications for use and the need for a variety of hypnotics». Acta Psychiatrica Scandinavica. Supplementum. 332: 132–41. doi:10.1111/j.1600-0447.1986.tb08990.x. PMID 2883820. S2CID 46560074.
- ^ Nishiyama T, Yamashita K, Yokoyama T, Imoto A, Manabe M (2007). «Effects of quazepam as a preoperative night hypnotic: comparison with brotizolam». Journal of Anesthesia. 21 (1): 7–12. doi:10.1007/s00540-006-0445-2. PMID 17285406. S2CID 24584685.
- ^ Nicholson AN, Stone BM, Pascoe PA (July 1980). «Studies on sleep and performance with a triazolo-1, 4-thienodiazepine (brotizolam)». British Journal of Clinical Pharmacology. 10 (1): 75–81. doi:10.1111/j.1365-2125.1980.tb00504.x. PMC 1430017. PMID 7397057.
- ^ Authier N, Balayssac D, Sautereau M, Zangarelli A, Courty P, Somogyi AA, et al. (November 2009). «Benzodiazepine dependence: focus on withdrawal syndrome» [Benzodiazepine dependence: Focus on withdrawal syndrome]. Annales Pharmaceutiques Françaises (in French). 67 (6): 408–13. doi:10.1016/j.pharma.2009.07.001. PMID 19900604.
- ^ Yasui M, Kato A, Kanemasa T, Murata S, Nishitomi K, Koike K, et al. (June 2005). «[Pharmacological profiles of benzodiazepinergic hypnotics and correlations with receptor subtypes]». Nihon Shinkei Seishin Yakurigaku Zasshi = Japanese Journal of Psychopharmacology. 25 (3): 143–51. PMID 16045197.
- ^ Noguchi H, Kitazumi K, Mori M, Shiba T (March 2004). «Electroencephalographic properties of zaleplon, a non-benzodiazepine sedative/hypnotic, in rats». Journal of Pharmacological Sciences. 94 (3): 246–51. doi:10.1254/jphs.94.246. PMID 15037809.
- ^ Griffiths RR, Johnson MW (2005). «Relative abuse liability of hypnotic drugs: a conceptual framework and algorithm for differentiating among compounds». The Journal of Clinical Psychiatry. 66 (Suppl 9): 31–41. PMID 16336040.
- ^ Lee KK, Chan TY, Chan AW, Lau GS, Critchley JA (1995). «Use and abuse of benzodiazepines in Hong Kong 1990-1993—the impact of regulatory changes». Journal of Toxicology. Clinical Toxicology. 33 (6): 597–602. doi:10.3109/15563659509010615. PMID 8523479.
Further reading[edit]
- Greenblatt DJ, Locniskar A, Shader RI (1983). «Pilot pharmacokinetic study of brotizolam, a thienodiazepine hypnotic, using electron-capture gas-liquid chromatography». Sleep. 6 (1): 72–6. doi:10.1093/sleep/6.1.72. PMID 6844800.
- Langley MS, Clissold SP (February 1988). «Brotizolam. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy as an hypnotic». Drugs. 35 (2): 104–22. doi:10.2165/00003495-198835020-00002. PMID 3281819. S2CID 243228878.
- Bechtel WD (1983). «Pharmacokinetics and metabolism of brotizolam in humans». British Journal of Clinical Pharmacology. 16 (Suppl 2): 279S–283S. doi:10.1111/j.1365-2125.1983.tb02301.x. PMC 1428235. PMID 6661373.
- Jochemsen R, Wesselman JG, Hermans J, van Boxtel CJ, Breimer DD (1983). «Pharmacokinetics of brotizolam in healthy subjects following intravenous and oral administration». British Journal of Clinical Pharmacology. 16 (Suppl 2): 285S–290S. doi:10.1111/j.1365-2125.1983.tb02302.x. PMC 1428208. PMID 6661374.
External links[edit]
- Inchem.org — Brotizolam
Описание активного компонента
Фармакологическое действие
Снотворное средство из группы производных бензодиазепина. Увеличивает общую продолжительность сна, уменьшает частоту пробуждений. Оказывает также седативное, центральное миорелаксирующее и противосудорожное действие.
Показания
Расстройства засыпания и сна, в частности, связанные с внутренним беспокойством и напряжением.
Режим дозирования
При приеме внутрь разовая доза составляет 250 мкг перед сном, в отдельных случаях — 500 мкг. Для пожилых пациентов разовая доза — 125 мкг.
Побочное действие
Возможно: ощущение усталости на следующее утро после приема бротизолама, головная боль, головокружение.
Редко: сухость во рту, тошнота, отсутствие аппетита.
Противопоказания
Цирроз печени, миастения, беременность, лактация; повышенная чувствительность к производным бензодиазепина.
Беременность и лактация
Противопоказан во время беременности и в период лактации.
Применение при нарушениях функции печени
Противопоказан при циррозе печени.
Применение в пожилом возрасте
Для пожилых пациентов требуется уменьшение разовой дозы (см режим дозирования).
Применение для детей
Опыт применения бротизолама у детей и подростков до 18 лет отсутствует.
Особые указания
Учитывая возможность развития лекарственной зависимости при длительном применении бротизолама, вопрос о целесообразности продолжительного лечения, превышающего несколько недель, следует решать индивидуально. При завершении курса лечения дозу следует уменьшать постепенно, учитывая возможность развития синдрома отмены.
Опыт применения бротизолама у детей и подростков до 18 лет отсутствует.
Влияние на способность к вождению автотранспорта и управлению механизмами
Пациентам, принимающим бротизолам, необходимо воздерживаться от потенциально опасных видов деятельности, требующих повышенного внимания и быстрых психомоторных реакций.
Лекарственное взаимодействие
Угнетающее влияние бротизолама на ЦНС усиливается при одновременном применении препаратов с депрессивным действием на ЦНС, а также содержащих этанол.
Бортезол — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-004178
Торговое наименование препарата
Бортезол
Международное непатентованное наименование
Бортезомиб
Лекарственная форма
лиофилизат для приготовления раствора для внутривенного и подкожного введения
Состав
На 1 флакон:
Действующее вещество: бортезомиб 3,50 мг;
Вспомогательные вещества: маннитол 35,00 мг.
Описание
Лиофилизированная масса или порошок от белого до почти белого цвета.
Фармакотерапевтическая группа
Противоопухолевое средство
Код АТХ
L01XX32
Фармакодинамика:
Бортезомиб — это обратимый ингибитор химотрипсин-подобной активности 26S-протеасомы клеток млекопитающих. Эта протеасома представляет собой крупный белковый комплекс, который расщепляет белки, конъюгированные с убиквитином. Убиквитин-протеасомный путь играет ключевую роль в регуляции внутриклеточной концентрации некоторых белков и, таким образом, поддерживает внутриклеточный гомеостаз. Подавление активности протеасомы предотвращает этот селективный протеолиз, что может влиять на многие каскады реакций передачи сигнала в клетке. Нарушение механизма поддержания гомеостаза может приводить к гибели клетки.
In vivo бортезомиб вызывал замедление роста опухоли во многих экспериментальных моделях, включая множественную миелому.
В экспериментах in vitro, ex vivo и на животных моделях бортезомиб усиливал дифференцировку и активность остеобластов и ингибировал функцию остеокластов. Эти эффекты наблюдались у пациентов с множественной миеломой с множественными очагами остеолиза, получающих терапию бортезомибом.
Фармакокинетика:
При внутривенном струйном введении бортезомиба в дозах 1,0 мг/м2 и 1,3 мг/м2 больным с множественной миеломой максимальные концентрации препарата в плазме составляют соответственно 57 и 112 нг/мл. При последующем введении препарата максимальные концентрации в плазме крови находятся в пределах 67-106 нг/мл для дозы 1,0 мг/м2 и примерно 89-120 для дозы 1,3 мг/м2. Средний период полувыведения препарата при многократном введении составляет 40-193 часа.
Препарат быстрее выводится после первой дозы по сравнению с последующими дозами. После первого введения в дозах 1,0 мг/м2 и 1,3 мг/м2 средний общий клиренс составляет соответственно 102 и 112 л/ч, а после последующих введений — соответственно 15-32 л/ч.
При введении в дозе 1,3 мг/м2 подкожно или внутривенно больным с множественной миеломой общее системное воздействие после повторного введения в той же дозе (AUClast) было эквивалентно для обоих путей введения (155 нг*ч/мл при подкожном введении и 151 нг*ч/мл при внутривенном введении). Сmах после подкожного введения (20,4 нг/мл) была ниже, чем после внутривенного введения (223 нг/мл).
Среднее геометрическое соотношение AUClast составило 0,99, а 90%-ные доверительные интервалы — 80,18-122,80%. Тmах составляло 30 мин при подкожном введении и 2 мин при внутривенном введении.
Распределение
После однократного или многократного введения в дозах 1,0 мг/м2 и 1,3 мг/м2 средний объем распределения бортезомиба у пациентов с множественной миеломой составляет 1659-3294 л (489-1884 л/м2). Это позволяет предположить, что бортезомиб интенсивно распределяется в периферических тканях. При концентрациях бортезомиба 100-1000 нг/мл связывание препарата с белками плазмы крови составляет в среднем 83%. Фракция бортезомиба, связанного с белками плазмы, не зависит от концентрации.
Метаболизм
В условиях in vitro метаболизм бортезомиба преимущественно осуществляется изоферментами цитохрома Р450 — CYP3A4, CYP2C19 и CYP1А2.
Участие изоферментов CYP2D6 и CYP2C9 в метаболизме бортезомиба незначительно. Основным путем метаболизма является отщепление атомов бора с образованием двух метаболитов, которые в дальнейшем гидроксилируются с образованием нескольких других метаболитов. Метаболиты бортезомиба не ингибируют протеасому 26S.
Выведение
Пути выведения бортезомиба у человека не изучались.
Фармакокинетика в особых группах пациентов
Возраст, пол и раса
Фармакокинетика бортезомиба изучалась у детей в возрасте от 2 до 16 лет с острой лимфобластной лейкемией или острой миелоидной лейкемией при внутривенном болюсном введении в дозе 1,3 мг/м2 2 раза в неделю. По данным популяционного анализа фармакокинетики, выведение бортезомиба ускорялось по мере увеличения площади поверхности тела пациента.
Среднее значение (коэффициент вариации, %) клиренса бортезомиба составило 7,79 (25%) л/ч/м2, равновесный объем распределения составил 834 (39%) л/м2, а период полувыведения — 100 (44%) ч.
После коррекции эффекта площади поверхности тела другие демографические переменные (такие как возраст, масса тела и пол) не оказывали клинически значимого влияния на клиренс бортезомиба.
Клиренс бортезомиба у детей, нормализованный по площади поверхности тела, был сопоставим с таковым у взрослых.
Влияние пола и расы на фармакокинетику бортезомиба не изучалось.
Пациенты с нарушением функции печени
Исследования фармакокинетики бортезомиба у онкологических больных с нарушениями функции печени проводились на 61 пациенте с различной степенью тяжести нарушений функции печени (см. таблицу 5) с применением доз бортезомиба 0,5-1,3 мг/м2.
Нарушение функции печени легкой степени не влияет на фармакокинетику бортезомиба.
У пациентов с нарушениями функции печени средней и тяжелой степени наблюдается 60% увеличение AUC (площадь под кривой «концентрация-время») бортезомиба по сравнению с пациентами с нормальной функцией печени. Для пациентов с нарушениями функции печени средней и тяжелой степени рекомендуется уменьшение начальной дозы бортезомиба. Требуется внимательное наблюдение таких пациентов.
Пациенты с нарушением функции почек
Фармакокинетика бортезомиба в дозах 0,7-1,3 мг/м2 внутривенно 2 раза в неделю у больных с нарушениями функции почек легкой, средней или тяжелой степени, включая пациентов, находящихся на диализе, сопоставима с фармакокинетикой препарата у больных с нормальной функцией почек.
Показания:
— Множественная миелома;
— мантийноклеточная лимфома.
Противопоказания:
— Повышенная чувствительность к бортезомибу, бору и маннитолу;
— беременность и период кормления грудью;
— детский возраст до 18 лет (отсутствие опыта применения);
— острые диффузные инфильтративные заболевания легких;
— поражение перикарда;
— одновременное применение с мощными индукторами изофермента CYP3A (рифампицин, карбамазепин, фенитоин, фенобарбитал, зверобой продырявленный).
С осторожностью:
— Нарушения функции печени тяжелой и средней степени;
— нарушения функции почек тяжелой степени;
— судороги или эпилепсия в анамнезе;
— обмороки;
— диабетическая нейропатия в анамнезе;
— одновременный прием гипотензивных препаратов;
— обезвоживание на фоне диареи или рвоты;
— запор;
— риск развития хронической сердечной недостаточности;
— одновременный прием ингибиторов или субстратов изофермента CYP3A4, одновременный прием субстратов изофермента CYP2C9, пероральных гипогликемических препаратов.
Беременность и лактация:
Применение препарата противопоказано при беременности и в период грудного вскармливания.
На время лечения препаратом следует прекратить кормление грудью.
Способ применения и дозы:
Бортезомиб вводится внутривенно струйно в течение 3-5 секунд или подкожно. Лекарственный препарат Бортезол показан только для внутривенного и подкожного введения. При интратекальном введении были зафиксированы случаи смерти.
При внутривенном введении концентрация раствора должна составлять 1 мг/мл. При подкожном введении концентрация раствора должна составлять 2,5 мг/мл. Концентрация раствора должна рассчитываться очень тщательно в связи с различием концентраций раствора для внутривенного введения и раствора для подкожного введения.
Монотерапия
Рецидивирующая множественная миелома и рецидивирующая мантийноклеточная лимфома
Рекомендуемая доза бортезомиба составляет 1,3 мг/м2 площади поверхности тела два раза в неделю в течение 2 недель (дни 1, 4, 8 и 11) с последующим 10-дневным перерывом (дни 12-21). Между введением последовательных доз препарата Бортезол должно пройти не менее 72 ч. Степень клинического ответа рекомендуется оценивать после проведения 3 и 5 циклов лечения.
В случае достижения полного клинического ответа рекомендуется проведение 2 дополнительных циклов лечения.
При длительности лечения более 8 циклов Бортезол можно применять по стандартной схеме или по схеме поддерживающей терапии рецидивирующей множественной миеломы — еженедельно в течение 4 недель (дни 1, 8, 15, 22) с последующим 13-дневным периодом отдыха (дни 23-35). Пациентам, у которых терапия препаратом Бортезол не дала клинического ответа (прогрессирование пли стабилизация заболевания после 2 или 4 циклов соответственно), может быть назначена комбинация высоких доз дексаметазона с препаратом Бортезол. В этом случае 40 мг дексаметазона назначается перорально с каждой дозой препарата Бортезол: 20 мг в день введения препарата Бортезол и 20 мг в следующий день после введения препарата Бортезол. Таким образом, прием дексаметазона производят в 1, 2, 4, 5, 8, 9, 11 и 12 день, суммарно 160 мг за 3 недели.
Коррекция дозы и возобновление терапии
При развитии гематологической токсичности 4-й степени или любого негематологического токсического эффекта 3-й степени, за исключением нейропатии, лечение препаратом Бортезол следует приостановить. После исчезновения симптомов токсичности лечение препаратом Бортезол можно возобновить в дозе, сниженной на 25% (дозу 1,3 мг/м2 снижают до 1,0 мг/м2; дозу 1,0 мг/м2 снижают до 0,7 мг/м2).
При появлении связанной с применением препарата Бортезол нейропатической боли и/или периферической сенсорной нейропатии дозу препарата изменяют в соответствии с таблицей 1. Отмечались случаи возникновения вегетативной нейропатии тяжелой степени, приводящие к прекращению или приостановлению терапии. У больных с тяжелой нейропатией в анамнезе Бортезол можно применять только после тщательной оценки соотношения риск/польза.
Таблица 1. Рекомендуемые изменения дозы при развитии вызванной препаратом Бортезол нейропатической боли и/или периферической сенсорной или двигательной нейропатии
|
Тяжесть периферической нейропатии |
Изменение дозы и частоты введения |
|
1-я степень (парестезия, слабость и/или угасание рефлексов) без боли или утраты функции. |
Доза и режим введения не требуют коррекции. |
|
1-я степень с болью или 2-я степень (нарушение функции, но не повседневной активности). |
Снизить дозу до 1,0 мг/м2 или изменить режим введения на 1,3 мг/м2 1 раз в неделю |
|
2-я степень с болью или 3-я степень (нарушение повседневной активности). |
Приостановить применение бортезомиба до исчезновения симптомов токсичности. После этого возобновить лечение, снизив дозу препарата до 0,7 мг/м2 и уменьшив частоту введения до одного раза в неделю. |
|
4-я степень (сенсорная нейропатия, приводящая к инвалидности или двигательная нейропатия, угрожающая жизни или приводящая к параличу). |
Прекратить применение бортезомиба. |
Комбинированная терапия
Множественная миелома у пациентов, ранее не получавших лечение, и которые не являются кандидатами на проведение трансплантации стволовых клеток
Рекомендуемая доза в комбинации с мелфаланом и преднизоном
Бортезомиб вводят внутривенно струйно в течение 3-5 секунд или подкожно в комбинации с мелфаланом и преднизоном, которые принимают внутрь. Проводят девять 6-недельных циклов, как показано в таблице 2. В циклах 1-4 бортезомиб применяют 2 раза в неделю (дни 1, 4, 8, 11, 22, 25, 29 и 32), а в циклах 5-9 — 1 раз в неделю (дни 1, 8, 22 и 29).
Таблица 2. Рекомендуемая схема дозирования бортезомиба, применяемого в комбинации с мелфаланом и преднизоном у пациентов с ранее нелеченой множественной миеломой, которым не показано проведение трансплантации стволовых клеток
|
Бортезомиб 2 раза в неделю (циклы 1-4) |
||||||||||||||||
|
Неделя |
1 |
2 |
3 |
4 |
5 |
6 |
||||||||||
|
Бортезомиб (1,3 мг/м2) |
день 1 |
— день 4 |
день 8 |
день 11 |
период отдыха |
день 22 |
день 25 |
день 29 |
день 32 |
период отдыха |
||||||
|
Мелфалан (9 мг/м2) + Преднизон (60 мг/м2) |
день 1 |
день 2 |
день 3 |
день 4 |
период отдыха |
|||||||||||
|
Бортезомиб 1 раз в неделю (циклы 5-9) |
||||||||||||||||
|
Неделя |
1 |
2 |
3 |
4 |
5 |
6 |
||||||||||
|
Бортезомиб (1,3 мг/м2) |
день 1 |
— |
— |
— |
день 8 |
период отдыха |
день 22 |
день 29 |
период отдыха |
|||||||
|
Мелфалан (9 мг/м2) + Преднизон (60 мг/м2) |
день 1 |
день 2 |
день 3 |
день 4 |
период отдыха |
|||||||||||
Коррекция дозы и схемы применения при применении бортезомиба совместно с мелфаланом и преднизоном
Перед началом нового цикла лечения:
— содержание тромбоцитов должно быть ≥ 70000/мкл;
— абсолютное содержание нейтрофилов (АСН) ≥ 1000/мкл;
— негематологическая токсичность должна снизиться до 1 степени или до исходного уровня.
Таблица 3. Коррекция дозы при последующих циклах лечения
|
Токсичность |
Коррекция или отсрочка дозы |
|
Гематологическая токсичность в ходе предыдущего цикла: |
|
|
Длительная нейтропения или тромбоцитопения 4 степени, либо тромбоцитопения с кровотечением |
В следующем цикле дозу мелфалана следует уменьшить на 25% |
|
— Содержание тромбоцитов < 30000/мкл или АСН < 750/мкл в день введения бортезомиба (кроме дня 1) |
Отложить введение бортезомиба |
|
— Несколько отсрочек введения бортезомиба в одном цикле (> 3 раз при введении 2 раза в неделю или > 2 раз при введении 1 раз в неделю) |
дозу бортезомиба снижают на 1 ступень (с 1,3 мг/м2 до 1,0 мг/м2; с 1,0 мг/м2 до 0,7 мг/м2). |
|
негематологическая токсичность ≥ 3 степени |
применение бортезомиба откладывают до снижения негематологической токсичности до 1 степени или до исходного уровня. после этого лечение бортезомибом можно возобновить в дозе, сниженной на 1 ступень (с 1,3 мг/м2 до 1,0 мг/м2; с 1,0 мг/м2 до 0,7 мг/м2). при развитии нейропатической боли и/или периферической нейропатии, связанной с применением бортезомиба, введение очередной дозы откладывают и/или корректируют дозу, как описано в таблице 1. |
дополнительная информация о мелфалане и преднизоне приводится в инструкциях по медицинскому применению этих препаратов.
множественная миелома у пациентов, ранее не получавших лечение, и которые являются кандидатами на проведение трансплантации стволовых клеток
рекомендуемая доза
рекомендуемая начальная доза бортезомиба при применении в комбинации с другими лекарственными препаратами составляет 1,3 мг/м2 площади поверхности тела два раза в неделю в течение 2 недель (дни 1, 4, 8, 11) с последующим перерывом продолжительностью 10-18 дней, что составляет 1 цикл лечения. необходимо провести от 3 до 6 таких циклов. между введением последовательных доз препарата бортезол должно пройти не менее 72 часов.
коррекцию дозы у пациентов, которым показано проведение трансплантации стволовых клеток, необходимо проводить согласно рекомендациям, описанным в таблице 1.
указания по дозированию лекарственных препаратов, применяемых в комбинации с препаратом бортезол, приведены в соответствующих инструкциях по медицинскому применению.
рецидивирующая множественная миелома
рекомендуемая доза при применении в комбинации с пегилированным липосомальным доксорубицином
указания по дозе и коррекции дозы препарата бортезол описаны выше в подразделе «монотерапия».
пегилированный липосомальный доксорубицин применяется в дозе 30 мг/м2 в 4-ый день 3-х недельного цикла приема препарата бортезол в виде внутривенной инфузии продолжительностью 1 ч. сразу после введения бортезомиба.
дополнительная информация о пегилированном липосомальном доксорубицине приводится в инструкции по медицинскому применению данного препарата.
рекомендуемая доза при применении в комбинации с дексаметазоном
указания в дозе и коррекции дозы препарата бортезол описаны выше в подразделе «монотерапия».
дексаметазон принимается внутрь в дозе 20 мг в сутки в день введения препарата бортезол и на следующий день.
дополнительная информация о дексаметазоне приводится в инструкции по медицинскому применению данного препарата.
повторная терапия множественной миеломы
в случае рецидива у пациентов, ранее ответивших на терапию препаратом бортезол (монотерапию или комбинированную терапию), необходимо начинать терапию с самой высокой переносимой дозы.
указания по дозированию описаны в подразделе «монотерапия».
ранее нелеченая мантийноклеточная лимфома
рекомендуемая доза при применении в комбинации с ритуксимабом, циклофосфамидом, доксорубицином и преднизоном
указания по дозе и коррекции дозы препарата бортезол описаны выше в подразделе «монотерапия». необходимо провести 6 циклов терапии бортезомибом. в случае, если у пациентов ответ на терапию впервые наблюдается во время 6-го цикла, рекомендуется провести еще 2 дополнительных цикла терапии препаратом бортезол. в 1-ый день каждого 3-недельного цикла терапии препаратом бортезол необходимо вводить следующие лекарственные препараты в виде внутривенных инфузий: ритуксимаб в дозе 375 мг/м2, циклофосфамид в дозе 750 мг/м2 и доксорубицин в дозе 50 мг/м2. преднизон принимается внутрь в дозе 100 мг/м2 в дни 1, 2, 3, 4 и 5 каждого цикла терапии препаратом бортезол.
коррекция дозы во время терапии ранее нелеченой мантийноклеточной лимфомы
перед началом нового цикла лечения (кроме цикла 1):
— содержание тромбоцитов должно быть ≥ 100000/мкл и абсолютное число нейтрофилов (ачн) ≥ 1500/мкл
— концетрация гемоглобина должна быть ≥ 8 г/дл (≥ 4,96 ммоль/л)
— негематологическая токсичность должна снизиться до 1 степени или до исходного уровня
при развитии гематологической токсичности 3-й степени или любого негематологического токсического эффекта 3-й степени, за исключением нейропатии, лечение препаратом бортезол следует приостановить. указания по коррекции дозы приведены в таблице 4.
таблица 4. коррекция дозы во время терапии у пациентов с ранее нелеченой мантийноклеточной лимфомой
|
токсичность |
коррекция или отсрочка дозы |
|
гематологическая токсичность: нейтропения ≥ 3 степени с лихорадкой или нейтропения 4 степени продолжительностью более 7 дней, содержание тромбоцитов ≤ 10000/мкл |
терапия препаратом бортезол должна быть приостановлена на срок до 2-х недель до момента, когда у пациента будут наблюдаться следующие показатели: ачн ≥ 750/мкл, содержащие тромбоцитов ≥ 25000/мкл. |
|
если при остановки терапии токсичность не разрешается до описанных выше показателей, то терапию необходимо полностью прекратить. |
|
|
если токсичность разрешается до показателей: лчн > 750/мкл содержание тромбоцитов > 25000/мкл, то доза препаратом бортезол должна быть снижена на 1 ступень (с 1,3 мг/м2 до 1,0 мг/м2, или е 1,0 мг/м2 до 0,7 мг/м2) |
|
|
содержание тромбоцитов < 25000/мкл или лчн < 750/мкд в день введения препарата бортезол (кроме дня 1) |
отложить введение препарата бортезол |
|
негематологическая токсичность 3 ≥ степени |
применение препарата бортезол откладывают до снижения негематологической токсичности до 2 степени или ниже. после этого лечение препаратом бортезол можно возобновить в дозе, сниженной на 1 ступень (с 1,3 мг/м2 до 1,0 мг/м2, или с 1,0 мг/м2 до 0,7 мг/м2). при развитии нейропатической боли и/или периферической нейропатии, связанной с применением препарата бортезол, введение очередной дозы откладывают и/или корректируют дозу, как описано в таблице 1. |
информация о режиме дозирования ритуксимаба, циклофосфамида, доксорубицина и преднизона приведена в инструкциях по медицинскому применению этих препаратов.
особые группы пациентов
пациенты с нарушениями функции почек
степень нарушения функции почек не влияет на фармакокинетику бортезомиба. поэтому для больных с почечной недостаточностью коррекции дозы не требуется. поскольку диализ может снижать концентрацию бортезомиба в крови, то препарат следует вводить после проведения диализа.
пациенты с нарушениями функции печени
у пациентов с нарушениями функции печени легкой степени не требуется изменения начальной дозы. следует назначать рекомендуемую дозу. пациентам с нарушениями функции печени средней и тяжелой степени следует назначать бортезомиб в уменьшенной дозе (см. таблицу 5).
таблица 5. рекомендуемые изменения начальной дозы бортезомиба у пациентов с нарушениями функции печени
|
степень тяжести нарушений функции печени |
концентрация билирубина |
активность act |
изменение начальной дозы |
|
легкая |
≤ 1,0 х вгн |
>вгн |
не требуется |
|
> 1,0 х -1,5 х вгн |
любая |
не требуется |
|
|
средняя |
> 1,5 х — 3 х вгн |
любая |
требуется назначать бортезомиб в уменьшенной дозе 0,7 мг/м2 в течение первого цикла. следует рассмотреть возможность увеличения дозы до 1,0 мг/м2 или дальнейшее уменьшение дозы до 0,5 мг/м2 в последующих циклах в зависимости от переносимости пациентом. |
|
тяжелая |
> 3 х вгн |
любая |
act = аспартатаминотрансфераза
вгн = верхняя граница нормы
способ применения
бортезол является противоопухолевым препаратом. при приготовлении раствора и обращении с препаратом следует проявлять осторожность. следует соблюдать соответствующие меры асептики. рекомендуется пользоваться перчатками и другой защитной одеждой для предотвращения контакта с кожей.
препарат нельзя смешивать с другими лекарственными средствами, за исключением 0,9% раствора натрия хлорида.
приготовление раствора для внутривенного введения
содержимое флакона растворяют в 3,5 мл 0,9% раствора натрия хлорида. концентрация приготовленного раствора для внутривенного введения — 1,0 мг/мл. приготовленный раствор должен быть прозрачным и бесцветным. при обнаружении механических включений или изменения цвета приготовленный раствор использовать нельзя.
полученный раствор вводят путем внутривенной болюсной инъекции продолжительностью 3-5 секунд через периферический или центральный венозный катетер, который затем промывают 0,9% раствором натрия хлорида для инъекций.
приготовление раствора для подкожного введения
содержимое флакона растворяют в 1,4 мл 0,9% раствора натрия хлорида. концентрация приготовленного раствора для подкожного введения — 2,5 мг/мл.
приготовленный раствор должен быть прозрачным и бесцветным. при обнаружении механических включений или изменения цвета приготовленный раствор использовать нельзя.
полученный раствор вводят подкожно в область бедра (правое или левое) или в область живота (справа или слева). необходимо постоянно менять место введения препарата. каждая последующая инъекция должна вводиться на расстоянии как минимум 2,5 см от места предыдущей инъекции. нельзя вводить препарат в чувствительные области, поврежденные области (покраснения, синяки), а также в области, где введение иглы затруднено.
в случае возникновения местных реакций в области подкожного введения бортезомиба можно использовать менее концентрированный раствор для подкожного введения (1 мг/мл вместо 2,5 мг/мл; для этого содержимое флакона растворяют в 3,5 мл 0,9% раствора хлорида натрия) или перейти на внутривенное введение препарата.
Побочные эффекты:
В целом, показатели безопасности бортезомиба при применении в монотерапии сходны с таковыми при применении его в комбинации с мелфаланом и преднизоном. Серьезные нежелательные реакции нечасто наблюдались во время терапии бортезомибом и включали сердечную недостаточность, синдром лизиса опухоли, легочную гипертензию, синдром обратимой задней энцефалопатии, острые диффузные инфильтративные легочные заболевания. Кроме того, в редких случаях наблюдалась вегетативная нейропатия.
Наиболее часто во время терапии бортезомибом отмечались следующие нежелательные реакции: тошнота, диарея, запор, рвота, усталость, пирексия, тромбоцитопения, анемия, нейтропения, периферическая нейропатия (в т.ч. сенсорная), головная боль, парестезия, снижение аппетита, одышка, сыпь, опоясывающий герпес и миалгия.
Ниже перечислены нежелательные реакции, которые были расценены как вероятно или возможно связанные с применением бортезомиба. Нежелательные реакции сгруппированы по системно-органным классам и частоте появления. Частоту нежелательных реакций классифицировали следующим образом: очень часто (>1/10), часто (≥1/100, <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10000 и <1/1000) и частота неизвестна.
Инфекционные и паразитарные заболевания:
часто — простой герпес, опоясывающий герпес (в т.ч. диссеминированный и офтальмогерпес), пневмония, грибковые инфекции;
нечасто — инфекция, бактериальные, вирусные инфекции, сепсис (в т.ч. септический шок), бронхопневмония, герпесвирусная инфекция, герпетический менингоэнцефалит, бактериемия (в т.ч. стафилококковая), ячмень, грипп, воспаление подкожно-жировой клетчатки, инфекции, ассоциированные с применением медицинских приборов, инфекции кожи, инфекции уха, стафилококковые инфекции, зубные инфекции;
редко — менингит (в т.ч. бактериальный), Эпштейн-Барр-вирусная инфекция, генитальный герпес, тонзиллит, мастоидит, синдром хронической усталости.
Новообразования доброкачественные, злокачественные и неопределенные (в т.ч. кисты и полипы):
редко — злокачественные новообразования, плазмоцитарный лейкоз, карцинома почки, новообразования, грибовидный микоз, доброкачественные новообразования.
Нарушения со стороны системы кроветворения и лимфатической системы:
очень часто — тромбоцитопения, нейтропения, анемия; часто — лейкопения, лимфопения;
нечасто — панцитопения, фебрильная нейтропения, коагулопатия, лейкоцитоз, лимфаденопатия, гемолитическая анемия;
редко — диссеминированное внутрисосудистое свертывание (ДВС-синдром), тромбоцитоз, синдром повышенной вязкости крови, нарушения со стороны тромбоцитов, тромбоцитопеническая пурпура, нарушения со стороны крови, геморрагический диатез, лимфоцитарная инфильтрация.
Нарушения со стороны иммунной системы:
нечасто — отек Квинке, гиперчувствительность;
редко — анафилактический шок, амилоидоз, реакции с образованием иммунных комплексов (тип III).
Нарушения со стороны эндокринной системы:
нечасто — синдром Иценко-Кушинга, гипертиреоз, нарушение секреции антидиуретического гормона;
редко — гипотиреоз.
Метаболические нарушения и нарушения питания:
очень часто — снижение аппетита;
часто — обезвоживание, гипокалиемия, гипонатриемия, изменение концентрации глюкозы в крови, гипокальциемия, изменение активности ферментов;
нечасто — синдром лизиса опухоли, отсутствие прибавки массы тела, гипомагниемия, гипофосфатемия, гиперкалиемия, гиперкальциемия, гипернатриемия, изменение концентрации мочевой кислоты, сахарный диабет, задержка жидкости;
редко — гипермагниемия, ацидоз, нарушение водно-электролитного баланса, избыточное накопление жидкости, гипохлоремия, гиповолемия, гиперхлоремия, гиперфосфатемия, нарушение обмена веществ, дефицит витаминов группы В, дефицит витамина В12, подагра, повышенный аппетит, непереносимость алкоголя.
Нарушения психики:
часто — расстройства и нарушения настроения, тревожность, расстройства и нарушения сна;
нечасто — изменения психического статуса, галлюцинации, психотическое расстройство, спутанность сознания, возбужденное состояние;
редко — суицидальные мысли, расстройство адаптации, делирий, снижение либидо.
Нарушения со стороны нервной системы:
очень часто — нейропатия, периферическая сенсорная нейропатия, дизестезия, невралгия;
часто — двигательная нейропатия, потеря сознания (в т.ч. обморок), головокружение, извращение вкуса, вялость, головная боль;
нечасто — тремор, периферическая сенсомоторная нейропатия, дискинезия, нарушение равновесия, потеря памяти (искл. деменцию), энцефалопатия, синдром задней обратимой энцефалопатии, нейротоксичность, судороги, постгерпетическая невралгия, расстройство речи, синдром «беспокойных ног», мигрень, ишиас, нарушение концентрации внимания, патологические рефлексы, паросмия;
редко — внутримозговое кровоизлияние, внутричерепное кровоизлияние (в т.ч. субарахноидальное), отек мозга, транзиторная ишемическая атака, кома, дисбаланс вегетативной нервной системы, вегетативная нейропатия, паралич черепных нервов, паралич, парез, предобморочное состояние, синдром поражения ствола мозга, нарушение мозгового кровообращения, корешковый синдром, психомоторная гиперактивность, компрессия спинного мозга, когнитивные расстройства, расстройства движений, расстройства нервной системы, радикулит, слюнотечение, гипотония мышц.
Нарушения со стороны органа зрения:
часто — отек глаз, нарушения зрения, конъюнктивит;
нечасто — кровоизлияние в глаз, инфекции век, воспаление глаз, диплопия, сухость глаз, раздражение глаз, боль в глазах, усиленное слезотечение, выделения из глаз;
редко — поражение роговицы, экзофтальм, ретинит, скотома, поражение глаз (в т.ч. век), дакриоаденит, светобоязнь, фотопсия, оптическая нейропатия, различные степени нарушения зрения (до слепоты).
Нарушения со стороны органа слуха и равновесия:
часто — вертиго;
нечасто — звон в ушах, нарушение слуха (до глухоты), дискомфорт в области уха; редко — кровотечение, вестибулярный нейронит, поражение уха.
Нарушения со стороны сердца:
нечасто — тампонада сердца, кардиопульмонарный шок, фибрилляция сердца (в т.ч. фибрилляция предсердий), сердечная недостаточность (в т.ч. левого и правого желудочков), аритмия, тахикардия, ощущение сердцебиения, стенокардия, перикардит (в т.ч. экссудативный перикардит), кардиомиопатия, желудочковая дисфункция, брадикардия;
редко — трепетание предсердий, инфаркт миокарда, атриовентрикулярная блокада, сердечно-сосудистые нарушения (в т.ч. кардиогенный шок), аритмия желудочковая тахисистолическая типа «пируэт», стенокардия нестабильная, заболевания клапанов сердца, коронарная недостаточность, остановка синусового узла.
Нарушения со стороны сосудистой системы:
часто — понижение артериального давления, ортостатическая гипотензия, повышение артериального давления;
нечасто — инсульт, тромбоз глубоких вен, кровотечение, тромбофлебит (в т.ч. поверхностный), циркуляторный коллапс (в т.ч. гиповолемический шок), флебит, приливы, гематома (в т.ч. периренальная), снижение периферического кровообращения, васкулит, гиперемия (в т.ч. окулярная);
редко — эмболия периферических сосудов, лимфедема, бледность, эритромелалгия, вазодилатация, изменение окраски вен, венозная недостаточность.
Нарушения со стороны дыхательной системы, грудной клетки и средостения:
часто — одышка, носовое кровотечение, инфекции верхних и нижних дыхательных путей, кашель;
нечасто — легочная эмболия, плевральный выпот, отек легких (в т.ч. острый), легочное альвеолярное кровоизлияние, бронхоспазм, хроническая обструктивная болезнь легких, гипоксемия, заложенность дыхательных путей, гипоксия, плеврит, икота, ринорея, дисфония, свистящее дыхание;
редко — дыхательная недостаточность, острый респираторный дистресс-синдром, апноэ, пневмоторакс, ателектаз, легочная гипертензия, кровохарканье, гипервентиляция, ортопноэ, пневмонит, респираторный алкалоз, тахипноэ, фиброз легких, нарушения со стороны бронхов, гипокапния, интерстициальное заболевание легких, инфильтрация легких, чувство стеснения в горле, сухость в горле, повышенная секреция в верхних дыхательных путях, раздражение горла, кашлевой синдром верхних дыхательных путей.
Нарушения со стороны желудочно-кишечного тракта:
очень часто — тошнота, рвота, диарея, запор;
часто — кровотечение из ЖКТ (в т.ч. кровотечение слизистой оболочки), диспепсия, стоматит, нарушение тонуса ЖКТ, боль в области горла и глотки, боли в области живота (в т.ч. желудочно-кишечная боль и боль в селезенке), нарушения со стороны ротовой полости, метеоризм;
нечасто — панкреатит (в т.ч. хронический), рвота кровью, отечность губ, обструкция ЖКТ (в т.ч. кишечная непроходимость), дискомфорт в животе, изъязвления слизистой оболочки полости рта, энтерит, гастрит, кровотечение из десен, гастроэзофагеальная рефлюксная болезнь, колит (в т.ч. псевдомембранозный колит), ишемический колит, воспаление слизистой оболочки ЖКТ, дисфагия, синдром раздраженного кишечника, нарушения со стороны ЖКТ, налет на языке, нарушение моторики ЖКТ, нарушения со стороны слюнных желез;
редко — острый панкреатит, перитонит, отек языка, асцит, эзофагит, хейлит, недержание кала, атония анального сфинктера, фекалома, изъязвления и перфорация желудочно-кишечного тракта, гипертрофия десен, мегаколон, выделения из прямой кишки, появление волдырей в глотке, боль в губах, периодонтит, анальная трещина, изменение ритма дефекации, прокталгия, нарушения стула.
Нарушения со стороны гепатобилиарной системы:
часто — изменение активности «печеночных» ферментов;
нечасто — гепатотоксичность (в т.ч печеночные нарушения), гепатит, холестаз;
редко — печеночная недостаточность, гепатомегалия, синдром Бадда-Киари, цитомегаловирусный гепатит, печеночное кровотечение, желчнокаменная болезнь.
Нарушения со стороны кожи и подкожной клетчатки:
часто — сыпь, зуд, эритема, сухость кожи;
нечасто — мультиформная эритема, крапивница, острый фебрильный нейтрофильный дерматоз, токсическая кожная сыпь, токсический эпидермальный некролиз, синдром Стивенса-Джонсона, дерматит, изменение структуры волос, петехия, экхимоз, поражение кожи, пурпура, новообразования кожи, псориаз, гипергидроз, ночная потливость, пролежни, угревая сыпь, волдыри, нарушение пигментации кожи;
редко — реакции со стороны кожи, лимфоцитарная инфильтрация Джесснера, ладонно-подошвенная эритродизестезия, подкожные кровотечения, сетчатое ливедо, индурация кожи, папула, реакции фоточувствительности, себорея, холодный пот, поражения кожи неуточненные, эритроз, язвы кожи, поражение ногтей.
Нарушения со стороны опорно-двигательного аппарата и соединительной ткани:
очень часто — костно-мышечные боли;
часто — мышечные спазмы, боли в конечностях, слабость мышц;
нечасто — мышечные подергивания, отеки суставов, артрит, тугоподвижность суставов, миопатия, ощущение тяжести;
редко — рабдомиолиз, синдром височно-нижнечелюстного сустава, фистула, суставной выпот, боль в челюсти, костные нарушения, инфекции и воспаление костно-мышечной и соединительной ткани, синовиальные кисты.
Нарушения со стороны почек и мочевыводящих путей:
часто — нарушение функции почек;
нечасто — острая почечная недостаточность, хроническая почечная недостаточность, инфекции мочевыводящих путей, жалобы со стороны мочевыводящих путей, гематурия, задержка мочи, нарушение мочеиспускания, протеинурия, азотемия, олигурия, поллакиурия;
редко — раздражение мочевого пузыря.
Нарушения со стороны половых органов и молочной железы:
нечасто — вагинальные кровотечения, боль в гениталиях, эректильная дисфункция;
редко — нарушение функции яичек, простатит, нарушение функции молочной железы, болезненность придатков яичек, эпидидимит, боль в области малого таза, изъязвление вульвы.
Врожденные, семейные и наследственные нарушения:
редко — аплазия, мальформация ЖКТ, ихтиоз.
Общие расстройства и нарушения, обусловленные способом применения:
очень часто — пирексия, повышенная утомляемость, астения; часто — отеки (в т.ч. периферические), озноб, боль, дискомфорт;
нечасто — ухудшение общего физического здоровья, отек лица, реакции в месте введения, нарушения со стороны слизистых оболочек, боль в области груди, нарушение походки, ощущение холода, экстравазация, осложнения от применения катетера, изменение чувства жажды, дискомфорт в области груди, ощущение изменения температуры тела, боль в месте введения;
редко — смерть (в т.ч. внезапная), полиорганная недостаточность, кровотечение в месте введения, грыжа, нарушение процессов заживления, воспаление, флебит в месте введения, болезненность, изъязвления, раздражительность, некардиальная боль в груди, боль в месте введения катетера, ощущение инородного тела.
Изменения лабораторных показателей:
часто — понижение массы тела;
нечасто — гипербилирубинемия, изменение белковых показателей, увеличение массы тела, изменение показателей крови, повышение концентрации С-реактивного белка;
редко — изменение содержания газов в крови, изменения кардиограммы (в т.ч. увеличение зубца QT), изменение протромбинового времени, понижение pH желудочного сока, увеличение агрегации тромбоцитов, повышение концентрации тропонина 1, обнаружение вирусов и изменение серологии, изменения в анализе мочи.
Травмы, отравления и осложнения процедур:
нечасто — падения, контузии;
редко — трансфузионные реакции, переломы, ригидность, травмы лица, травмы суставов, ожоги, разрывы, боль во время процедуры, радиационное поражение.
Хирургические и терапевтические процедуры:
редко — активация макрофагов.
Пациенты с мантийноклеточной лимфомой
Показатели безопасности бортезомиба у этих пациентов были сходны с соответствующими показателями у пациентов с множественной миеломой.
Значительные различия между двумя группами пациентов заключались в том, что тромбоцитопения, нейтропения, анемия, тошнота, рвота и пирексия чаще наблюдались у пациентов с множественной миеломой по сравнению с пациентами с мантийноклеточной лимфомой; а периферическая нейропатия, сыпь и зуд — у пациентов с мантийноклеточной лимфомой.
Передозировка:
Введение бортезомиба в дозе, превышающей рекомендуемую дозу более чем в 2 раза, сопровождалось острым снижением артериального давления и тромбоцитопенией со смертельным исходом.
Специфический антидот к бортезомибу не известен. При передозировке следует контролировать показатели жизненных функций пациента и температуры тела, проводить соответствующую терапию для поддержания артериального давления (инфузионная терапия, сосудосуживающие и/или инотропные препараты).
Взаимодействие:
Бортезомиб проявляет свойства слабого ингибитора изоферментов цитохрома Р450 1А2, 2С9, 2С19, 2D6 и 3А4.
Исходя из незначительного вклада изофермента CYP2D6 в метаболизм бортезомиба (7%), у людей с низкой активностью этого изофермента не ожидается изменения общего распределения препарата.
Исследование влияния лекарственного взаимодействия с мощным ингибитором изофермента CYP3A4 кетоконазолом на фармакокинетику бортезомиба показало увеличение средних значений AUC (площадь под кривой «концентрация-время») бортезомиба в среднем на 35%. Поэтому следует тщательно наблюдать за больными, получающими одновременно бортезомиб и мощный ингибитор изофермента CYP3A4 (кетоконазол, ритонавир).
В исследовании влияния лекарственного взаимодействия с мощным ингибитором изофермента CYP2C19 омепразолом на фармакокинетику бортезомиба не выявлено существенного изменения фармакокинетики бортезомиба.
Исследование влияния лекарственного взаимодействия с рифампицином — мощным индуктором изофермента CYP3A4 — на фармакокинетику бортезомиба показало снижение средних значений AUC (площадь под кривой «концентрация-время») бортезомиба в среднем на 45%. Поэтому не рекомендуется применять бортезомиб вместе с мощными индукторами CYP3A4, так как эффективность терапии может быть снижена. К индукторам CYP3A4 относятся рифампицин, карбамазепин, фенитоин, фенобарбитал и зверобой продырявленный.
В том же исследовании оценивали эффект дексаметазона — более слабого индуктора CYP3A4. Исходя из результатов исследования не выявлено существенного изменения фармакокинетики бортезомиба.
Исследование влияния лекарственного взаимодействия с комбинацией мелфалан-преднизон показало увеличение средних значений AUC (площадь под кривой «концентрация-время») бортезомиба на 17%. Это изменение считается клинически не значимым.
У больных сахарным диабетом, получавших пероральные гипогликемические препараты, зарегистрированы случаи гипогликемии и гипергликемии.
При применении бортезомиба в сочетании с препаратами, которые могут ассоциироваться с периферической нейропатией (такие как амиодарон, противовирусные средства, изониазид, нитрофурантоин или статины) и препаратами, снижающими артериальное давление, следует соблюдать осторожность.
Особые указания:
Лечение бортезомибом следует проводить только под наблюдением врача, имеющего опыт применения противоопухолевой химиотерапии.
При неумышленном введении бортезомиба интратекально зафиксированы случаи смерти. Бортезомиб показан только для внутривенного и подкожного введения. Не вводить интратекально.
До начала и во время каждого цикла терапии необходимо проводить полный анализ крови с подсчетом лейкоцитарной формулы и содержания тромбоцитов.
Тромбоцитопения/нейтропения
Терапия препаратом Бортезол может приводить к тромбоцитопении и нейтропении. Наименьшее число тромбоцитов обычно наблюдается на 11 день цикла и восстанавливается к началу следующего цикла.
Цикловая периодичность уменьшения и увеличения количества тромбоцитов наблюдалась в ходе клинических исследований у пациентов с множественной миеломой или мантийноклеточной лимфомой.
Отсутствуют данные, подтверждающие нарастающую тромбоцитопению или нейтропению при любом из режимов дозирования. При снижении количества тромбоцитов < 25000/мкл терапию бортезомибом следует приостановить. При восстановлении количества тромбоцитов лечение следует продолжить в уменьшенных дозах при тщательном сопоставлении возможной пользы и риска лечения.
Для лечения гематологической токсичности можно применять колониестимулирующие факторы, переливание тромбоцитарной и эритроцитарной массы.
При одновременном применении с мелфаланом и преднизолоном, когда количество тромбоцитов < 30000/мкл, терапию препаратом следует приостановить.
Желудочно-кишечные нарушения
С целью предотвращения тошноты и рвоты рекомендуется применение противорвотных препаратов. При возникновении диареи назначают противодиарейные лекарственные средства. Для предотвращения или лечения обезвоживания больным необходимо проводить регидратационную терапию и поддерживать водно-электролитный баланс. Сообщалось о случаях развития кишечной непроходимости (нечасто).
Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ)
Об очень редких случаях развития вирусной инфекции Джона Каннингема неизвестной этиологии, приводившей к прогрессирующей мультифокальной лейкоэнцефалопатии и к смерти, сообщалось у пациентов, принимающих препарат Бортезол. Пациенты с диагнозом ПМЛ получали иммуносупрессивную терапию до или одновременно с применением препарата Бортезол. В большинстве случаев ПМЛ была диагностирована в течение 12 месяцев с момента введения первой дозы препарата Бортезол. Пациентов необходимо наблюдать на регулярной основе на предмет возникновения или ухудшения неврологических симптомов или признаков, которые могут свидетельствовать о ПМЛ. При подозрении на ПМЛ пациента необходимо направить к специалисту в области ПМЛ и предпринять соответствующие диагностические меры. Следует прекратить применение препарата Бортезол в случае диагностирования ПМЛ.
Периферическая нейропатия
При возникновении нейропатии проводят поддерживающую терапию. Обычно частота развития периферической нейропатии достигает максимума на 5 цикле лечения бортезомибом. При появлении новых или усилении имеющихся симптомов периферической нейропатии может потребоваться снижение дозы и изменение режима введения бортезомиба.
Пациенты должны находиться под постоянным наблюдением в связи с возможностью возникновения симптомов нейропатии (ощущение жжения, гиперестезия, гипестезия, парестезия, ощущение дискомфорта, нейропатическая боль или слабость).
Частота возникновения нейропатии при подкожном введении бортезомиба ниже, чем таковая при внутривенном введении.
Отмечались случаи возникновения вегетативной нейропатии тяжелой степени, приводящие к прекращению или приостановлению терапии.
Ранний и регулярный мониторинг на наличие симптомов нейропатии с неврологической оценкой должен проводиться у пациентов, принимающих бортезомиб в комбинации с препаратами, способными вызвать нейропатию (например, талидомид). При этом рассмотреть возможность соответствующего снижения дозы или прекращения лечения.
Судороги
У больных с отсутствием судорог или эпилепсии в анамнезе описаны нечастые случаи развития судорог. При лечении больных, имеющих какие-либо факторы риска развития судорог, требуется особая осторожность.
Ортостатическая гипотензия
Терапия бортезомибом часто сопровождается ортостатической гипотензией. В большинстве случаев она бывает слабой или средней тяжести и может наблюдаться в ходе всего лечения. Редко отмечались кратковременные потери сознания. У больных, имеющих в анамнезе обмороки, диабетическую нейропатию, получающих гипотензивные препараты, а также у больных с обезвоживанием на фоне диареи или рвоты следует соблюдать осторожность. Больных следует проинструктировать о необходимости обращения к врачу в случае головокружения, чувства «легкости в голове» или обморока. При развитии ортостатической гипотензии рекомендуется гидратация, введение глюкокортикоидов и/или симпатомиметиков; при необходимости следует снизить дозу гипотензивных препаратов.
Сердечная недостаточность
При применении бортезомиба описано развитие или усиление имеющейся хронической сердечной недостаточности. К развитию признаков и симптомов сердечной недостаточности может предрасполагать задержка жидкости. Больные с факторами риска или с заболеваниями сердца в анамнезе должны подвергаться тщательному наблюдению.
Печеночная недостаточность
Описаны случаи возникновения острой печеночной недостаточности у пациентов, которые на фоне терапии бортезомибом одновременно принимали в качестве сопутствующего лечения другие препараты. Такие признаки нарушения функции печени, как увеличение активности печеночных ферментов, гипербилирубинемия или гепатит, обычно проходили при отмене бортезомиба. Данные о состоянии этих пациентов после возобновления терапии бортезомибом ограничены.
Пациентам с симптомами нарушения функции печени следует назначать бортезомиб в более низких начальных дозах и проводить мониторинг на предмет возникновения токсичности, так как бортезомиб метаболизируется печеночными ферментами и его концентрация может увеличиться при нарушении функции печени средней — тяжелой степени (см. раздел «Способ применения и дозы»).
Синдром обратимой лейкоэнцефалопатии
У пациентов, принимающих бортезомиб, отмечался обратимый лейкоэнцефалопатический синдром — редкое, обратимое неврологическое нарушение, которое может сопровождаться судорогами, повышением артериального давления, головной болью, летаргией, спутанностью сознания, слепотой и другими визуальными и неврологическими нарушениями. Для подтверждения диагноза проводится магнитно-резонансная томография головного мозга. При развитии синдрома задней обратимой энцефалопатии следует прекратить прием бортезомиба. Безопасность возобновления терапии бортезомибом после ранее выявленного синдрома задней обратимой энцефалопатии неизвестна.
Реактивация вируса Herpes zoster
Лечащим врачам следует рассмотреть возможность проведения противовирусной профилактики у пациентов, получающих терапию бортезомибом. У пациентов, получающих терапию бортезомибом, мелфаланом и преднизоном, частота реактивации вируса Herpes zoster была большей по сравнению с пациентами, получающими терапию мелфаланом и преднизоном (14% и 4%, соответственно). Проведение противовирусной профилактики достоверно снижает частоту реактивации вируса Herpes zoster.
Нарушения функции легких
В редких случаях при применении бортезомиба наблюдались острые диффузные инфильтративные легочные заболевания неизвестной этиологии, такие как пневмонит, интерстициальная пневмония, легочная инфильтрация и синдром острой дыхательной недостаточности. Некоторые из этих состояний привели к летальному исходу. В случае появления симптомов расстройства функции легких или ухудшения уже имеющихся симптомов необходимо сразу же провести диагностику и назначить пациентам соответствующее лечение.
Синдром лизиса опухоли
В связи с возможным развитием гиперурикемии, связанной с синдромом лизиса опухоли, пациентам во время терапии рекомендуется определять концентрацию мочевой кислоты и креатинина в сыворотке крови. Для предотвращения гиперурикемии рекомендуется обильное питье, при необходимости — аллопуринол и защелачивание мочи.
При применении бортезомиба у больных, одновременно принимающих пероральные гипогликемические препараты, следует тщательно контролировать уровень глюкозы в крови и при необходимости провести коррекцию дозы гипогликемических препаратов.
В период лечения любого из половых партнеров рекомендуется использовать надежные методы контрацепции.
Реакции иммунокомплексного типа
Реакции иммунокомплексного типа, такие как сывороточная болезнь, полиартрит с сыпью, пролиферативный гломерулонефрит были зарегистрированы нечасто. Следует прекратить применение бортезомиба при возникновении серьезных реакций.
Меры предосторожности при применении
При работе с бортезомибом следует соблюдать общепринятые правила обращения с цитотоксическими препаратами.
Влияние на способность управлять транспортными средствами и механизмами:
Пациентов необходимо предупредить о возможности появления во время лечения бортезомибом головокружения, обморока, зрительных расстройств и других нежелательных явлений, которые могут повлиять на способность управлять транспортными средствами. При возникновении этих симптомов пациентам рекомендуется воздержаться от управления автомобилем и занятий другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска/дозировка:
Лиофилизат для приготовления раствора для внутривенного и подкожного введения, 3,5 мг.
Упаковка:
По 3,5 мг бортезомиба во флакон бесцветного стекла (тип I) вместимостью 10 мл, укупоренный бромбутиловой пробкой и закрытый алюминиевым колпачком типа «flip-off».
По 1 флакону вместе с инструкцией по применению в картонную пачку.
По 5 флаконов с равным количеством инструкций по применению в картонную коробку (для стационаров).
Условия хранения:
В защищенном от света месте, при температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Срок годности:
2 года.
Препарат не следует использовать после истечения срока годности, указанного на упаковке.
Условия отпуска
По рецепту
Производитель
Акционерное общество «Фармасинтез-Норд» (АО «Фармасинтез-Норд»), 194356, г. Санкт-Петербург, Дорога в Каменку, д. 74, пом. 1-Н, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
АО «Фармасинтез-Норд»
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)