Фоскавир (foscarnet)
Противовирусное лекарственное средство, широкого спектра действия, назначается при таких диагнозах как вирус герпеса 1,2 и 6 типа, ВЭБ IV типа, гепатитА и В, ВИЧ, включая вирус ветряной оспы.
Категория
Foscarnet, раствор для инфузии 24 мг/мл, противовирусный препарат прямого действия.
Принцип действия
Foscarnet обладает противовирусной активностью в отношении штаммов вируса герпеса, ЦМВ, опоясывающего лишая и т.д. Его действие заключается в блокаде ДНК-полимеразы вируса. Препарат воздействует на штаммы ЦМВ, резистентные к ганцикловиру.
Показания к применению
Фоскавир назначают для индукционной и поддерживающей терапии: цитомегаловирусного ретинита у пациентов со СПИДом, инфекций простого вируса герпеса при отсутствии ответа на ацикловир у больных с ослабленным иммунитетом и т.д.
Более подробно о показаниях к применению фоскарнета можно прочесть в инструкции.
Противопоказания
Гиперчувствительность к действующему веществу или любому из компонентов.
Фоскавир не рекомендуется для лечения иных ЦМВ-инфекций, помимо ретинита, или для назначения пациентам, не страдающим от СПИДа или снижения иммунитета.
Препарат не назначают детям и пациентам, проходяшим гемодиализ.
Клинические исследования
По результатам клинических исследований Фоскавир является эффективным препаратом для лечения пациентов с вирусом ветряной оспы или вирусом простого герпеса, резистентных к ацикловиру. Лекарственное средство существенно снижает циркулирующие уровни ВИЧ антигена у больных с цитомегаловирусной инфекцией на фоне СПИДа. Также препарат эффективен при цитомегаловирусной инфекции сетчатки глаза, заживление или стабилизация поражений наблюдается у 85-95% пациентов после 2-3 недель терапии.
В результате проведенных исследований Фоскавир был зарегистрирован и успешно применяется во многих странах, включая Россию.
Способ применения
Фоскарнет вводится только внутривенно, в центральную или периферическую вену. До применения препарат разводят 5% раствором глюкозы или физраствором, затем медленно вводят в вену вашей руки или ноги.
Продолжительность лечения, дозировки и режим применения препарата зависят от вашего показания и клинического ответа.
Фоскарнет вводят каждые 2-3 недели, начиная с концентрации 60 мг/кг. Дозировку могут менять в зависимости от функции почек пациента. Продолжительность инфузии составляет не менее 1 часа.
Уточните у врача всю необходимую информацию при назначении фоскарнета натрия.
Побочные эффекты
- Гранулоцитопения, анемия, лейкопения, тромбоцитопения, нейтропения
- Снижение аппетита, гипокалиемия, гипомагниемия, гипофосфатемия, гипонатриемия, повышенный уровень щелочной фосфатазы, лактат-дегидрогеназы в крови, гиперкалиемия, обезвоживание
- Агрессия, возбужденность, чувство беспокойства, замешательство, депрессия, нервозность
- Головокружение, головная боль, парестезия
- Гипертензия, гипотензия, тромбофлебит
- Диарея, тошнота, рвота, боль в животе, запор, диспепсия, желудочно-кишечное кровотечение, панкреатит
- Нарушение функции печени
- Сыпь, зуд
- Миалгия
- Нарушение функции почек, острая почечная недостаточность, дизурия, протеинурия
- Астения, озноб, усталость, лихорадка
- Чувство недомогания, отек, боль в груди, боль в месте введения, воспаление в месте введения
- Повышенный уровень креатинина, гемоглобина, гамма-глутамилтрансферазы, аланин-аминотрансферазы, липазы, аспартат-аминотрансферазы в крови
Лечение других заболеваний
Также Фоскавир применяется по еще не одобренным показаниям, не внесенным в инструкцию, для лечения:
- Оппортунистические инфекции у пациентов с ВИЧ
- Определенные типы вируса ветряной оспы, включая прогрессирующий некроз наружного отдела сетчатки (инфекция и воспаление сетчатки глаза) и инфекции ВВО и опоясывающего лишая, резистентные к ацикловиру
- Цитомегаловирусная инфекция, включая цитомегаловирусную пневмонию (инфекция и воспаление легких) и неврологические осложнения на фоне ЦМВ-инфекции
Во время терапии
Прежде чем приобрести препарат Фоскарнет, скажите вашему врачу, если у вас низкие уровни кальция в крови, и есть необходимость контролировать потребление натрия. При таких обстоятельствах назначение фоскавира может навредить вашему здоровью.
В ходе лечения вы можете сдавать анализы крови и мочи, это выполняется для контроля функции ваших почек и уровня минералов в вашей крови.
Скажите доктору, если вы принимаете: пентамидин, амфотерицин, гентамицин, стрептомицин, ацикловир, ритонавир, циклоспорин, метотрексат или такролимус. Эти препараты могут повлиять на эффективность фоскарнета натрия.
Женщины, способные забеременеть, должны использовать эффективные методы контрацепции в ходе лечения Фоскавиром. Мужчины, принимающие препарат, должны воздержаться от зачатия ребенка в ходе лечения и в течение 6 месяцев после его окончания.
Невозможно исключить риска для новорожденного ребенка, поэтому грудное вскармливание не рекомендуется в ходе терапии Фоскавиром.
Фоскарнет может вызывать сонливость и чувство усталости, поэтому будьте внимательны при управлении автомобиля или техники, требующей пристального внимания.
Официальную инструкцию по применению фоскавира можно прочесть, перейдя по этой ссылке:
Материалы, использованные при подготовке статьи
При подготовке статьи по фоскавиру мы использовали следующие материалы:
http://www.medsafe.govt.nz/Consumers/CMI/f/Foscavir.pdf
https://www.ncbi.nlm.nih.gov/pubmed/18611671
Аналоги
В настоящее время аналогов Фоскавира не существует
Условия хранения:
Приготовленный раствор противовирусного лекарственного средства Фоскавир, следует использовать сразу же. В ином случае раствор может храниться в течение 24 часов при температуре 2-8°C, но его эффективность остается на ответственности потребителя.
Не замораживать лекарство, хранить при температуре не более 30°C.
Инструкция по применению
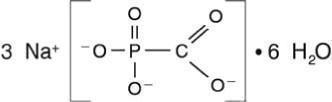
Структурная формула
Русское название
Фоскарнет натрия
Латинское название вещества Фоскарнет натрия
Natrii Foscarnetum (род. Natrii Foscarneti)
Брутто-формула
CNa3O5P
Фармакодинамика
После попадания в организм Foscarnet sodium подавляет ДНК всех видов вируса герпеса:
- Варицела-Зостер;
- цитамегаловирус;
- простой вирус.
Фармакокинетика
Foscarnet sodium выводится полностью в неизмененном виде мочевыделительной системой, что делает фоскавир токсичным для почек. Выведение половины принятой дозы Фоскарнета происходит за 8 часов, а через 3-4 суток выводится на 95 %. Малая часть вещества остается в костной ткани.
Показания
Фоскавир показан для применения при:
- герпесе I и II типа;
- Cytomegalovirus;
- ВЭБ IV типа;
- гепатите А и В;
- ВИЧ.
Среди показаний к применению также есть ветряная оспа, но на практике фоскарнет не назначается для лечения ветрянки, потому как цена лекарства не соответствует терапевтическому эффекту при патологии, которая проходит самостоятельно.
Инструкция по применению
- Фоскарнет плохо растворим в воде, поэтому перед введением его разводят в изотоническом растворе глюкозы или плазмозамещающем растворе натрия хлорида.
- Препарат эффективен только при внутривенном введении, при этом важна низкая скорость его накопления в кровяном русле, поэтому Фоскавир вводится не струйно, путем инъекции, а капельно.
Взрослым
Дозировка препарата рассчитывается исходя из массы человека. При СПИД на килограмм веса необходимо 60 мг Foscarnet sodium. Препарат вводится капельно через 8 часов. Когда промежуток между инфузиями составляет 12 часов, доза повышается до 100-120 мг на килограмм массы тела. Курс в среднем составляет около 3 недель.
При герпесе Фоскавир вводится из расчета 40 мг Foscarnet sodium на килограмм веса 3 раза в сутки 15-20 дней.
Детям, новорожденным
Новорожденным назначение препарата строго запрещено.
Курс лечения детей старше 3 лет составляет три дня, на протяжении которых Фоскавир вводится в дозе 50 мг препарат на 1 кг массы тела трехкратно в сутки. Потом, до завершения курса, длина которого определяется лечащим врачом, Фоскавир вводится единожды в день в дозе 30 мг на килограмм веса.
Противопоказания
- беременность;
- период лактации;
- аллергия к препарату;
- ХПН;
- возраст старше 65 лет.
Последнее противопоказание не является категорическим, и препарат теоретически может назначаться пожилым людям, но с достаточной степенью осторожности и под контролем врача.
Побочные действия
Учитывая тот факт, что вещество Фоскавира выводится через мочевыделительную систему, одним из главных побочных действий является нефротоксичность. На фоне приема могут возникнуть следующие признаки снижения почечной фильтрации:
- изменение диуреза на фоне обычного питьевого режима;
- изменение цвета мочи;
- отеки;
- тошнота и рвота.
Во время лечения должен обязательно вестись контроль над уровнем креатинина и мочевины. Если эти показатели становятся предельно высокими, может быть показан гемодиализ.
- Также Фоскавир оказывает негативное действие на нервную систему. На фоне терапии многие пациенты жаловались на головную боль, эмоциональную лабильность, депрессивное состояние, быструю утомляемость и снижение когнитивных функций.
- Со стороны кроветворной системы возникает анемия – снижение гемоглобина, и тромбоэмболия – высокая степень свертываемости крови. Как правило, проводимые на фоне терапии исследования быстро обнаруживают этот факт и прописывают лекарственные средства для нормализации вязкости и состава крови.
- При местном применении средства в виде крема с компонентом Foscarnet sodium может возникнуть чувство жжения и гиперемия кожи.
Особые указания
Для наибольшей эффективности начинать терапию герпеса нужно до пузырьковой стадии, тогда препарат быстро устраняет вирус и его внешние проявления на коже.
Взаимодействие с другими лекарствами и алкоголем
Фоскавир не стоит применять вместе с аналогами по механизму действия, например, с Ацикловиром. Также не стоит допускать одновременного назначения Фоскавира и лекарств из групп:
- аминогликозидами;
- амфотерицином;
- пентамидином.
Аналоги
Аналогами Фоскавира являются:
- Гефин;
- Триаптен;
- Ацикловир.
Однако по терапевтическим свойствам Фоскавир является наиболее действенным, нежели все существующие аналоги.
Препарат ФОСКАВИР (фоскарнет) / FOSCAVIR (foscarnet) купить в Москве, купить в Санкт-Петербурге и других городах России проблематично. Мы готовы помочь найти ФОСКАВИР (фоскарнет) / FOSCAVIR (foscarnet) по приемлемой цене с доставкой в кратчайшие сроки.
Перед тем как купить ФОСКАВИР (фоскарнет) / FOSCAVIR (foscarnet) обязательно проконсультируйтесь с врачом!
Где купить ФОСКАВИР (фоскарнет) / FOSCAVIR (foscarnet) по низкой цене? ФОСКАВИР (фоскарнет) / FOSCAVIR (foscarnet) инструкция по применению. ФОСКАВИР (фоскарнет) / FOSCAVIR (foscarnet) купить с доставкой в Москва
Зарезервировать
*Цена получена на основе проведённого мониторинга.
Package insert / product label
Generic name: foscarnet sodium
Dosage form: injection, solution
Drug class: Miscellaneous antivirals
J Code (medical billing code): J1455 (Per 1,000 mg, injection)
Foscavir Description
FOSCAVIR is the brand name for foscarnet sodium. The chemical name of foscarnet sodium is phosphonoformic acid, trisodium salt. Foscarnet sodium is a white, crystalline powder containing 6 equivalents of water of hydration with an empirical formula of Na3CO5P•6 H2O and a molecular weight of 300.1. The structural formula is:
FOSCAVIR has the potential to chelate divalent metal ions, such as calcium and magnesium, to form stable coordination compounds. FOSCAVIR INJECTION is a sterile, isotonic aqueous solution for intravenous administration only. The solution is clear and colorless. Each milliliter of FOSCAVIR contains 24 mg of foscarnet sodium hexahydrate in Water for Injection, USP. Hydrochloric acid may have been added to adjust the pH of the solution to 7.4. FOSCAVIR INJECTION contains no preservatives.
VIROLOGY
Mechanism of Action
Foscarnet exerts its antiviral activity by a selective inhibition at the pyrophosphate binding site on virus-specific DNA polymerases at concentrations that do not affect cellular DNA polymerases. Foscarnet does not require activation (phosphorylation) by thymidine kinase or other kinases.
Antiviral Activity in Cell Culture
The quantitative relationship between the cell culture susceptibility of human cytomegalovirus (CMV) or herpes simplex virus 1 and 2 (HSV-1 and HSV-2) to foscarnet and clinical response to therapy has not been established and virus sensitivity testing has not been standardized. Sensitivity test results, expressed as the concentration of drug required to inhibit by 50% the growth of virus in cell culture (EC50), vary greatly depending on the assay method used, cell type employed and the laboratory performing the test. A number of sensitive viruses and their EC50 values are listed below (Table 1). The combination antiviral activity of foscarnet and ganciclovir or acyclovir are not antagonistic in cell culture.
|
*Mean = 269 μM |
|
| Virus | EC50 value (μM) |
| CMV Ganciclovir resistant CMV HSV-1, HSV-2 HSV-TK negative mutant HSV-DNA polymerase mutants |
50-800* 190 10-130 67 5-443 |
Antiviral Activity in vivo
Statistically significant decreases in positive CMV cultures from blood and urine have been demonstrated in two studies (FOS-03 and ACTG-015/915) of subjects treated with FOSCAVIR. Although median time to progression of CMV retinitis was increased in subjects treated with FOSCAVIR, reductions in positive blood or urine cultures have not been shown to correlate with clinical efficacy in individual subjects (Table 2).
|
*A total of 77 subjects were treated with FOSCAVIR in two clinical trials (FOS-03 and ACTG-015/915). |
|||
|
Not all subjects had blood or urine cultures done and some subjects had results from both cultures. |
|||
|
†(60 mg/kg FOSCAVIR TID for 2–3 weeks). |
|||
| Blood | +CMV | -CMV | |
| Baseline | 27 | 34 | |
| End of Induction† | 1 | 60 | |
| Urine | +CMV | -CMV | |
| Baseline | 52 | 6 | |
| End of Induction† | 21 | 37 |
Resistance
Cell culture: CMV and HSV isolates with reduced susceptibility to foscarnet have been selected in cell culture by passage of wild type virus in the presence of increasing concentrations of the drug. All foscarnet resistant isolates are known to be generated through amino acid substitutions in the viral DNA polymerase pUL54 (CMV) or pUL30 (HSV) (Table 3).
| CMV pUL54 | T419M, T552N, S585A, F595I, Q807A, M844T/V, V946L |
| HSV-1 pUL30 | Y577H, E597D, A605V, L702H, V714M, L774F, L788M, D780N, L782I, P797T, L802F, V813M, V817M, Y818C, T821M, R842S, S889A, F891C, V892M, D907V, A910V, SRA914-916LCV, V958L, R959H |
| HSV-2 pUL30 | _ |
In vivo: Limited clinical data are available on the development of clinical resistance to foscarnet and many pathways to resistance likely exist. Substitutions documented in the literature in treated patients as associated with foscarnet resistance, are listed in Table 4.
|
Note: Many additional pathways to foscarnet resistance likely exist |
|
| CMV pUL54 | N495K, Q578H/L, D588E/N, T700A, V715M, E756D/K/Q, L773V, L776M, V781I, V787L, L802M, A809V, V812L, T813S, T821I, A834P, T838A, G841A/S, del 981-982 |
| HSV-1 pUL30 | S599L, D672N, R700G, V715G, A719T/V, S724N, E798K, G841C/S, A910T, Y941H |
| HSV-2 pUL30 | A724T, S725G, S729N, Q732R, L783M, D785N, T844I, L850I, D912V |
The possibility of viral resistance should be considered in patients who show poor clinical response or experience persistent viral excretion during therapy.
Cross-Resistance: The amino acid substitutions that resulted in reduced susceptibility to foscarnet and either ganciclovir, acyclovir and/or cidofovir are summarized in Tables 5 and 6.
| Cross-resistant to ganciclovir | CMV pUL54 | Q578H, D588N, E756K, L773V, L776M, V781I, V787L, L802M, A809V, V812L, T813S, T821I, A834P, G841A/S, del 981-982 |
| Cross-resistant to cidofovir | CMV pUL54 | Q578H, D588N, E756K, L773V, V812L, T813S, A834P, G841A, del 981-982 |
|
Cross-resistant to acyclovir |
HSV-1 pUL30 |
E597D, S599L, A605V, D672N, R700G, L702H, V714M, V715G, A719T/V, S724N, L774F, L778M, D780N, L782I, P797T, E798K, L802F, V813M, V817M, Y818C, T821M, G841C/S, R842S, S889A, F891C/Y, V892M, D907V, A910V/T, SRA914-916LCV, Y941H, V958L, V959H |
|
HSV-2 pUL30 |
A724T, S725G, S729N, Q732R, L783M, D785N, T844I, D912V |
|
|
Marginally cross-resistant to cidofovir |
HSV-1 pUL30 |
V714M, A719V, S724N, L778M, L802F, Y818C, T821M, G841S |
|
HSV-2 pUL30 |
L783M |
Foscavir — Clinical Pharmacology
Pharmacokinetics
The pharmacokinetics of foscarnet has been determined after administration as an intermittent intravenous infusion during induction therapy in AIDS patients with CMV retinitis. Observed plasma foscarnet concentrations in four studies (FOS-01, ACTG-015, FP48PK, FP49PK) are summarized in Table 7:
|
*Values expressed as mean S.D. (number of subjects studied) for each parameter |
||
|
†50 mg/kg Q8h for 28 days, samples taken 3 hrs after end of 1 hr infusion (Astra Report 815-04 AC025-1) |
||
|
‡90 mg/kg Q12hr for 28 days, samples taken 1 hr after end of 2 hr infusion (Hengge et al., 1993) |
||
| Parameter | 60 mg/kg Q8h | 90 mg/kg Q12h |
| Cmax at steady-state (μM) | 589 ± 192 (24) | 623 ± 132 (19) |
| Ctrough at steady-state (μM) | 114 ± 91 (24) | 63 ± 57 (17) |
| Volume of distribution (L/kg) | 0.41 ± 0.13 (12) | 0.52 ± 0.20 (18) |
| Plasma half-life (hr) | 4.0 ± 2.0 (24) | 3.3 ± 1.4 (18) |
| Systemic clearance (L/hr) | 6.2 ± 2.1 (24) | 7.1 ± 2.7 (18) |
| Renal clearance (L/hr) | 5.6 ± 1.9 (5) | 6.4 ± 2.5 (13) |
| CSF: plasma ratio | 0.69 ± 0.19 (9) † | 0.66 ± 0.11 (5) ‡ |
Distribution
In vitro studies have shown that 14 – 17% of foscarnet is protein bound at plasma drug concentrations of 1 – 1000 μM.
The foscarnet terminal half-life determined by urinary excretion was 87.5 ± 41.8 hours, possibly due to release of foscarnet from bone. Postmortem data on several patients in European clinical trials provide evidence that foscarnet does accumulate in bone in humans; however, the extent to which this occurs has not been determined.
Special Populations
Adults with Impaired Renal Function: The pharmacokinetic properties of foscarnet have been determined in a small group of adult subjects with normal and impaired renal function, as summarized in Table 8:
|
*Group 1 patients had normal renal function defined as a creatinine clearance (CrCl) of >80 mL/min, Group 2 CrCl was 50 – 80 mL/min, Group 3 CrCl was 25 – 49 mL/min and Group 4 CrCl was 10 – 24 mL/min. |
||||
| Parameter | Group 1 (N=6) |
Group 2 (N=6) |
Group 3 (N=6) |
Group 4 (N=4) |
| Creatinine clearance (mL/min) | 108 ± 16 | 68 ± 8 | 34 ± 9 | 20 ± 4 |
| Foscarnet CL (mL/min/kg) | 2.13 ± 0.71 | 1.33 ± 0.43 | 0.46 ± 0.14 | 0.43 ± 0.26 |
| Foscarnet half-life (hr) | 1.93 ± 0.12 | 3.35 ± 0.87 | 13.0 ± 4.05 | 25.3 ± 18.7 |
Total systemic clearance (CL) of foscarnet decreased and half-life increased with diminishing renal function (as expressed by creatinine clearance). Based on these observations, it is necessary to modify the dosage of foscarnet in patients with renal impairment (see DOSAGE AND ADMINISTRATION).
Drug Interaction
The pharmacokinetics of foscarnet and ganciclovir were not altered in 13 patients receiving either concomitant therapy or daily alternating therapy for maintenance of CMV disease.
There is no clinically significant interaction with zidovudine (AZT), or probenecid.
Clinical Studies
CMV Retinitis
A prospective, randomized, controlled clinical trial (FOS-03) was conducted in 24 patients with AIDS and CMV retinitis comparing treatment with FOSCAVIR to no treatment. Patients received induction treatment of FOSCAVIR, 60 mg/kg every 8 hours for 3 weeks, followed by maintenance treatment with 90 mg/kg/day until retinitis progression (appearance of a new lesion or advancement of the border of a posterior lesion greater than 750 microns in diameter). All diagnoses and determinations of retinitis progression were made from masked reading of retinal photographs. The 13 patients randomized to treatment with FOSCAVIR had a significant delay in progression of CMV retinitis compared to untreated controls. Median times to retinitis progression from study entry were 93 days (range 21 – >364) and 22 days (range 7 – 42), respectively.
In another prospective clinical trial of CMV retinitis in patients with AIDS (ACTG-915), 33 patients were treated with two to three weeks of FOSCAVIR induction (60 mg/kg TID) and then randomized to either 90 mg/kg/day or 120 mg/kg/day maintenance therapy. The median times from study entry to retinitis progression were not significantly different between the treatment groups, 96 (range 14 – >176) days and 140 (range 16 – >233) days, respectively.
In study ACTG 129/FGCRT SOCA study 107 patients with newly diagnosed CMV retinitis were randomized to treatment with FOSCAVIR (induction: 60 mg/kg TID for 2 weeks; maintenance: 90 mg/kg QD) and 127 were randomized to treatment with ganciclovir (induction: 5 mg/kg BID; maintenance: 5 mg/kg QD). The median time to progression on the two drugs was similar (Fos=59 and Gcv=56 days).
Relapsed CMV Retinitis
The CMV Retinitis Retreatment Trial (ACTG 228/SOCA CRRT) was a randomized, open-label comparison of FOSCAVIR or ganciclovir monotherapy to the combination of both drugs for the treatment of persistently active or relapsed CMV retinitis in patients with AIDS. Subjects were randomized to one of the three treatments: FOSCAVIR 90 mg/kg BID induction followed by 120 mg/kg QD maintenance (Fos); ganciclovir 5 mg/kg BID induction followed by 10 mg/kg QD maintenance (Gcv); or the combination of the two drugs, consisting of continuation of the subject’s current therapy and induction dosing of the other drug (as above), followed by maintenance with FOSCAVIR 90 mg/kg QD plus ganciclovir 5 mg/kg QD (Cmb). Assessment of retinitis progression was performed by masked evaluation of retinal photographs. The median times to retinitis progression or death were 39 days for the FOSCAVIR group, 61 days for the ganciclovir group and 105 days for the combination group. For the alternative endpoint of retinitis progression (censoring on death), the median times were 39 days for the FOSCAVIR group, 61 days for the ganciclovir group and 132 days for the combination group. Due to censoring on death, the latter analysis may overestimate the treatment effect. Treatment modifications due to toxicity were more common in the combination group than in the FOSCAVIR or ganciclovir monotherapy groups (see ADVERSE REACTIONS section).
Mucocutaneous Acyclovir Resistant HSV Infections
In a controlled trial, patients with AIDS and mucocutaneous, acyclovir-resistant HSV infection were randomized to either FOSCAVIR (N=8) at a dose of 40 mg/kg TID or vidarabine (N=6) at a dose of 15 mg/kg per day. Eleven patients were nonrandomly assigned to receive treatment with FOSCAVIR because of prior intolerance to vidarabine. Lesions in the eight patients randomized to FOSCAVIR healed after 11 to 25 days; seven of the 11 patients nonrandomly treated with FOSCAVIR healed their lesions in 10 to 30 days. Vidarabine was discontinued because of intolerance (N=4) or poor therapeutic response (N=2). In a second trial, forty AIDS patients and three bone marrow transplant recipients with mucocutaneous, acyclovir-resistant HSV infections were randomized to receive FOSCAVIR at a dose of either 40 mg/kg BID or 40 mg/kg TID. Fifteen of the 43 patients had healing of their lesions in 11 to 72 days with no difference in response between the two treatment groups.
Indications and Usage for Foscavir
CMV Retinitis
FOSCAVIR is indicated for the treatment of CMV retinitis in patients with acquired immunodeficiency syndrome (AIDS). Combination therapy with FOSCAVIR and ganciclovir is indicated for patients who have relapsed after monotherapy with either drug. SAFETY AND EFFICACY OF FOSCAVIR HAVE NOT BEEN ESTABLISHED FOR TREATMENT OF OTHER CMV INFECTIONS (e.g., PNEUMONITIS, GASTROENTERITIS); CONGENITAL OR NEONATAL CMV DISEASE; OR NONIMMUNOCOMPROMISED INDIVIDUALS.
Mucocutaneous Acyclovir Resistant HSV Infections
FOSCAVIR is indicated for the treatment of acyclovir-resistant mucocutaneous HSV infections in immunocompromised patients. SAFETY AND EFFICACY OF FOSCAVIR HAVE NOT BEEN ESTABLISHED FOR TREATMENT OF OTHER HSV INFECTIONS (e.g., RETINITIS, ENCEPHALITIS); CONGENITAL OR NEONATAL HSV DISEASE; OR HSV IN NONIMMUNOCOMPROMISED INDIVIDUALS.
Contraindications
FOSCAVIR is contraindicated in patients with clinically significant hypersensitivity to foscarnet sodium.
Warnings
Renal Impairment
THE MAJOR TOXICITY OF FOSCAVIR IS RENAL IMPAIRMENT (see ADVERSE REACTIONS section). Renal impairment is most likely to become clinically evident during the second week of induction therapy, but may occur at any time during FOSCAVIR treatment. Renal function should be monitored carefully during both induction and maintenance therapy (see PATIENT MONITORING section). Elevations in serum creatinine are usually, but not always, reversible following discontinuation or dose adjustment of FOSCAVIR. Safety and efficacy data for patients with baseline serum creatinine levels greater than 2.8 mg/dL or measured 24-hour creatinine clearances <50 mL/min are limited.
SINCE FOSCAVIR HAS THE POTENTIAL TO CAUSE RENAL IMPAIRMENT, DOSE ADJUSTMENT BASED ON SERUM CREATININE IS NECESSARY. Hydration may reduce the risk of nephrotoxicity. It is recommended that 750–1000 mL of normal saline or 5% dextrose solution should be given prior to the first infusion of FOSCAVIR to establish diuresis. With subsequent infusions, 750–1000 mL of hydration fluid should be given with 90-120 mg/kg of FOSCAVIR, and 500 mL with 40–60 mg/kg of FOSCAVIR. Hydration fluid may need to be decreased if clinically warranted.
After the first dose, the hydration fluid should be administered concurrently with each infusion of FOSCAVIR.
Mineral and Electrolyte Abnormalities
FOSCAVIR has been associated with changes in serum electrolytes including hypocalcemia, hypophosphatemia, hyperphosphatemia, hypomagnesemia, and hypokalemia (see ADVERSE REACTIONS section). FOSCAVIR may also be associated with a dose-related decrease in ionized serum calcium which may not be reflected in total serum calcium. This effect is likely to be related to chelation of divalent metal ions such as calcium by foscarnet. Patients should be advised to report symptoms of low ionized calcium such as perioral tingling, numbness in the extremities and paresthesias. Particular caution and careful management of serum electrolytes is advised in patients with altered calcium or other electrolyte levels before treatment and especially in those with neurologic or cardiac abnormalities and those receiving other drugs known to influence minerals and electrolytes (see PATIENT MONITORING and Drug Interactions sections). Physicians should be prepared to treat these abnormalities and their sequelae such as tetany, seizures or cardiac disturbances. The rate of FOSCAVIR infusion may also affect the decrease in ionized calcium. Therefore, an infusion pump must be used for administration to prevent rapid intravenous infusion (see DOSAGE AND ADMINISTRATION section). Slowing the infusion rate may decrease or prevent symptoms.
Seizures
Seizures related to mineral and electrolyte abnormalities have been associated with FOSCAVIR treatment (see WARNING section; Mineral and Electrolyte Abnormalities). Several cases of seizures were associated with death. Cases of status epilepticus have been reported. Risk factors associated with seizures included impaired baseline renal function, low total serum calcium, and underlying CNS conditions.
Hypersensitivity
Serious acute hypersensitivity reactions (e.g., anaphylactic shock, urticaria, angioedema) have been reported postmarketing in patients receiving FOSCAVIR (see ADVERSE REACTIONS section). If such an acute reaction occurs, therapy should be discontinued and appropriate medical therapy immediately instituted.
QT prolongation and torsade de pointes
FOSCAVIR has been associated with prolongation of the QT interval, an ECG abnormality that has been associated with torsades de pointes, which has been reported during postmarketing surveillance for FOSCAVIR (see ADVERSE REACTIONS section). Some of these patients had confounding risk factors such as underlying cardiac disease, electrolyte abnormalities and other concomitant medications.
Use with caution in patients who have a history of QT prolongation, in patients who are taking medications known to prolong the QT interval (see PRECAUTIONS section), in patients with electrolyte disturbances, or in patients who have other risk factors for QT prolongation. Electrocardiograms (ECGs) and measurement of electrolytes should be obtained prior to treatment initiation and periodically during treatment with FOSCAVIR.
Precautions
General
Care must be taken to infuse solutions containing FOSCAVIR only into veins with adequate blood flow to permit rapid dilution and distribution to avoid local irritation (see DOSAGE AND ADMINISTRATION). Local irritation and ulcerations of penile epithelium have been reported in male patients receiving FOSCAVIR, possibly related to the presence of drug in the urine. Cases of male and female genital irritation/ulceration have been reported in patients receiving FOSCAVIR. Adequate hydration with close attention to personal hygiene may minimize the occurrence of such events.
Due to the sodium content of FOSCAVIR (240 micromoles (5.5 mg) of sodium per mL), avoid FOSCAVIR use when intravenous infusion of a large amount of sodium or water may not be tolerated (e.g. in patients with cardiomyopathy). FOSCAVIR should also be avoided in patients on a controlled sodium diet.
Hematopoietic System
Anemia has been reported in 33% of patients receiving FOSCAVIR in controlled studies. Granulocytopenia has been reported in 17% of patients receiving FOSCAVIR in controlled studies; however, only 1% (2/189) were terminated from these studies because of neutropenia.
Information for Patients
CMV Retinitis: Patients should be advised that FOSCAVIR is not a cure for CMV retinitis, and that they may continue to experience progression of retinitis during or following treatment. They should be advised to have regular ophthalmologic examinations.
Mucocutaneous Acyclovir-Resistant HSV Infections: Patients should be advised that FOSCAVIR is not a cure for HSV infections. While complete healing is possible, relapse occurs in most patients. Because relapse may be due to acyclovir-sensitive HSV, sensitivity testing of the viral isolate is advised. In addition, repeated treatment with FOSCAVIR has led to the development of resistance associated with poorer response. In the case of poor therapeutic response, sensitivity testing of the viral isolate also is advised.
Effects on Ability to Drive and Use Machines: Adverse effects such as dizziness and convulsions may occur during FOSCAVIR therapy. Patients who experience seizures, dizziness, somnolence or other adverse reactions that could result in impairment, should be advised to avoid driving or operating machinery.
General: Patients should be informed that the major toxicities of foscarnet are renal impairment, electrolyte disturbances, and seizures, and that dose modifications and possibly discontinuation may be required. The importance of close monitoring while on therapy must be emphasized. Patients should be advised of the importance of reporting to their physicians symptoms of perioral tingling, numbness in the extremities or paresthesias during or after infusion as possible symptoms of electrolyte abnormalities. Patients should also be advised to promptly report any cardiac symptoms. Should such symptoms occur, the infusion of FOSCAVIR should be stopped, appropriate laboratory samples for assessment of electrolyte concentrations obtained, and a physician consulted before resuming treatment. The rate of infusion must be no more than 1 mg/kg/minute. The potential for renal impairment may be minimized by accompanying FOSCAVIR administration with hydration adequate to establish and maintain a diuresis during dosing.
Drug Interactions
A possible drug interaction of FOSCAVIR and intravenous pentamidine has been described. Concomitant treatment of four patients in the United Kingdom with FOSCAVIR and intravenous pentamidine may have caused hypocalcemia; one patient died with severe hypocalcemia. Toxicity associated with concomitant use of aerosolized pentamidine has not been reported. Because FOSCAVIR can reduce serum levels of ionized calcium, extreme caution is advised when used concurrently with other drugs known to influence serum calcium levels (e.g., intravenous pentamidine). Renal impairment and symptomatic hypocalcemia have been observed during concurrent treatment with FOSCAVIR and intravenous pentamidine.
Because of foscarnet’s tendency to cause renal impairment, the use of FOSCAVIR should be avoided in combination with potentially nephrotoxic drugs such as aminoglycosides, amphotericin B, cyclosporine, acyclovir, methotrexate, tacrolimus and intravenous pentamidine (see above) unless the potential benefits outweigh the risks to the patient.
When diuretics are indicated, thiazides are recommended over loop diuretics because the latter inhibit renal tubular secretion, and may impair elimination of FOSCAVIR, potentially leading to toxicity.
Abnormal renal function has been observed in clinical practice during the use of FOSCAVIR and ritonavir, or FOSCAVIR, ritonavir, and saquinavir. (See DOSAGE and ADMINISTRATION.)
Because of the risk of QT prolongation and the potential for torsades de pointes, the use of FOSCAVIR should be avoided in combination with agents known to prolong the QT interval including Class IA (e.g., quinidine or procainamide) or Class III (e.g., dofetilide, amiodarone, sotalol) antiarrhythmic agents, phenothiazines, tricyclic antidepressants, and certain macrolides and fluoroquinolones.
Carcinogenesis, Mutagenesis, Impairment of Fertility
Carcinogenicity studies were conducted in rats and mice at oral doses of 500 mg/kg/day and 250 mg/kg/day. Oral bioavailability in unfasted rodents is < 20%. No evidence of oncogenicity was reported at plasma drug levels equal to 1/3 and 1/5, respectively, of those in humans (at the maximum recommended human daily dose) as measured by the area-under-the-time/concentration curve (AUC).
FOSCAVIR showed genotoxic effects in the BALB/3T3 in vitro transformation assay at concentrations greater than 0.5 mcg/mL and an increased frequency of chromosome aberrations in the sister chromatid exchange assay at 1000 mcg/mL. A high dose of foscarnet (350 mg/kg) caused an increase in micronucleated polychromatic erythrocytes in vivo in mice at doses that produced exposures (area under curve) comparable to that anticipated clinically.
Pregnancy
There are no adequate and well-controlled studies of FOSCAVIR in pregnant women. Because animal reproduction studies are not always predictive of human response, this drug should be used during pregnancy only if clearly needed.
Animal Data: FOSCAVIR did not adversely affect fertility and general reproductive performance in rats. The results of peri- and post-natal studies in rats were also negative. However, these studies used exposures that are inadequate to define the potential for impairment of fertility at human drug exposure levels.
Daily subcutaneous doses up to 75 mg/kg administered to female rats prior to and during mating, during gestation, and 21 days post-partum caused a slight increase (< 5%) in the number of skeletal anomalies compared with the control group. Daily subcutaneous doses up to 75 mg/kg administered to rabbits and 150 mg/kg administered to rats during gestation caused an increase in the frequency of skeletal anomalies/variations. On the basis of estimated drug exposure (as measured by AUC), the 150 mg/kg dose in rats and 75 mg/kg dose in rabbits were approximately one-eighth (rat) and one-third (rabbit) the estimated maximal daily human exposure. These studies are inadequate to define the potential teratogenicity at levels to which women will be exposed.
Nursing Mothers
It is not known whether FOSCAVIR is excreted in human milk; however, in lactating rats administered 75 mg/kg, FOSCAVIR was excreted in maternal milk at concentrations three times higher than peak maternal blood concentrations. Because of the potential for serious adverse events in nursing infants, a decision should be made whether to discontinue nursing or discontinue drug, taking into consideration the importance of the drug to the mother. The Centers for Disease Control and Prevention recommend that HIV-infected mothers not breast-feed their infants to avoid risking postnatal transmission of HIV.
Pediatric Use
The safety and effectiveness of FOSCAVIR in pediatric patients have not been established. FOSCAVIR is deposited in teeth and bone and deposition is greater in young and growing animals. FOSCAVIR has been demonstrated to adversely affect development of tooth enamel in mice and rats. The effects of this deposition on skeletal development have not been studied.
Since deposition in human bone has also been shown to occur, it is likely that it does so to a greater degree in developing bone in pediatric patients. Administration to pediatric patients should be undertaken only after careful evaluation and only if the potential benefits for treatment outweigh the risks.
Geriatric Use
No studies of the efficacy or safety of FOSCAVIR in persons 65 years of age or older have been conducted. However, FOSCAVIR has been used in patients age 65 years of age and older. The pattern of adverse events seen in these patients is consistent across all age groups. This drug is known to be substantially excreted by the kidney, and the risk of toxic reactions to this drug may be greater in patients with impaired renal function. Because elderly patients are more likely to have decreased renal function, care should be taken in dose selection, and renal function should be monitored. (See DOSAGE AND ADMINISTRATION).
Adverse Reactions/Side Effects
THE MAJOR TOXICITY OF FOSCAVIR IS RENAL IMPAIRMENT (see WARNINGS section). Approximately 33% of 189 patients with AIDS and CMV retinitis who received FOSCAVIR (60 mg/kg TID), without adequate hydration, developed significant impairment of renal function (serum creatinine ≥ 2.0 mg/dL). The incidence of renal impairment in subsequent clinical trials in which 1000 mL of normal saline or 5% dextrose solution was given with each infusion of FOSCAVIR was 12% (34/280).
FOSCAVIR has been associated with changes in serum electrolytes including hypocalcemia (15–30%), hypophosphatemia (8–26%) and hyperphosphatemia (6%), hypomagnesemia (15–30%), and hypokalemia (16–48%) (see WARNINGS section). The higher percentages were derived from those patients receiving hydration.
FOSCAVIR treatment was associated with seizures in 18/189 (10%) AIDS patients in the initial five controlled studies (see WARNINGS section). Risk factors associated with seizures included impaired baseline renal function, low total serum calcium, and underlying CNS conditions predisposing the patient to seizures. The rate of seizures did not increase with duration of treatment. Three cases were associated with overdoses of FOSCAVIR (see OVERDOSAGE section).
In five controlled U.S. clinical trials the most frequently reported adverse events in patients with AIDS and CMV retinitis are shown in Table 9. These figures were calculated without reference to drug relationship or severity.
| n = 189 | n = 189 | ||
| Fever | 65% | Abnormal Renal Function | 27% |
| Nausea | 47% | Vomiting | 26% |
| Anemia | 33% | Headache | 26% |
| Diarrhea | 30% | Seizures | 10% |
From the same controlled studies, adverse events categorized by investigator as “severe” are shown in Table 10. Although death was specifically attributed to FOSCAVIR in only one case, other complications of FOSCAVIR (i.e., renal impairment, electrolyte abnormalities, and seizures) may have contributed to patient deaths (see WARNINGS section).
| n = 189 | |
| Death | 14% |
| Abnormal Renal Function | 14% |
| Marrow Suppression | 10% |
| Anemia | 9% |
| Seizures | 7% |
From the five initial U.S. controlled trials of FOSCAVIR, the following list of adverse events has been compiled regardless of causal relationship to FOSCAVIR. Evaluation of these reports was difficult because of the diverse manifestations of the underlying disease and because most patients received numerous concomitant medications.
Incidence of 5% or Greater
Body as a Whole: fever, fatigue, rigors, asthenia, malaise, pain, infection, sepsis, death
Central and Peripheral Nervous System: headache, paresthesia, dizziness, involuntary muscle contractions, hypoesthesia, neuropathy, seizures including grand mal seizures (see WARNINGS)
Gastrointestinal System: anorexia, nausea, diarrhea, vomiting, abdominal pain
Hematologic: anemia, granulocytopenia, leukopenia, neutropenia (see PRECAUTIONS)
Metabolic and Nutritional: mineral and electrolyte imbalances (see WARNINGS) including hypokalemia, hypocalcemia, hypomagnesemia, hypophosphatemia, hyperphosphatemia
Psychiatric: depression, confusion, anxiety
Respiratory System: coughing, dyspnea
Skin and Appendages: rash, increased sweating
Urinary System: alterations in renal function including increased serum creatinine, decreased creatinine clearance, and abnormal renal function (see WARNINGS)
Special Senses: vision abnormalities
Incidence between 1% and 5%
Application Site: injection site pain, injection site inflammation
Body as a Whole: back pain, chest pain (including reports of transient chest pain as part of infusion reactions), edema, influenza-like symptoms, bacterial infections, moniliasis, fungal infections, abscess
Cardiovascular: hypertension, palpitations, ECG abnormalities including sinus tachycardia, first degree AV block and non-specific ST-T segment changes, hypotension, flushing, cerebrovascular disorder (see WARNINGS)
Central and Peripheral Nervous System: tremor, ataxia, dementia, stupor, generalized spasms, sensory disturbances, meningitis, aphasia, abnormal coordination, leg cramps, EEG abnormalities (see WARNINGS)
Gastrointestinal: constipation, dysphagia, dyspepsia, rectal hemorrhage, dry mouth, melena, flatulence, ulcerative stomatitis, pancreatitis
Hematologic: thrombocytopenia, platelet abnormalities, thrombosis, white blood cell abnormalities, lymphadenopathy
Liver and Biliary: abnormal A-G ratio, abnormal hepatic function, increased SGPT, increased SGOT
Metabolic and Nutritional: hyponatremia, decreased weight, increased alkaline phosphatase, increased LDH, increased BUN, acidosis, cachexia, thirst
Musculo-Skeletal: arthralgia, myalgia
Neoplasms: lymphoma-like disorder, sarcoma
Psychiatric: insomnia, somnolence, nervousness, amnesia, agitation, aggressive reaction, hallucination
Respiratory System: pneumonia, sinusitis, pharyngitis, rhinitis, respiratory disorders, respiratory insufficiency, pulmonary infiltration, stridor, pneumothorax, hemoptysis, bronchospasm
Skin and Appendages: pruritus, skin ulceration, seborrhea, erythematous rash, maculo-papular rash, skin discoloration
Special Senses: taste perversions, eye abnormalities, eye pain, conjunctivitis
Urinary System: albuminuria, dysuria, polyuria, urethral disorder, urinary retention, urinary tract infections, acute renal failure, nocturia, facial edema
Selected adverse events occurring at a rate of less than 1% in the five initial U.S. controlled clinical trials of FOSCAVIR include: syndrome of inappropriate antidiuretic hormone secretion, pancytopenia, hematuria, dehydration, hypoproteinemia, increases in amylase and creatinine phosphokinase, cardiac arrest, coma, and other cardiovascular and neurologic complications.
Selected adverse event data from the Foscarnet vs. Ganciclovir CMV Retinitis Trial (FGCRT), performed by the Studies of the Ocular Complications of AIDS (SOCA) Research Group, are shown in Table 11 (see CLINICAL TRIALS section).
|
* Values for the treatment groups refer only to patients who completed at least one follow-up visit – i.e., 133 to 119 patients in the ganciclovir group and 93 to 100 in the foscarnet group. “Events” denotes all events observed and “patients” the number of patients with one or more of the indicated events. |
||||||
|
†Per person-year at risk |
||||||
|
‡Final frozen SOCA I database dated October 1991 |
||||||
| EVENT | GANCICLOVIR | FOSCARNET | ||||
| No. of Events |
No. of Patients | Rates† | No. of Events |
No. of Patients | Rates† | |
| Absolute neutrophil count decreasing to <0.50 x 109 per liter | 63 | 41 | 1.30 | 31 | 17 | 0.72 |
| Serum creatinine increasing to >260 μmol per liter (>2.9 mg/dL) | 6 | 4 | 0.12 | 13 | 9 | 0.30 |
| Seizure ‡ | 21 | 13 | 0.37 | 19 | 13 | 0.37 |
| Catheterization-related infection | 49 | 27 | 1.26 | 51 | 28 | 1.46 |
| Hospitalization | 209 | 91 | 4.74 | 202 | 75 | 5.03 |
Selected adverse events from ACTG Study 228 (CRRT) comparing combination therapy with FOSCAVIR or ganciclovir monotherapy are shown in Table 12. The most common reason for a treatment change in patients assigned to either FOSCAVIR or ganciclovir was retinitis progression. The most frequent reason for a treatment change in the combination treatment group was toxicity.
|
* Pts. = patients with event; †Rate = events/person/year; ‡ANC = absolute neutrophil count |
|||||||||
| Foscavir N=88 |
Ganciclovir N=93 |
Combination N=93 |
|||||||
| No. Events | No. Pts.* | Rate† | No. Events | No. Pts.* | Rate† | No. Events | No. Pts.* | Rate† | |
| Anemia (Hgb <70g/L) | 11 | 7 | 0.20 | 9 | 7 | 0.14 | 19 | 15 | 0.33 |
| Neutropenia‡ ANC <0.75 x 109 cells/L ANC <0.50 x 109 cells/L |
86 50 |
32 25 |
1.53 0.91 |
95 49 |
41 28 |
1.51 0.80 |
107 50 |
51 28 |
1.91 0.85 |
| Thrombocytopenia Platelets <50 x 109/L Platelets <20 x 109/L |
28 1 |
14 1 |
0.50 0.01 |
19 6 |
8 2 |
0.43 0.05 |
40 7 |
15 6 |
0.56 0.18 |
| Nephrotoxicity Creatinine >260 μmol/L (>2.9 mg/dL) |
9 |
7 |
0.15 |
10 |
7 |
0.17 |
11 |
10 |
0.20 |
| Seizures | 6 | 6 | 0.17 | 7 | 6 | 0.15 | 10 | 5 | 0.18 |
| Hospitalizations | 86 | 53 | 1.86 | 111 | 59 | 2.36 | 118 | 64 | 2.36 |
Adverse events that have been reported in post-marketing surveillance include: administration site extravasation, localized edema, hypersensitivity reactions (including anaphylactic shock, urticaria and angioedema) (see WARNINGS section), gastrointestinal hemorrhage, increased lipase, glomerulonephritis, nephrotic syndrome, proteinuria, status epilepticus, ventricular arrhythmia, prolongation of QT interval, torsade de pointes (see WARNINGS section), gamma GT increased, diabetes insipidus (usually nephrogenic), renal calculus, Fanconi syndrome acquired, renal tubular acidosis, renal tubular necrosis, crystal-induced nephropathy, hypercalcemia, hypernatremia, esophageal ulceration and muscle disorders including myopathy, myositis, muscle weakness and rare cases of rhabdomyolysis. Cases of vesiculobullous eruptions including erythema multiforme, toxic epidermal necrolysis, and Stevens-Johnson syndrome have been reported. In most cases, patients were taking other medications that have been associated with toxic epidermal necrolysis or Stevens-Johnson syndrome.
Overdosage
In controlled clinical trials performed in the United States, overdosage with FOSCAVIR was reported in 10 out of 189 patients. All 10 patients experienced adverse events and all except one made a complete recovery. One patient died after receiving a total daily dose of 12.5 g for three days instead of the intended 10.9 g. The patient suffered a grand mal seizure and became comatose. Three days later the patient expired with the cause of death listed as respiratory/cardiac arrest. The other nine patients received doses ranging from 1.14 times to 8 times their recommended doses with an average of 4 times their recommended doses. Overall, three patients had seizures, three patients had renal function impairment, four patients had paresthesias either in limbs or periorally, and five patients had documented electrolyte disturbances primarily involving calcium and phosphate.
Overdose (up to 20 times the recommended dose) has been reported in post-marketing use of FOSCAVIR. Some of these post-marketing reports were relative overdoses in that the dose of FOSCAVIR had not been adjusted in patients with a reduced renal function. The pattern of adverse events associated with a FOSCAVIR overdose is consistent with the known adverse event profile of the drug.
There is no specific antidote for FOSCAVIR overdose. Hemodialysis and hydration may be of benefit in reducing drug plasma levels in patients who receive an overdosage of FOSCAVIR, but the effectiveness of these interventions has not been evaluated. The patient should be observed for signs and symptoms of renal impairment and electrolyte imbalance. Medical treatment should be instituted if clinically warranted.
Foscavir Dosage and Administration
CAUTION — DO NOT ADMINISTER FOSCAVIR BY RAPID OR BOLUS INTRAVENOUS INJECTION. THE TOXICITY OF FOSCAVIR MAY BE INCREASED AS A RESULT OF EXCESSIVE PLASMA LEVELS. CARE SHOULD BE TAKEN TO AVOID UNINTENTIONAL OVERDOSE BY CAREFULLY CONTROLLING THE RATE OF INFUSION. THEREFORE, AN INFUSION PUMP MUST BE USED. IN SPITE OF THE USE OF AN INFUSION PUMP, OVERDOSES HAVE OCCURRED.
ADMINISTRATION
Instructions for Administration and Preparation
FOSCAVIR is administered by controlled intravenous infusion, either by using a central venous line or by using a peripheral vein. The rate of infusion must be no more than 1 mg/kg/minute. An individualized dose of FOSCAVIR should be calculated on the basis of body weight (mg/kg), renal function, indication of use and dosing frequency (refer to DOSAGE subsection). To reduce the risk of nephrotoxicity, creatinine clearance (mL/min/kg) should be calculated even if serum creatinine is within the normal range, and doses should be adjusted accordingly.
An individualized dose at the required concentration (24 mg/mL or 12 mg/mL) for the route of administration (central line or peripheral line) needs to be aseptically prepared prior to dispensing. The standard 24 mg/mL solution may be used with or without dilution when using a central venous catheter for infusion. When a peripheral vein catheter is used, the 24 mg/mL injection must be diluted to a 12 mg/mL concentration with 5% dextrose in water or with a normal saline solution prior to administration to avoid local irritation of peripheral veins. Dilutions and/or removals of excess quantities should be accomplished under aseptic conditions. Solutions thus prepared should be used within 24 hours of first entry into a sealed bottle or infusion bag.
Hydration
Hydration may reduce the risk of nephrotoxicity. Clinically dehydrated patients should have their condition corrected before initiating FOSCAVIR therapy. It is recommended that 750–1000 mL of normal saline or 5% dextrose solution should be given prior to the first infusion of FOSCAVIR to establish diuresis. With subsequent infusions, 750–1000 mL of hydration fluid should be given with 90–120 mg/kg of FOSCAVIR, and 500 mL with 40–60 mg/kg of FOSCAVIR. Hydration fluid may need to be decreased if clinically warranted. Oral rehydration with similar regimens may be considered in certain patients.
After the first dose, the hydration fluid should be administered concurrently with each infusion of FOSCAVIR.
Compatibility With Other Solutions/Drugs
Other drugs and supplements can be administered to a patient receiving FOSCAVIR. However, care must be taken to ensure that FOSCAVIR is only administered with normal saline or 5% dextrose solution and that no other drug or supplement is administered concurrently via the same catheter. Foscarnet has been reported to be chemically incompatible with 30% dextrose, amphotericin B, and solutions containing calcium such as Ringer’s lactate and TPN. Physical incompatibility with other IV drugs has also been reported including acyclovir sodium, ganciclovir, trimetrexate glucuronate, pentamidine isethionate, vancomycin, trimethoprim/sulfamethoxazole, diazepam, midazolam, digoxin, phenytoin, leucovorin, and proclorperazine. Because of foscarnet’s chelating properties, a precipitate can potentially occur when divalent cations are administered concurrently in the same catheter.
Parenteral drug products must be inspected visually for particulate matter and discoloration prior to administration whenever the solution and container permit. Solutions that are discolored or contain particulate matter should not be used.
Accidental Exposure
Accidental skin and eye contact with foscarnet sodium solution may cause local irritation and burning sensation. If accidental contact occurs, the exposed area should be flushed with water.
DOSAGE
THE RECOMMENDED DOSAGE, FREQUENCY, OR INFUSION RATES SHOULD NOT BE EXCEEDED. ALL DOSES MUST BE INDIVIDUALIZED FOR PATIENTS’ RENAL FUNCTION.
Induction Treatment
The recommended initial dose of FOSCAVIR for patients with normal renal function is:
- For CMV retinitis patients, either 90 mg/kg (1-1/2 to 2 hour infusion) every twelve hours or 60 mg/kg (minimum one hour infusion) every eight hours over 2-3 weeks depending on clinical response.
- For acyclovir-resistant HSV patients, 40 mg/kg (minimum one hour infusion) either every 8 or 12 hours for 2-3 weeks or until healed.
An infusion pump must be used to control the rate of infusion. Adequate hydration is recommended to establish a diuresis (see Hydration for recommendation), both prior to and during treatment to minimize renal toxicity (see WARNINGS), provided there are no clinical contraindications.
Maintenance Treatment
Following induction treatment the recommended maintenance dose of FOSCAVIR for CMV retinitis is 90 mg/kg/day to 120 mg/kg/day (individualized for renal function) given as an intravenous infusion over 2 hours. Because the superiority of the 120 mg/kg/day has not been established in controlled trials, and given the likely relationship of higher plasma foscarnet levels to toxicity, it is recommended that most patients be started on maintenance treatment with a dose of 90 mg/kg/day. Escalation to 120 mg/kg/day may be considered should early reinduction be required because of retinitis progression. Some patients who show excellent tolerance to FOSCAVIR may benefit from initiation of maintenance treatment at 120 mg/kg/day earlier in their treatment.
An infusion pump must be used to control the rate of infusion with all doses. Again, hydration to establish diuresis both prior to and during treatment is recommended to minimize renal toxicity, provided there are no clinical contraindications (see WARNINGS).
Patients who experience progression of retinitis while receiving FOSCAVIR maintenance therapy may be retreated with the induction and maintenance regimens given above or with a combination of FOSCAVIR and ganciclovir (see CLINICAL TRIALS section). Because of physical incompatibility, FOSCAVIR and ganciclovir must NOT be mixed.
Use in Patients with Abnormal Renal Function
FOSCAVIR should be used with caution in patients with abnormal renal function because reduced plasma clearance of foscarnet will result in elevated plasma levels (see CLINICAL PHARMACOLOGY). In addition, FOSCAVIR has the potential to further impair renal function (see WARNINGS). Safety and efficacy data for patients with baseline serum creatinine levels greater than 2.8 mg/dL or measured 24-hour creatinine clearances < 50 mL/min are limited.
Renal function must be monitored carefully at baseline and during induction and maintenance therapy with appropriate dose adjustments for FOSCAVIR as outlined below (see Dose Adjustment and PATIENT MONITORING). During FOSCAVIR therapy if creatinine clearance falls below the limits of the dosing nomograms (0.4 mL/min/kg), FOSCAVIR should be discontinued, the patient hydrated, and monitored daily until resolution of renal impairment is ensured.
FOSCAVIR is not recommended in patients undergoing hemodialysis because dosage guidelines have not been established.
Dose Adjustment
FOSCAVIR dosing must be individualized according to the patient’s renal function status. Refer to Table 13 below for recommended doses and adjust the dose as indicated. Even patients with serum creatinine in the normal range may require dose adjustment; therefore, the dose should be calculated at baseline and frequently thereafter.
To use this dosing guide, actual 24-hour creatinine clearance (mL/min) must be divided by body weight (kg), or the estimated creatinine clearance in mL/min/kg can be calculated from serum creatinine (mg/dL) using the following formula (modified Cockcroft and Gault equation):
For males: 140 – age (x 0.85 for females) = mL/min/kg
Serum creatinine x 72
| HSV: Equivalent to | CMV: Equivalent to | |||
| CrCI (mL/min/kg) |
80 mg/kg/day total (40 mg/kg Q12h) |
120 mg/kg/day total (40 mg/kg Q8h) |
180 mg/kg/day total | |
| (60 mg/kg Q8h) | (90 mg/kg Q12h) | |||
| >1.4 | 40 Q12h | 40 Q8h | 60 Q8h | 90 Q12h |
| >1.0 – 1.4 | 30 Q12h | 30 Q8h | 45 Q8h | 70 Q12h |
| >0.8 – 1.0 | 20 Q12h | 35 Q12h | 50 Q12h | 50 Q12h |
| >0.6 – 0.8 | 35 Q24h | 25 Q12h | 40 Q12h | 80 Q24h |
| >0.5 – 0.6 | 25 Q24h | 40 Q24h | 60 Q24h | 60 Q24h |
| >0.4 – 0.5 | 20 Q24h | 35 Q24h | 50 Q24h | 50 Q24h |
| <0.4 | Not recommended | Not recommended | Not recommended | Not recommended |
|
*> means “greater than”, †≥ means “greater than or equal to”, ‡< means “less than” |
||
| CMV: Equivalent to | ||
| CrCI (mL/min/kg) |
90 mg/kg/day (once daily) |
120 mg/kg/day (once daily) |
| >*1.4 | 90 Q24h | 120 Q24h |
| >*1.0 – 1.4 | 70 Q24h | 90 Q24h |
| >*0.8 – 1.0 | 50 Q24h | 65 Q24h |
| >*0.6 – 0.8 | 80 Q48h | 105 Q48h |
| >*0.5 – 0.6 | 60 Q48h | 80 Q48h |
| ≥†0.4 – 0.5 | 50 Q48h | 65 Q48h |
| <‡0.4 | Not recommended | Not recommended |
PATIENT MONITORING
The majority of patients will experience some decrease in renal function due to FOSCAVIR administration. Therefore it is recommended that creatinine clearance, either measured or estimated using the modified Cockcroft and Gault equation based on serum creatinine, be determined at baseline, 2–3 times per week during induction therapy and once weekly during maintenance therapy, with FOSCAVIR dose adjusted accordingly (see Dose Adjustment). More frequent monitoring may be required for some patients. It is also recommended that a 24-hour creatinine clearance be determined at baseline and periodically thereafter to ensure correct dosing (assuming verification of an adequate collection using creatinine index). FOSCAVIR should be discontinued if creatinine clearance drops below 0.4 mL/min/kg.
Due to FOSCAVIR’s propensity to chelate divalent metal ions and alter levels of serum electrolytes, patients must be monitored closely for such changes. It is recommended that a schedule similar to that recommended for serum creatinine (see above) be used to monitor serum calcium, magnesium, potassium and phosphorus. Particular caution is advised in patients with decreased total serum calcium or other electrolyte levels before treatment, as well as in patients with neurologic or cardiac abnormalities, and in patients receiving other drugs known to influence serum calcium levels. Any clinically significant metabolic changes should be corrected. Also, patients who experience mild (e.g., perioral numbness or paresthesias) or severe (e.g., seizures) symptoms of electrolyte abnormalities should have serum electrolyte and mineral levels assessed as close in time to the event as possible.
Careful monitoring and appropriate management of electrolytes, calcium, magnesium and creatinine are of particular importance in patients with conditions that may predispose them to seizures (see WARNINGS).
How is Foscavir supplied
FOSCAVIR (foscarnet sodium) INJECTION, 24 mg/mL for intravenous infusion, is supplied in 250 mL glass bottles or polypropylene based infusion bags containing 6000 mg foscarnet sodium (24 mg/mL) as follows:
NDC 76310-024-11 250 mL bottle
NDC 76310-024-01 250 mL bottles, cases of 10
NDC 76310-024-31 250 mL infusion bag
NDC 76310-024-35 250 mL infusion bag, cases of 10
Single-dose. Discard unused portion.
Store between 20° and 25°C (68° and 77°F) [See USP Controlled Room Temperature]. Protect from excessive heat (above 40°C) and from freezing. If refrigerated or exposed to temperatures below the freezing point, precipitation may occur. By keeping the bottle or infusion bag at room temperature with repeated shaking, the precipitate can be brought into solution again.
FOSCAVIR INJECTION should be used only if the bottle or infusion bag and its seal(s) are intact, a vacuum is present, and the solution is clear and colorless. Do not remove the infusion bag from the overwrap until ready for use.
Manufactured for:
Clinigen Healthcare Ltd., DE14 2WW, UK
Distributed by: Hospira, Inc., Lake Forest, IL 60045 USA
FOSCAVIR is a trademark of Clinigen Healthcare Ltd.
Date of revision: October 2020
Novaplus is a registered trademark of Vizient, Inc.
BOTTLE LABEL – PRINCIPAL DISPLAY PANEL
NDC 76310-024-11
Foscavir ® (foscarnet sodium) injection
6000 mg/250 mL (24 mg/mL)
For Central Intravenous Infusion Only
Must Be Diluted for Peripheral Intravenous Infusion
Rx only
Single-dose. Discard unused portion.
Mfd. for: Clinigen Healthcare Ltd., DE14 2WW, UK.
Distributed by: Hospira Inc., Lake Forest, IL 60045 USA.
(Clinigen and Novaplus logos)
Novaplus is a registered trademark of Vizient, Inc.
INNER CARTON LABEL – PRINCIPAL DISPLAY PANEL
NDC 76310-024-11 Rx only
Foscavir ®
(foscarnet sodium)
injection
6000 mg/250 mL
(24 mg/mL)
For Central Intravenous Infusion Only
Must Be Diluted for Peripheral
Intravenous Infusion
Single-dose. Discard unused portion.
Медицинский туризм в Германии
Медицинский туризм сегодня очень популярен, так как не привязывает вас к месту проживания и дает возможность выбрать лечение в той стране, которая к этому наиболее предрасположена. Германия считается лидером в этой сфера из-за огромного количества клиник, рабоотающих в тесной связке с передовыми медицинскими лабораториями. Тем самым препараты попадают к пациентам в кратчайшие сроки, а врачи не только поддерживают, но и повышают свою квалификацию!
Компания Apteka-German с радостью поможет вам в выборе города, клиники и лечующих врачей в Германии. Мы работает уже более 3-х лет, и через нас прошла не одна сотня клиентов, из которых никто не возвращался недовольным.
Фоскавир показан для применения при:
- герпесе I и II типа;
- Cytomegalovirus;
- ВЭБ IV типа;
- гепатите А и В;
- ВИЧ.
Среди показаний к применению также есть ветряная оспа, но на практике фоскарнет(фоскавир) не назначается для лечения ветрянки, потому как цена лекарства не соответствует терапевтическому эффекту при патологии, которая проходит самостоятельно.
Противопоказания
Фоскарнет(фоскавир) натрия не назначается лечащим врачом пациенту, если в его анамнезе обнаружены факты:
- беременность;
- период лактации;
- аллергия к препарату;
- ХПН;
- возраст старше 65 лет.
Последнее противопоказание не является категорическим, и препарат теоретически может назначаться пожилым людям, но с достаточной степенью осторожности и под контролем врача.
Побочные эффекты
- изменение диуреза на фоне обычного питьевого режима;
- изменение цвета мочи;
- отеки;
- тошнота и рвота.
Также Фоскавир оказывает негативное действие на нервную систему. На фоне терапии многие пациенты жаловались на головную боль, эмоциональную лабильность, депрессивное состояние, быструю утомляемость и снижение когнитивных функций.
Со стороны кроветворной системы возникает анемия – снижение гемоглобина, и тромбоэмболия – высокая степень свертываемости крови. Как правило, проводимые на фоне терапии исследования быстро обнаруживают этот факт и прописывают лекарственные средства для нормализации вязкости и состава крови.
При местном применении средства в виде крема с компонентом Foscarnet sodium может возникнуть чувство жжения и гиперемия кожи.
Особые указания
Для наибольшей эффективности начинать терапию герпеса нужно до пузырьковой стадии, тогда препарат быстро устраняет вирус и его внешние проявления на коже.
Герпес — инфекционное заболевание, которое быстро передаётся при контакте с больным и через его предметы, вызывая периодические высыпания на коже. Для борьбы с симптомами используют противовирусные средства: для наружного применения и в таблетках.
Скрытая вирусная угроза
Любой вид герпеса возникает из-за вируса, который надолго поселяется в организме человека и время от времени даёт о себе знать болезненными пузырьками на коже и слизистых. Иногда инфекция поражает даже глаза и центральную нервную систему; рецидивы возникают от стрессов, переутомления и при снижении иммунитета.
К сожалению, навсегда вылечить болезнь не получится из-за надёжного укрытия возбудителя в нервных клетках. Современные средства могут только ослабить симптомы и сделать так, чтобы их неприятный эффект прошёл как можно быстрее.
Виды герпеса
Бывает герпес 8 типов, хотя наибольшее значение имеют первые 6. В зависимости от разновидности вируса меняется и способ борьбы. Большинство стандартных препаратов активны по отношению к вирусам первого и второго типов.
- Вирус герпеса первого типа обычно проявляется на губах, но иногда поражает нос и слизистую рта.
- Второй тип даёт о себе знать на половых органах и временами переносится в ротовую полость.
- К третьему варианту относят ветряную оспу: реактивация вируса становится опоясывающим лишаем.
- Четвёртый — вирус Эпштейна-Барр. У детей он может проявляться в виде инфекции дыхательных путей: иногда с ангиной, температурой и увеличением лимфатических узлов. У подростков и взрослых развивается инфекционный мононуклеоз.
- Цитомегаловирус относится к пятому типу. Симптомы похожи на заражение предыдущей формой герпеса.
- Представитель шестого типа — внезапная экзантема.
Вид герпеса помогает установить анализ. Чаще всего в его ходе исследуется кровь на антитела. Впрочем, из-за распространения вирусов типов 1 и 2 больных обычно интересует не возбудитель, а способ убрать высыпания как можно скорее.
Выбор способа лечения и препаратов
Пусть народные средства для избавления от герпеса всё ещё в ходу, проверенные препараты имеют больше шансов улучшить состояние больного. Особенно часто лечения требует первичное проявление болезни или возникновение герпеса у ослабленного пациента: например, при иммунодефиците.
В идеале лечение герпеса должно быть комплексным: важно не только бороться с вирусом, но и поддерживать защитные силы организма.
Противовирусные средства в целом работают сходно: они так или иначе мешают возбудителю размножаться и заражать другие клетки. К примеру, ацикловир в организме превращается в 3-фосфат, который встраивается в ДНК для новых частиц и вызывает обрыв её цепи, останавливая строительство дополнительных единиц вируса. Выбор лекарственной формы зависит только от тяжести симптомов.
- Мазь работает только на месте нанесения. Она почти не всасывается и не создаёт нежелательные эффекты для внутренних органов.
- Таблетки должны оказаться в пищеварительном тракте, а их действующие вещества — попасть в кровоток. Так бороться с возбудителем лучше, но и список последствий растёт.
Мазями пользоваться безопаснее, а таблетки назначают в серьёзных ситуациях и для профилактики рецидивов при проблемах с иммунитетом. К слову, если герпес появился на губе, головке полового органа или в носу, мазь станет полезнее ещё и благодаря высокой концентрации средства на поражённом участке. Приём внутрь скорее рассчитан на борьбу с инфекцией в целом.
Лечение герпеса мазями
Применять мазь просто: для достижения эффекта достаточно только периодически наносить её на повреждённый участок. Иногда это может принести неудобства, но в целом симптомы герпеса благодаря процедуре проходят быстро. Какая мазь от герпеса на губах самая эффективная, сразу сказать сложно; вывод можно сделать после знакомства с яркими представителями группы.
| Препарат | Действующее вещество | Производитель | Цена |
| Ацикловир мазь для наружного применения 5% | Ацикловир | НИЖФАРМ АО (Россия) | 25 руб. |
| Зовиракс крем для наружного применения 5% | Ацикловир | ГлаксоСмитКляйн Хелскер АО (Россия) (Великобритания) | 188 руб. |
| Герперакс мазь для наружного применения 5% | Ацикловир | MICRO LABS Limited (Индия) | 67 руб. |
| Эразабан крем для наружного применения 10% | Докозанол | ИНВАР ООО (Россия) | 374 руб. |
| Панавир гель для наружного и местного применения 0,002% | Картофеля побегов экстракт | НАЦИОНАЛЬНАЯ ИССЛЕДОВАТЕЛЬСКАЯ КОМПАНИЯ ООО (Россия) | 152 руб. |
Немалая часть актуальных мазей и кремов содержит ацикловир: цена на разные варианты зависит от производителя и его технологии. В целом именно препарат с аналогичным названием годами не теряет лидерских позиций в лечении герпеса благодаря сочетанию низкой цены и неплохого результата. Эразабан и Панавир считаются более прогрессивными; доказательная база обширнее у последнего средства.
Лидер по назначениям — Ацикловир
Продаётся Ацикловир не только в форме мази, но и таблетками; оба варианта недорогие. К новому поколению он не относится, но проверен временем и пользуется популярностью. Помогает противовирусное при герпесе на губах, генитатальной инфекции, опоясывающем лишае и ветряной оспе.
Мазать болезненные участки и примыкающие к ним области кожи нужно через каждые 4 часа, тонким слоем средства. Лучше всего делать это ватным тампоном; если мазь наносится руками, их нужно тщательно вымыть. Продолжается лечение от 5 до 10 дней: до образования корочки или полного заживления.
Нанесение мази непосредственно до появления пузырьков (при покалывании и зуде на губе) или сразу после этого ускоряет снятие симптомов.
Ациловиром нельзя пользоваться при аллергии на него и валацикловир.
Во время терапии у вируса иногда появляется резистентность: в этом случае повторные курсы лекарства будут бесполезны. Побочные эффекты у мази выражаются жжением, воспалением слизистых, сухостью кожи. Иногда возникает аллергия. В применении и побочных эффектах таблеток есть особенности.
Аналоги Ацикловира
То же самое действующее вещество содержится в Зовираксе и Герпераксе. Применяются они без особенностей, формы выпуска — разнообразны. Более интересными вариантами с другими активными компонентами против герпеса становятся Эразабан и Панавир.
- Зовиракс — дорогой аналог. Курс лечения кремом длится от 4 дней, эффект становится ощутим уже через пару применений. Продаётся Зовиракс в удобной небольшой упаковке, однако заканчивается лекарство крайне быстро. Другие формы выпуска включают таблетки 200 мг, глазную мазь и лиофилизат для приготовления раствора для инфузий. В состав Зовиракса дуо-актив включено гормональное противовоспалительное средство — гидрокортизон.
- Герперакс стоит дешевле Зовиракса. Его дополнительная форма выпуска — таблетки. По эффекту средство похоже на Ацикловир.
Примерами других аналогов становятся Ацигерпин и Виворакс. Считается, что Зовиракс выигрывает по качеству: благодаря особенностям производства и очистки он действует мягче, но эффективнее. Биодоступность такого крема выше, действие при впитывании продолжительнее, а случаи устойчивости вируса — сокращаются.
Прогрессивные препараты
Возникающая время от времени резистентность герпеса к лечению преодолевается с помощью противовирусных средств без ацикловира в составе. Пригодятся здесь Эразабан и Панавир; в их составе — доконазол и экстракт побегов картофеля соответственно. Оба средства — относительно новые, и механизм их работы может быть не до конца изучен.
- Эразабан эффективен только в случае заражения герпесом 1 типа. Считается, что доконазол в его составе не даёт вирусу соединяться с мембраной клетки и проникать внутрь. Наносят крем каждые 3 часа, продолжается лечение до 10 дней. До 12 лет Эразабан не рекомендуют, а помимо местных реакций его использование может вызвать головную боль.
- Панавир борется с герпесом 1 и 2 типов и папилломами. Растительный препарат выпускается в виде геля, таблеток, суппозиториев и раствора для внутривенного введения, а его побочное действие ограничено аллергическими реакциями. Гель можно использовать беременным с учётом рисков. Во второй и третий триместр Панавир показан системно при обострении цитомегаловирусной инфекции. До 18 лет лекарство не назначают.
Панавир заметно превосходит Эразабан по спектру воздействия. В составе комплексной терапии и внутрь препарат назначается при язвенной болезни, ревматоидном артрите, гриппе, клещевом энцефалите и хроническом бактериальном простатите. Преимуществом геля над мазями или кремами становится отсутствие запаха и жирного блеска.
Использование таблеток
Все самые современные препараты — представители нового поколения — выпускаются в таблетках. У лучших из них нежелательных последствий почти нет. В такой лекарственной форме противогерпетические средства дороже, но зато удобнее для приёма.
| Препарат | Действующее вещество | Производитель | Цена |
| Ацикловир таблетки 200 мг | Ацикловир | АВЕКСИМА ОАО (Россия) | 37 руб. |
| Валтрекс таблетки, покрытые плёночной оболочкой, 500 мг | Валацикловир | ГлаксоСмитКляйн Хелскер АО (Россия) (Великобритания) | 1325 руб. |
| Валвир таблетки, покрытые плёночной оболочкой, 500 мг | Валацикловир | ACTAVIS GROUP PTC ehf. (Исландия) | 1193 руб. |
| Фамвир таблетки, покрытые оболочкой, 500 мг | Фамцикловир | NOVARTIS PHARMA AG (Швейцария) | 1540 руб. |
| Фамилар таблетки, покрытые плёночной оболочкой, 500 мг | Фамцикловир | АРС ООО (Россия) | 1748 руб. |
| Изопринозин таблетки 500 мг | Инозин пранобекс | Teva Pharmaceutical Industries Ltd. (Израиль) | 1160 руб. |
Подвергаясь в организме превращениям, валацикловир преобразуется в своего предшественника: ацикловир. Тем не менее, работают такие таблетки лучше. Концентрация действующего вещества в крови получается выше, к тому же она длительное время сохраняется на хорошем уровне и продолжает воздействовать на вирус. Это позволяет отнести препараты на основе валацикловира к более современной группе.
Ацикловир в таблетках
Пьют Ацикловир во время еды или сразу после неё. При лечении следует знать, что препарат требует осторожного применения у пожилых: нужно следить за тем, чтобы больные получали достаточно воды. При почечной недостаточности дозу снижают. Следят и за больными с неврологическими нарушениями. Несмотря на хорошую переносимость, список возможных последствий внушительный:
- тошнота, расстройство пищеварения, проблемы с печенью вплоть до гепатита;
- нарушения кроветворения: например, анемия и лейкопения;
- головная боль, галлюцинации, спутанность сознания, судороги, сонливость, кома;
- одышка;
- аллергические реакции, зуд, сыпь, выпадение волос;
- отёки, нарушение зрения, утомляемость, боли в мышцах.
До 3 лет таблетки детям давать нельзя. Известно также, что ацикловир проникает в грудное молоко: это позволяет включить период лактации в противопоказания. При беременности Ацикловир иногда назначают.
Препараты на основе валацикловира
Устойчивые к валациклавиру штаммы герпеса появляются редко, и в целом препараты с ним чаще оказываются полезнее, чем сам Ацикловир. Всасывается из желудочно-кишечного тракта вещество хорошо, превращается в активный метаболит быстро и полностью.
Ацикловир, получающийся из валацикловира, отвечает за некоторые побочные эффекты препаратов и необходимость отказа от грудного вскармливания на время лечения. Осторожности требует работа с больными ВИЧ, пациентами с недостаточностью почек или принимающими токсичные для этих органов препараты.
- Валтрекс — дорогие, но эффективные таблетки. Они не показаны до 12 лет, а опоясывающий герпес можно лечить только с 18 лет. Дозы для взрослых и подростков не пересчитываются; в каждой таблетке содержится 500 мг вещества.
- Валвир не отстаёт по цене от аналога, но представлен на рынке в двух дозировках: по 500 и 1000 мг. Последняя удобна, когда за раз нужно принять сразу большую дозу лекарства. Борьба с опоясывающим герпесом — один из таких примеров.
Пьют таблетки с валацикловиром вне зависимости от приёма пищи. Назначают аналоги в одинаковых случаях и с равной частотой приёма. К редким побочным эффектам добавляется вероятность нарушения работы почек: кристаллы ацикловира могут сформироваться прямо в просвете их канальцев.
Таблетки с фамцикловиром
Фамцикловир — новое и современное лекарство для лечения герпеса, поэтому средства с ним в высшей степени заслуживают звание таблеток от герпеса на губах последнего поколения. Герпесом 1 типа его работа не ограничивается: выступающий в роли активного метаболита пенцикловир борется с опоясывающим герпесом, вирусом Эпштейна-Барр и цитомегаловирусом.
Вещество не даёт вирусной ДНК реплицироваться в течение 12 часов. При этом эффект достигается при небольшой концентрации, что почти избавляет здоровые клетки от влияния средства. В связи с этим противопоказаний у фамцикловира в целом меньше, и переносится он лучше.
- Фамвир — швейцарский препарат с широким набором дозировок: 125, 250 и 500 мг. Считается одним из лучших препаратов для лечения опоясывающего лишая и поражения глаз. Именно Фамвир в настоящее время становится пусть и дорогим, но лидером по соотношению цена-качество.
- Фамилар — один из аналогов с тем же составом; производится он в России или в Индии. Каждая таблетка несёт по 500 мг фамцикловира, а режим приёма — строго индивидуален. Из других аналогов можно упомянуть таблетки Фамирокс, Минакер и Фамцикловир-Тева.
Побочные эффекты фамцикловира проявляются головной болью, тошнотой, снижением числа тромбоцитов, сыпью и зудом. Иногда больные жалуются на желтуху, галлюцинации и тяжёлые поражения кожи. Противопоказан фамцикловир при непереносимости, а данных по эффектам на беременных и детей ещё не накоплено.
Фоскарнет при устойчивости к лечению
Из-за сходного механизма действия вышеназванных препаратов они в редких случаях оказываются бессильны перед мутировавшими штаммами. В таких ситуациях показан Фоскавир, активным веществом которого становится фоскарнет натрия. Его мишень — ДНК-полимераза вируса. Продаётся средство в виде 3% крема и раствора для внутривенного введения, а наибольшую роль оно играет в терапии ВИЧ.
Лучший эффект Фоскавира достигается при капельном внутривенном введении.
Препарат дорогой, более токсичный и назначается в крайних случаях: больным вводят 40 мг вещества на кг массы тела трижды в сутки на протяжении 15-10 дней.
Противопоказанием становится хроническая почечная недостаточность, лечение беременной женщины и кормление грудью. Применение возможно с трёх лет. Главное побочное действие — нефротоксичность; также Фоскавир может вызвать отёки, тошноту, снижение гемоглобина, депрессию, головную боль и утомляемость.
Противовирусное со стимуляцией иммунитета
Изопринозин — таблетки, способные справиться с герпесом, корью, цитомегаловирусом, гриппом A и B. Инозин пранобекс в его составе ингибирует РНК вируса и важный для репликации фермент — дигидроптероатсинтетазу. Помимо этого, лекарство стимулирует активность лимфоцитов и повышает синтез иммуноглобулина, тем самым делая иммунитет более активным. Изопринозин усиливает эффект ацикловира.
Изопринозин противопоказан при подагре, мочекаменной болезни, аритмии и почечной недостаточности.
Пить таблетки нужно после еды из расчёта 50 мг/кг массы тела; суточную дозу делят на 3-4 приёма. Взрослым обычно положено 6-8 таблеток в день; тяжёлая инфекция требует увеличения дозы вдвое, а принимать лекарство соответственно нужно чаще. Курс лечения герпеса длится 5-10 дней, при профилактике в течение месяца пьют по 1 таблетке дважды в сутки.
Начинают давать лекарство детям с 3 лет, когда пациент набирает массу 15-20 кг. Основная масса побочных реакций Изопринозина связана с нарушением пищеварения и головной болью, хотя встречаются полиурия, боль в суставах и обострение подагры.
Курсы лечения таблетками у взрослых
Назначение таблеток зависит от вида герпеса и тяжести его проявления. Первичная инфекция обычно переносится хуже и может включать общую слабость и повышение температуры; при этом могут назначить повышенную дозировку. Пересчёт проводится и при заболеваниях почек — в зависимости от их состояния; больные с иммунодефицитом также требуют особого подхода.
| Применение | Дозировка, мг | Частота, раз в сутки | Курс, дней |
| Ацикловир | |||
| 1 и 2 типы | 200 | 5 с интервалом в 4 ч днём и в 8 ч — на ночь | 5-10 |
| Профилактика | 200 мг 4 раза в сутки или 400 мг 2 раза в сутки. Возможно 200 мг 3 раза в сутки | Индивидуально | |
| Ветряная оспа | 800 | 5 с интервалом в 4 ч днём и в 8 ч — на ночь | 7-10 |
| Опоясывающий лишай | 800 | 4, каждые 6 ч | 5 |
| Валтрекс и Валвир | |||
| 1 и 2 типы, в том числе лабиальный герпес | 500 | 2 | 3 или 5; до 10 при первичном |
| Лабиальный герпес (альтернативный вариант) | 2000 | 2 | 1 |
| Профилактика | 500 | 1 или 2 при иммунодефиците | 6-12 месяцев |
| После трансплантации | 2000 | 4 | 90 |
| Опоясывающий герпес | 1000 | 3 | 7 |
| Фамвир | |||
| Ветряная оспа, опоясывающий герпес | 250 мг — 3 раза в сутки, 500 мг — 2, 750 мг — 1 | 7 | |
| Простой герпес — первичная | 250 | 3 | 5 |
| Простой герпес — рецидивы | 125 | 2 | 5 |
Несмотря на разработанные курсы для профилактики рецидивов, обращаются к предупредительному лечению нечасто. Для постоянной борьбы с вирусом лекарство должно постоянно находиться в крови: это требует ежедневного приёма таблеток, что для пациентов без проблем с иммунитетом не всегда целесообразно. В любую схему лечения врачи могут включить препараты для иммунотерапии: Интерферон, Виферон, Левамизол, Полудан, Амиксин, Арбидол.
Лечение герпеса у детей
Обычно детям средства от герпеса стараются не назначать: оправданы они только при серьёзной угрозе жизни и здоровью. Часто такие случаи связаны с трансплантацией органов или заражением ребёнка ВИЧ; несовершенство иммунной системы малышей даёт вирусу шанс вызвать патологии. Иногда врачи прибегают к помощи препаратов и у относительно здоровых ребят; простую инфекцию можно быстро вылечить в домашних условиях, а для сложных случаев показан стационар.
Чтобы шанс заболеть снизился, малышу показаны хорошее питание, свежий воздух, подходящий уровень физических нагрузок.
Если всё же обнаруживается герпес на теле, лечение у детей препаратами для приёма внутрь проводится редко.
Самым простым и безопасным средством становится мазь Ацикловира; можно обрабатывать высыпания растворами фурацилина, хлоргексидина, а ускорит заживление облепиховое масло. Герпес в глазах лечат специальной мазью Зовиракса. Если у малыша поднимается температура, её сбивают Ибупрофеном или Парацетамолом.
Ацикловир в таблетках детям назначают при ветряной оспе. При этом в возрасте от 3 до 6 лет показано по 2 таблетки 4 раза в сутки, а ребятам старше дозировку повышают до 4 таблеток с той же периодичностью. Курс лечения — 5 дней. Той же схемы придерживаются при опоясывающем лишае. Таблетки на основе валацикловира показаны с 12 лет в равной со взрослыми дозировке, а Фамвир и аналоги из-за нехватки данных дают только по серьёзным показаниям.
Лучший вариант лечения
Самая подходящая лекарственная форма для лечения периодических высыпаний на коже — мазь; поможет дешёвый Ацикловир или более эффективный дорогой Зовиракс. Чем раньше будет использован препарат, тем быстрее исчезнут пузырьки. Оптимальным вариантом будет помазать больное место уже при первых признаках покалывания. Панавир современнее и стимулирует иммунитет.
Таблетки предназначены для лечения серьёзных инфекций и профилактики: обычно при сниженном иммунитете. Валтрекс или Валвир превосходят по действию Ацикловир и могут приниматься реже, а самым современным лекарством становится Фамвир, исцеляющий даже опасные проявления болезни. Если возбудитель проявил к лечению устойчивость, врачи могут прибегнуть к назначению Фоскавира.
Комплексная терапия герпеса включает противовирусные и средства для повышения иммунитета. Немалую роль в обеспечении здоровья играют правильное питание и приём витаминов. Сильный организм делает шанс на рецидивы минимальным.
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-002208
Торговое наименование препарата
Никавир®
Международное непатентованное наименование
Фосфазид
Лекарственная форма
таблетки
Состав
Действующее вещество: фосфазид — 400 мг.
Вспомогательные вещества: кальция карбонат (осажденный) — 225,5 мг; целлюлоза микрокристаллическая — 72,7 мг; кремния диоксид коллоидный (аэросил) — 25,5 мг; кальция стеарат — 7,3 мг.
Описание
Таблетки белого или белого с желтовато-сероватым оттенком цвета, с желтовато-сероватыми вкраплениями, двояковыпуклой формы, с характерным запахом.
Фармакотерапевтическая группа
Противовирусное [ВИЧ] средство
Код АТХ
J05AX
Фармакодинамика:
Активное вещество фосфазид относится к классу ингибиторов обратной транскриптазы (ревертазы) ретровирусов, являясь модифицированным аналогом природного нуклеозида тимидина. Фосфазид, проникнув в инфицированную клетку, дважды фосфорилируется до активного метаболита — трифосфата азидотимидина, который встраивается вместо трифосфата тимидина в синтезируемую ревертазой цепочку провирусной ДНК, что приводит к ингибированию ревертазы, обрыву цепочки ДНК и остановке воспроизведения вирусных частиц. На этом механизме и основан терапевтический эффект препарата по снижению концентрации ВИЧ в крови больного.
Также препарат ингибирует репликацию некоторых других ретровирусов млекопитающих, например, вируса гепатита В.
Фармакокинетика:
Фосфазид хорошо всасывается из желудочно-кишечного тракта. Время полного всасывания составляет 3-3,5 ч; период полувыведения из организма — 3-4 ч; максимальная концентрация фосфазида в плазме крови — 19-22 мкг/мл достигается через 4-5 ч.
Биодоступность при пероральном применении составляет 20%. Относительная биодоступность фосфазида составляет 83,7%. Фосфазид проникает через гематоэнцефалический барьер и обнаруживается в спинномозговой жидкости в концентрации, составляющей 15-64% исходной дозы. Активное вещество хорошо проникает через плаценту, вследствие чего концентрация его в крови пуповины сопоставима с таковой в крови матери. Метаболизм фосфазида происходит в печени с образованием глюкуронида, который выводится из организма почками с мочой.
Показания:
Лечение ВИЧ-инфекции у взрослых в комбинации с другими антиретровирусными препаратами.
Экстренная профилактика ВИЧ-инфекции в случае риска профессионального инфицированияпри попадании биологических жидкостей пациентов на слизистые оболочки и повреждении кожных покровов (уколах, порезах).
Лечение острого гепатита В в легкой и среднетяжелой форме (желтушный период).
Противопоказания:
Повышенная чувствительность к фосфазиду или к любому из вспомогательных веществ препарата.
Детский возраст до 18 лет.
С осторожностью:
Выраженная тошнота, рвота, анемия (концентрация гемоглобина ниже 50 г/л), повышение активности трансаминаз (более чем в 5 раз относительно верхней границы нормы), гиперкреатининемия, нейтропения (ниже 0,5×109/л), тромбоцитопения (менее 25×109/л).
Беременность и лактация:
ВИЧ- инфицированным беременным женщинам не рекомендуется принимать препарат до 14 недели беременности; при необходимости применения препарата в период лактации необходимо решить вопрос о прекращении грудного вскармливания.
Способ применения и дозы:
Внутрь. Суточная доза при ВИЧ-инфекции — 800-1200 мг в 2 или 3 приема.
Рекомендуется принимать препарат перед едой и запивать стаканом воды. При поражениях центральной нервной системы вирусом иммунодефицита человека, препарат назначают в суточной дозе 1200 мг. При плохой переносимости препарата суточная доза может быть снижена до 400 мг в сутки.
Курс лечения. Препарат назначают на длительный, практически неограниченный срок, при необходимости курс может быть прерван, но длительность его должна составлять не менее 12 недель с перерывом между курсами — не более 12 недель.
Для профилактики заражения вирусом иммунодефицита человека рекомендуется как можно раньше, но не позднее, чем через 72 часа после возможного инфицирования, начать прием препарата по 400 мг 3 раза в день в течение 4 недель;
При остром гепатите препарат назначают по 400 мг 2 раза в день в течение 20 дней. Рекомендуется начинать принимать препарат не позднее 7 дней от начала желтухи.
Побочные эффекты:
В первые дни приема препарата — тошнота, головная боль, тяжесть в эпигастрии, диарея. Обычно эти явления впоследствии исчезают. Со стороны органов кроветворения: анемия, гранулоцитопения.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка:
Случаи передозировки препаратом не описаны. Гемодиализ и перитонеальный диализ усиливают выведение глюкуронового метаболита фосфазида.
Взаимодействие:
Совместное применение препарата Никавир® с зидовудином, ставудином приводит к взаимному понижению активности в отношении ВИЧ.
Совместное применение с интерфероном альфа, диданозином, ламивудином, фоскарнетом приводит к взаимному повышению активности в отношении ВИЧ.
Совместное применение с доксорубицином, интерфероном альфа, амфотерицином-В, ко-тримоксазолом, винбластином, винкристином, ганцикловиром, дапсоном, сульфадиазином и другими сульфаниламидами может приводить к взаимному усилению миелотоксичности, поэтому требуется дополнительный контроль за концентрацией гемоглобина и гранулоцитов.
Особые указания:
Обычно препарат хорошо переносится больными. Фосфазид — малотоксичное вещество. Его токсичность в 5-6 раз ниже, чем зидовудина. Оценивая переносимость препарата, следует учитывать, что указанные побочные действия и другие симптомы и синдромы могут быть проявлениями не только терапии, но и самой ВИЧ-инфекции и сопутствующих заболеваний.
При проявлении некоторых нежелательных явлений на ранних стадиях приема препарата не следует его отменять, рекомендуется продолжить терапию под контролем врача.
Нерегулярность приема препарата больным (нарушение схемы лечения) может привести к развитию резистентности (устойчивости) ретровируса к нему, что повлечет за собой снижение эффективности проводимой терапии и необходимости замены препарата.
Во избежание осложнений препарат применяют под контролем врача.
Терапия препаратом не снижает риска передачи ВИЧ другим людям при половых контактах или при переливании крови.
Влияние на способность управлять транспортными средствами и механизмами:
Исследования не проводились, однако при решении вопроса о возможности управлять автомобилем, механизмами, нужно иметь в виду состояние пациента и возможность развития побочных реакций на Никавир®, таких как тошнота, головная боль, диарея.
Форма выпуска/дозировка:
Таблетки 400 мг.
Упаковка:
10 таблеток в контурной ячейковой упаковке (блистер) из пленки-ПВХ/ПВДХ и фольги; по 6 блистеров с инструкцией по применению в пачке из картона.
Условия хранения:
В сухом защищенном от света месте при температуре не выше 20°С. Хранить в недоступном для детей месте.
Срок годности:
2 года. Не использовать после истечения срока годности.
Условия отпуска
По рецепту
Производитель
ООО «АЗТ ФАРМА К.Б.», г. Москва, ул. Твардовского, д. 8, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
ООО «АЗТ ФАРМА К.Б.»
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)