Описание
Набор для определения антифунгальной чувствительности патогенных для человека дрожжевых грибов,
вызывающих системные (глубокие) микозы.
Количество тестов -12.
Состав набора:
— флакон 4 мл с буферным раствором полужидкого агара, содержащего бакто-агар, колимицин и ванкомицин; для суспендирования колоний и стандартизации инокулята – 14 шт.,
— флакон 5 мл с жидкой средой (модифицированная среда RPMI), содержащей резазурин в качестве индикатора роста и глюкозу; для проведения теста на чувствительность – 12 шт.,
— плашка с 20 лунками (одна плашка для одного теста) – 12 шт.,
— флакон 4 мл с раствором сульфата бария для контроля мутности – 1 шт.
Чувствительность к грибам тестируется на 5 антимикотиков:
Флуцитозин (4 мкг/мл, 8 мкг/мл, 16 мкг/мл, 32 мкг/мл),
Итраконазол (0,125 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1 мкг/мл),
Флуконазол (8 мкг/мл, 16 мкг/мл, 32 мкг/мл, 64 мкг/мл) в 4-х концентрациях,
Вориконазол (1 мкг/мл, 2 мкг/мл, 4 мкг/мл),
Амфотерицин В (0,5 мкг/мл, 1 мкг/мл, 2 мкг/мл) в 3-х концентрациях.
Контроль мутности включен в набор.
Время исследования 24 часа (не более 48 часов).
Бесприборная визуализация изменения цвета среды.
Сроки годности набора не менее 6 месяцев с момента поставки
Image
Overview
Rapid colorimetric test to determine susceptibility of yeasts to
6 antifungal
agents by broth dilution method
(10 tests)
Unlicensed for Sale in Canada; Non-homologué pour la vente au Canada
- SDS
-
Сертификат анализа
Safety Data Sheet
Find Certificate
- Описание
Описание
Описание
Unlicensed for Sale in Canada
Non-homologué pour la vente au Canada.
ФСЗ 2009/04380
для открытых систем, определение чувствительности к антибиотикам, 10 шт.
Bio-Rad Laboratories, Франция
ОКП/ОКПД2: 93 9800
- Сохранить PDF
- Печатать
Характеристики
| Для открытых систем | да |
| Назначение | определение чувствительности к антибиотикам |
| Упаковка | флакон |
| Фасовка | 10 шт. |
Дополнительные характеристики
Тест система для определения чувствительности дрожжей к антимикробным препаратам. Основан на определении роста дрожжей в присутствии 6 антигрибковых препаратов в 2 различных концентрациях, в модифицированной RPMI 1640 буферной среде, с цветовым индикатором.
Для оформления заказа на сайте выберите понравившийся товар и добавьте его в корзину. Далее перейдите в Корзину и нажмите на «Оформить заказ», заполнив необходимые поля для заказа. После оформления заявки Вам перезвонит менеджер и уточнит условия заказа.
Получить консультацию нашего специалиста и сделать заказ Вы можете следующими способами:
- Позвонить на многоканальный номер отдела продаж +7 (495) 787-04-32, +7 (495) 787-66-09 .
Если Вы находитесь не в Москве, то по всем вопросам можете обращаться в отдел региональных продаж: +7(495) 612-43-12 доб. 273, доб. 274 и доб. 120 - Написать письмо по электронной почте: sale@hemltd.ru (отдел продаж Москва и МО), regions@hemltd.ru (отдел региональных продаж).
При размещении заказа необходимо указать каталожный номер товара, его существенные характеристики и необходимое количество.
Скидки предоставляются отдельно на каждый товар в зависимости от объема закупки.
Когда мы выписываем Вам счет, то всю продукцию по этому счету мы для Вас резервируем на 3 календарных дня, причем без оплаты, если иное не оговорено в счете. Выставленный Вам счет имеет силу договора, если между нашими предприятиями не заключен договор поставки или иной вид контракта.
Минимальная сумма счета и отгрузки — 9 000 рублей.
М. О. Нагаева
к. м. н., доцент кафедры терапевтической стоматологии ГОУ ВПО ОмГМА Минздрава РФ
М. Г. Чеснокова
д. м. н., профессор, кафедра микробиологии, вирусологии и иммунологии ГОУ ВПО ОмГМА Минздрава РФ
И. В. Анисимова
к. м. н., ассистент кафедры терапевтической стоматологии ГОУ ВПО ОмГМА Минздрава РФ
Истинная заболеваемость кандидозом полости рта в России неизвестна, поскольку он официально не регистрируется, поэтому публикации по этой проблеме в отечественной литературе немногочисленны [5]. Колонизация слизистых оболочек грибами Сandida у практически здоровых людей колеблется от 15 до 40 % и может возрасти до 80 % на фоне какой-либо патологии.
Актуальность исследования
Усиленный рост гриба, приводящий к развитию кандидоза, наблюдается при нарушении местного и системного иммунитета.
Возможно и экзогенное заражение. Поверхностный кандидоз слизистых возникает и у практически здоровых лиц. Глубокий кандидоз развивается при тяжелом иммунодефиците на фоне кандидозного стоматита, глоссита или фарингита. Через поврежденную слизистую грибы проникают в кровь, вызывая фунгемию и сепсис.
Лечение кандидоза должно быть индивидуальным для каждого больного с учетом локализации и остроты процесса и возможности наличия хронической стадии заболевания, с учетом иммунного статуса, наличия других заболеваний. Этиотропное лечение является наиболее важной составляющей комплексного лечения больных с кандидозом полости рта. Эрадикация возбудителя — первое мероприятие, после которого можно переходить к профилактике рецидивов и коррекции местных и общих предрасполагающих факторов. Этиотропная терапия может быть местной (в случае изолированного кандидозного поражения полости рта) и системной (при распространении инфекционного процесса на нижерасположенные отделы пищеварительного тракта, кожу, другие слизистые оболочки). Системная терапия кандидоза слизистой оболочки полости рта назначается, как правило, только при определенных показаниях: хронический гиперпластический кандидоз, эрозивно-язвенная форма кандидоза; кандидоз полости рта на фоне сахарного диабета, иммунодефицитного состояния; при неэффективной местной терапии.
Перечень антигрибковых препаратов огромен, и с каждым годом появляются новые препараты в виде ополаскивателей, растворов, таблетированных форм. Основную группу специфических препаратов составляют антимикотические средства, однако на сегодняшний день чувствительность к ним грибов Candida неодинаковая, а зачастую недостаточная. Тем не менее тесты на чувствительность не считаются рутинной процедурой, не всегда доступны и обычно не рассматриваются как стандартная методика в ведении больного. Тесты на чувствительность считаются полезными в тех случаях, когда мы имеем дело с глубокими инфекциями, обусловленными non-albicans видами Candida. В этих случаях, особенно если больного предварительно уже лечили антифунгальными азолами, должна быть рассмотрена возможность микробиологической резистентности.
Целью нашего исследования явилось определение чувствительности к антимикотикам штаммов грибов рода Сandida, выделенных у больных оральным кандидозом.
Материалы и методы
На базе кафедры терапевтической стоматологии ОмГМА и ГКСП № 1 г. Омска нами проведено клиническое обследование 48 пациентов с жалобами на боль и жжение в слизистой оболочке полости рта. Обследование проводилось согласно алгоритму, предложенному Недосеко В. Б., Анисимовой И. В. (2003) [3].
В комплексном обследовании пациентов проводилось микробиологическое исследование материала, полученного путем соскоба со слизистой оболочки спинки языка. Забор биоматериала осуществлялся до назначения лечебных мероприятий сухим стерильным тампоном без использования транспортной среды. Перед взятием микробиологического материала пациентам рекомендовали воздержаться от приема пищи и гигиенических процедур. Микробиологический материал помещался в стерильную транспортную пробирку и в течение двух часов доставлялся в баклабораторию. С целью выделения факультативно-анаэробных микроорганизмов, дрожжеподобных грибов рода Candida биоматериал засевали на питательные среды. Готовили серию последовательных двукратных разведений материала с 102 по 1012. Для выделения стафилококков осуществляли посев соответствующих разведений на желточно-солевой агар, для выявления стрептококков проводили посев на кровяной агар с азидом натрия. Для выделения бактерий рода Haemophilus и Neisseria материал засевали на шоколадный агар с линкомицином, энтеробактерий — на среду Эндо, для обнаружения энтерококков использовали энтерококковый агар.
Для выделения грибов рода Candida биоматериал засевали на среду Сабуро, Кандиселект.
Для идентификации грибов оценивали культуральные свойства на среде Кандисилект, биохимическую идентификацию проводили с помощью тест-системы «Ауксоколор».
Для определения чувствительности дрожжеподобных грибов рода Candida к антимикотическим препаратам (нистатин, амфотерицин В, клотримазол, флуконазол, итраконазол) использовали классический дискодиффузионный метод и Фунгитест.
Для постановки дискодиффузионного метода готовили взвесь культуры в изотоническом растворе хлорида натрия, 1 мл взвеси выливали на поверхность среды Мюллера — Хинтона. Учет результатов проводили путем измерения диаметра зоны подавления роста культуры к антимикотику.
Для проведения Фунгитеста готовили суспензию грибов из чистой культуры, выросшей на среде Сабуро, — первый калиброванный инокулят с мутностью, соответствующей стандарту 3 х 106 грибов/мл.
Разведение первичного раствора 1:20 добавляли в суспензионную среду для получения стандартного инокулята (103 КОЕ/мл). Стандартный инокулят вносили в лунки микропланшета. Инкубировали в течение 48 часов.
Результаты исследования и их обсуждение
При обследовании 48 пациентов нами было выявлено 23 пациента с признаками орального кандидоза. Все пациенты предъявляли жалобы на боль, жжение, сухость во рту. У 60,8 % (14 пациентов) выявлялись клинические признаки хронического атрофического кандидоза (рис. 1), у 39,2 % (9 пациентов) был обнаружен хронический гиперпластический кандидоз (рис. 2).
Рис. 1. Пациентка К., 65 лет. Хронический атрофический кандидоз полости рта
Рис. 2. Пациентка И., 69 лет. Хронический гиперпластический кандидоз полости рта. Кандидозная заеда
В результате микробиологического исследования материала из полости рта 23 пациентов выделено и идентифицировано 75 штаммов условно патогенных микроорганизмов (48 штаммов Candida albicans, 27 штаммов условно патогенных бактерий). Большинство выделенных микроорганизмов высевалось в значимых концентрациях (104 КОЕ — 29,3 %, 106 КОЕ 40,0 %, 108 КОЕ — 22,7 %). При этом Candida albicans наиболее часто встречалась в ассоциации с S. epidermidis (104 КОЕ, 106 КОЕ), с E. faecalis (104 КОЕ, 106 КОЕ), S. salivarius (106 КОЕ). В ходе определения чувствительности грибов Candida аlbicans к антимикотическим препаратам выявлено 18 (37,5 %) штаммов с признаками резистентности. Наибольшая устойчивость выделенных штаммов грибов определялась к нистатину (33 % чувствительных штаммов) (рис. 3).
Рис. 3. Чувствительность к антимикотикам в дискодиффузионном методе
Чувствительность Candida аlbicans к итраконазолу, кетоконазолу, 5 флюороцитазину и миконазолу составила 100 % (рис. 3, 4).
Рис. 4. Чувствительность к антимикотикам в методе «Фунгитест»
При определении чувствительности к флуконазолу дискодиффузионным методом выявлено 94,4 % чувствительных к флуконазолу штаммов. При использовании метода «Фунгитест» чувствительность к флуконазолу в концентрации 8 составила 88,8 %, к флуконазолу в концентрации 64 — 100 %. К клотримазолу проявляли чувствительность 94,4 % штаммов C. аlbicans. Все выделенные штаммы были чувствительны к амфотерицину В(64), к амфотерицину В(8) — лишь 66,6 % штаммов. При определении чувствительности дискодиффузионным методом к амфотерицину В проявляли чувствительность 77,4 % исследуемых штаммов.
Заключение
При назначении этиотропного лечения пациентам с оральным кандидозом необходимо учитывать результаты микологического исследования с определением чувствительности к антимикотическим препаратам, так как у выделенных штаммов Candida аlbicans в 37 % случаев выявлена резистентность к антимикотикам. При выборе метода определения чувствительности к противогрибковым препаратам необходимо учитывать, что дискодиффузионный метод является ориентировочным, Фунгитест обладает выраженной специфичностью и высокой чувствительностью. Кроме того, методы отличаются спектром антимикотиков. Таким образом, для обеспечения оптимального выбора противогрибковых препаратов в практике можно рекомендовать использование двух методов — как дискодиффузионного, так и метода «Фунгитест».
ОЦЕНКА АДГЕЗИВНОЙ СПОСОБНОСТИ И ЧУВСТВИТЕЛЬНОСТИ К АНТИФУНГАЛЬНЫМ ПРЕПАРАТАМ ГРИБОВ РОДА CANDIDA В КОНТЕКСТЕ ИСТОЧНИКА ИЗОЛЯЦИИ
- Авторы
- Файлы
Хомич Ю.С.
Бурмистрова А.Л.
Самышкина Н.Е.
Поспелова А.В.
Чернов Ю.И.
Грибы рода Candida являются уникальными микроорганизмами, имеющими огромный диапазон адаптационных возможностей (от сапрофитов до комменсалов и оппортунистов), позволяющих им успешно проживать как в различных анатомических местах организма хозяина, так и во внешней среде. И хотя этим грибам и вызываемым ими инфекциям посвящено большое количество работ, многие вопросы остаются до конца не решенными, например, такой «простой» вопрос, как происхождение источника инфекции при кандидозе. Считается, что большинство штаммов, выступающих в качестве причины заболевания, являются комменсалами самих пациентов. Возникает вопрос, каковы причины и вклад грибов рода Candida при переключении от «безобидного» сосуществования до агрессии? И одним из параметров, характеризующих трансформацию биологических свойств грибов рода Candida при смене условий существования (внешняя среда/человек), является способность к адгезии на эпителиоциты человека.
В тоже время, возрастающая частота кандидозов, в т.ч. вызванных Candida non albicans, может свидетельствовать об импорте инфекции и (или) о замене, в силу каких-то обстоятельств, «добропорядочных» комменсалов на агрессивные («дикие») штаммы.
Целью данного исследования было сравнить природные и клинические изоляты грибов рода Candida:
- по чувствительности к антифунгальным препаратам in vitro;
- по адгезивной способности в системе «Candida spp. — буккальные/вагинальные эпителиоциты» in vitro.
1. Исследуемые культуры. В работе были использованы:
- культуры грибов рода Candida, выделенные из: а) влагалища женщин с различной генитальной патологией (n = 22); б) ротовой полости больных с кандидозом ротовой полости (n = 12); в) окружающей среды (n = 10);
- штамм Candida albicans ATCC 10231.
Все клинические изоляты первоначально идентифицировали с помощью теста на ростовую трубку. Candida non albicans виды идентифицировали далее с помощью тест-системы «Auxocolor» (BioRad, Франция). Среди штаммов, выделенных из влагалища, одна культура была идентифицирована как Candida krusei, три — Candida glabrata; остальные — Candida albicans. Оральные изоляты все были представлены видом C. albicans. Природные штаммы были любезно предоставлены кафедрой биологии почв факультета почвоведения МГУ. Среди них было восемь коллекционных (три культуры — Candida guilliermondii, три — Candida tropicalis, одна — Candida maltosa, одна — Rhodotorula rubra) и две музейные культуры. Музейные культуры были реидентифицированы нами как Rhodotorula rubra и Candida kefyr («Auxocolor»).
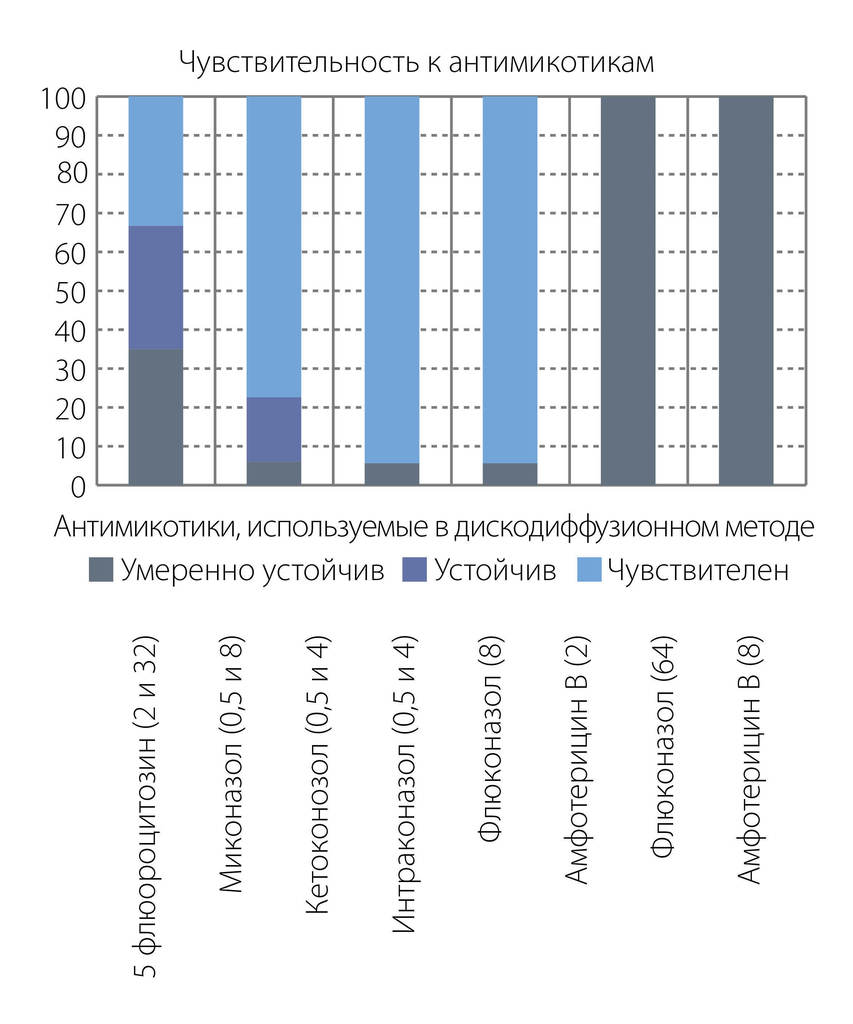
2. Чувствительность к антифунгальным препаратам. Для определения чувствительности грибов использовали коммерческую тест-систему «Fungitest» (BioRad, Франция), включающую следующие препараты:
- Флуконазол в концентрации 8 и 64 мкг/мл,
- Итраконазол 0,5 и 4 мкг/мл,
- Кетоконазол 0,5 и 4 мкг/мл,
- Миконазол 0,5 и 8 мкг/мл,
- Амфотерицин В 2 и 8 мкг/мл,
- 5-флюороцитозин 2 и 32 мкг/мл.
Методику проводили согласно прилагаемой инструкции.
Кроме этого, из тех лунок, где результат был расценен как «чувствителен», для оценки эффекта действия на грибы антифунгального препарата, производили высев 10 мкл содержимого каждой лунки микропланшета на среду Сабуро. Если через 48 часов инкубации при 28°С проявлялся рост грибов, то эффект расценивали как фунгистатический; если роста не было — как фунгицидный.
Результаты. Природные изоляты грибов рода Candida проявили наибольшую чувствительность к антифунгальным препаратам (77,3% чувствительных штаммов) по сравнению с клиническими (59,8%). Максимальную активность в отношении природных и клинических изолятов грибов рода Candida продемонстрировали амфотерицин В (100% чувствительных штаммов) и 5-флюороцитозин (100% среди природных по отношению к 77-92% клинических). Природные штаммы, в отличие от клинических изолятов, показали высокую чувствительность кетоконазолу, но оказались устойчивыми по отношению к миконазолу в концентрации 0,5 мкг/мл (при концентрации 8 мкг/мл показали 100% чувствительность). Обращает внимание низкая чувствительность клинических изолятов к флуконазолу при обеих концентрациях. Для всех антимикотиков было отмечено, что если при минимальной концентрации препарат оказывал фунгистатическое действие, то при увеличении концентрации — эффект становился фунгицидным.
Штамм C.albicans АТСС 10231 продемонстрировал 100% чувствительность ко всем антимикотикам, входящим в набор «Fungitest».
Вывод. Природные изоляты проявили более высокую чувствительность к антифунгальным препаратам, чем клинические, что, возможно, является отражением общей тенденции роста числа резистентных к антифунгальным препаратам клинических штаммов грибов рода Candida.
3. Адгезия к эпителиальным клеткам здорового человека in vitro. Для изучения адгезивной способности грибов было выбрано две модели: буккальный и вагинальный эпителий. Известно, что успешность адгезии (с последующей колонизацией слизистых поверхностей человека) зависит от координированной регуляции большого количества генов и тестирования множества окружающих параметров, включая физиологические, экологической ниши заселения. Исходя из сказанного, адгезия проводилась с созданием следующих условий: температура 37°С, контактный эпителий из ротовой и вагинальной полости здоровых лиц, pH культуральной среды соответствовал физиологическим показателям той экологической ниши, из которой был получен эпителий (адгезию к вагинальному эпителию для всех штаммов проводили при рН 4,0-4,5; к буккальному — при рН 7,0).
Адгезивная способность всех изученных культур грибов рода Candida оценивалась на буккальном эпителии. У части культур (17 вагинальных, 7 оральных и 5 природных) адгезия оценивалась одновременно на буккальном и вагинальном эпителии.
С целью определения индекса адгезии (ИА) смешивали равные объемы эпителия и грибов при соотношении клеток 1:100 соответственно. Пробирки встряхивали в ротаторе 1 час при 37°С, 70 об/мин. Затем готовили мазок, который окрашивали метиленовой синью. Подсчитывали индекс адгезии — среднее количество адгезированных грибов в пересчете на один эпителиоцит. Определение индекса прочности адгезии (ИПА) проводили следующим образом — эпителиоциты с прикрепившимися кандидами наслаивали на фиколл-верографин (плотность 1,077 г/см3) и центрифугировали при 1000 об/мин 10 минут. Из клеточного осадка делали мазок и подсчитывали индекс прочности адгезии (количество кандид в пересчете на один эпителиоцит, оставшихся адгезированными после прохождения через фиколл-верографин). Процент прочноадгезированных кандид по отношению ко всем прикрепившимся определяли по формуле: ИПА/ ИА × 100%.
Статистическую обработку полученных результатов проводили, используя критерий Стьюдента.
Результаты. Сравнение индексов адгезии оральных, вагинальных и природных изолятов грибов рода Candida к буккальному эпителию (таблица 1) показало наличие достоверно более низкого показателя у природных изолятов по отношению к клиническим штаммам (p<0,01). В то же время, отношение индекса прочности адгезии к индексу адгезии было достоверно выше среди природных изолятов по сравнению с оральными и вагинальными (p<0,05).
Штамм C.albicans АТСС 10231 и природные изоляты имели практически равный индекс адгезии (3,9 и 3,8 соответственно) к буккальному эпителию, но количество прочноадгезированных кандид по отношению ко всем адгезированным клеткам у АТСС штамма было в два раза ниже (25,6% и 50,8% соответственно).
Сравнение индексов адгезии к вагинальному эпителию показало наличие более высокого показателя у вагинальных изолятов в сравнении с оральными (p<0,02) и природными. В то же время, прочность крепления к вагинальному эпителию изолятов из разных экологических ниш достоверно не различалась.
Вывод. Сравнительный анализ адгезивной способности клинических и природных изолятов грибов рода Candida к эпителиальным клеткам различных экологических ниш тела человека (к буккальным и вагинальным) показал, что оральные изоляты демонстрируют достоверно выраженную сайт-специфическую адгезию к буккальному эпителию (p<0,05); вагинальные изоляты имеют практически равный индекс адгезии к буккальному и вагинальному эпителию, а природные штаммы — пониженные индексы адгезии к человеческому эпителию в сравнении с клиническими изолятами. Кроме того, у природных изолятов процент прочноадгезированных кандид ассоциировался с типом эпителия, используемым в реакции: был выше для буккального и ниже для вагинального эпителия в сравнении с клиническими изолятами.
4. Обсуждение результатов исследования. Проведенные исследования показали наличие фенотипических вариаций грибов рода Candida в контексте источника изоляции и позволили высказать несколько соображений.
- Способность вагинальных изолятов Candida albicans одинаково успешно осуществлять адгезию к клеткам вагинального и орального эпителия (одинаковые индексы адгезии и индексы прочности адгезии) позволяет предположить, что вагинально-оральный путь передачи штаммов рода Candida в родах новорожденному является эволюционно-отраженным физиологическим путем создания нормобиоты ротовой полости, но может стать путем патофизиологическим (т.е. путем развития орального кандидоза у новорожденных) в условиях клинически выраженного вульвовагинального кандидоза у матери.
- Хорошо выраженная сайт-специфическая адгезия оральных изолятов Candida albicans к буккальному эпителию может свидетельствовать об успешном импорте оральной кандидозной инфекции в госпитальных условиях (через предметы личного пользования: ложка, стакан и т.д.), особенно когда речь идет о заселении ротовой полости новорожденного или грудного младенца.
- Можно предположить, что существенный процент заболеваний (и оральных, и вагинальных кандидозов) может быть связан с частыми орально-генитальными контактами, а источником кандид могут служить как ротовая, так и вагинальная (более вероятно) полости сексуальных партнеров.
- В связи с тем, что природные штаммы демонстрируют высокую прочность крепления к буккальному эпителию, можно высказать предположение, что при наличии определенных условий природные изоляты имеют шанс стать успешными оральными комменсалами.
Таблица 1. Сравнение адгезивной способности природных и клинических изолятов грибов рода Candida к буккальному и вагинальному эпителию
|
Характер изолятов |
Буккальный эпителий |
Вагинальный эпителий |
||||
|
ИА |
ИПА |
% прочноадгезированных кандид |
ИА |
ИПА |
% прочноадгезированных кандид |
|
|
1. |
2. |
3. |
4. |
5. |
6. |
|
|
1. Вагинальные изоляты |
6,6±0,8 |
2,1±0,4 |
29,0±3,3 |
7,1±0,6*** |
3,0±0,6 |
39,3±5,7 |
|
2. Оральные изоляты |
7,7±1,6**** |
2,8±0,7 |
34,1±3,8 |
4,4±0,9 |
2,0±0,5 |
44,6±4,4 |
|
3. Природные изоляты |
3,8±0,6* |
1,8±0,4 |
50,8±8,5** |
5,0±1,2 |
1,5±0,4 |
31,0±3,6 |
Примечание:* р<0,01 по отношению к 1.1. и 1.2.
** р<0,05 по отношению к 1.3. и 2.3.
*** р<0,02 по отношению к 2.4. и 3.4.
**** р<0,05 по отношению к 2.4.
Библиографическая ссылка
Хомич Ю.С., Бурмистрова А.Л., Самышкина Н.Е., Поспелова А.В., Чернов Ю.И. ОЦЕНКА АДГЕЗИВНОЙ СПОСОБНОСТИ И ЧУВСТВИТЕЛЬНОСТИ К АНТИФУНГАЛЬНЫМ ПРЕПАРАТАМ ГРИБОВ РОДА CANDIDA В КОНТЕКСТЕ ИСТОЧНИКА ИЗОЛЯЦИИ // Успехи современного естествознания. – 2006. – № 4.
– С. 105-107;
URL: https://natural-sciences.ru/ru/article/view?id=10268 (дата обращения: 30.11.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)