WARNINGS
Included as part of the PRECAUTIONS section.
PRECAUTIONS
Use Of QUALAQUIN For Treatment Or Prevention Of Nocturnal Leg Cramps
QUALAQUIN may cause unpredictable serious and life-threatening hematologic reactions including thrombocytopenia and hemolytic-uremic syndrome/thrombotic thrombocytopenic purpura (HUS/TTP) in addition to hypersensitivity reactions, QT prolongation, serious cardiac arrhythmias including torsades de pointes, and other serious adverse events requiring medical intervention and hospitalization. Chronic renal impairment associated with the development of TTP, and fatalities have also been reported. The risk associated with the use of QUALAQUIN in the absence of evidence of its effectiveness for treatment or prevention of nocturnal leg cramps, outweighs any potential benefit in treating and/or preventing this benign, self-limiting condition.
Thrombocytopenia
Quinine-induced thrombocytopenia is an immune-mediated disorder. Severe cases of thrombocytopenia that are fatal or life threatening have been reported, including cases of HUS/TTP. Chronic renal impairment associated with the development of TTP has also been reported. Thrombocytopenia usually resolves within a week upon discontinuation of quinine. If quinine is not stopped, a patient is at risk for fatal hemorrhage. Upon re-exposure to quinine from any source, a patient with quinine-dependent antibodies could develop thrombocytopenia that is more rapid in onset and more severe than the original episode.
QT Prolongation And Ventricular Arrhythmias
QT interval prolongation has been a consistent finding in studies which evaluated electrocardiographic changes with oral or parenteral quinine administration, regardless of age, clinical status, or severity of disease. The maximum increase in QT interval has been shown to correspond with peak quinine plasma concentration. Quinine sulfate has been rarely associated with potentially fatal cardiac arrhythmias, including torsades de pointes, and ventricular fibrillation.
QUALAQUIN has been shown to cause concentration-dependent prolongation of the PR and QRS interval. At particular risk are patients with underlying structural heart disease and preexisting conduction system abnormalities, elderly patients with sick sinus syndrome, patients with atrial fibrillation with slow ventricular response, patients with myocardial ischemia or patients receiving drugs known to prolong the PR interval (e.g. verapamil) or QRS interval (e.g. flecainide or quinidine).
QUALAQUIN is not recommended for use with other drugs known to cause QT prolongation, including Class IA antiarrhythmic agents (e.g., quinidine, procainamide, disopyramide), and Class III antiarrhythmic agents (e.g., amiodarone, sotalol, dofetilide).
The use of macrolide antibiotics such as erythromycin should be avoided in patients receiving QUALAQUIN. Fatal torsades de pointes was reported in an elderly patient who received concomitant quinine, erythromycin, and dopamine. Although a causal relationship between a specific drug and the arrhythmia was not established in this case, erythromycin is a CYP3A4 inhibitor and has been shown to increase quinine plasma levels when used concomitantly. A related macrolide antibiotic, troleandomycin, has also been shown to increase quinine exposure in a pharmacokinetic study.
Quinine may inhibit the metabolism of certain drugs that are CYP3A4 substrates and are known to cause QT prolongation, e.g., astemizole, cisapride, terfenadine, pimozide, halofantrine and quinidine. Torsades de pointes has been reported in patients who received concomitant quinine and astemizole. Therefore, concurrent use of QUALAQUIN with these medications, or drugs with similar properties, should be avoided.
Concomitant administration of QUALAQUIN with the antimalarial drugs, mefloquine or halofantrine, may result in electrocardiographic abnormalities, including QT prolongation, and increase the risk for torsades de pointes or other serious ventricular arrhythmias. Concurrent use of QUALAQUIN and mefloquine may also increase the risk of seizures.
QUALAQUIN should also be avoided in patients with known prolongation of QT interval and in patients with clinical conditions known to prolong the QT interval, such as uncorrected hypokalemia, bradycardia, and certain cardiac conditions.
Concomitant Use Of Rifampin
Treatment failures may result from the concurrent use of rifampin with QUALAQUIN, due to decreased plasma concentrations of quinine, and concomitant use of these medications should be avoided.
Concomitant Use Of Neuromuscular Blocking Agents
The use of neuromuscular blocking agents should be avoided in patients receiving QUALAQUIN. In one patient who received pancuronium during an operative procedure, subsequent administration of quinine resulted in respiratory depression and apnea. Although there are no clinical reports with succinylcholine or tubocurarine, quinine may also potentiate neuromuscular blockade when used with these drugs.
Hypersensitivity
Serious hypersensitivity reactions reported with quinine sulfate include anaphylactic shock, anaphylactoid reactions, urticaria, serious skin rashes, including Stevens-Johnson syndrome and toxic epidermal necrolysis, angioedema, facial edema, bronchospasm, and pruritus.
A number of other serious adverse reactions reported with quinine, including thrombotic thrombocytopenic purpura (TTP) and hemolytic uremic syndrome (HUS), thrombocytopenia, immune thrombocytopenic purpura (ITP), blackwater fever, disseminated intravascular coagulation, leukopenia, neutropenia, granulomatous hepatitis, and acute interstitial nephritis may also be due to hypersensitivity reactions.
QUALAQUIN should be discontinued in case of any signs or symptoms of hypersensitivity.
Atrial Fibrillation And Flutter
QUALAQUIN should be used with caution in patients with atrial fibrillation or atrial flutter. A paradoxical increase in ventricular response rate may occur with quinine, similar to that observed with quinidine. If digoxin is used to prevent a rapid ventricular response, serum digoxin levels should be closely monitored, because digoxin levels may be increased with use of quinine.
Hypoglycemia
Quinine stimulates release of insulin from the pancreas, and patients, especially pregnant women, may experience clinically significant hypoglycemia.
Patient Counseling Information
See FDA-approved patient labeling (Medication Guide)
Dosing Instructions
Patients should be instructed to:
- Take all of the medication as directed.
- Take no more of the medication than the amount prescribed.
- Take with food to minimize possible gastrointestinal irritation.
If a dose is missed, patients should also be instructed not to double the next dose. If more than 4 hours has elapsed since the missed dose, the patient should wait and take the next dose as previously scheduled.
Nonclinical Toxicology
Carcinogenesis, Mutagenesis, Impairment Of Fertility
Carcinogenesis
Carcinogenicity studies of quinine have not been conducted.
Mutagenesis
Genotoxicity studies of quinine were positive in the Ames bacterial mutation assay with metabolic activation and in the sister chromatid exchange assay in mice. The sex-linked recessive lethal test performed in Drosophila, the in vivo mouse micronucleus assay, and the chromosomal aberration assay in mice and Chinese hamsters were negative.
Impairment of Fertility
Published studies indicate that quinine produces testicular toxicity in mice at a single intraperitoneal dose of 300 mg/kg corresponding to a dose of approximately 0.75 times the maximum recommended human dose (MRHD; 32 mg/kg/day) and in rats at an intramuscular dose of 10 mg/kg/day, 5 days/week, for 8 weeks corresponding to a daily dose of approximately 0.05 times the MRHD based on body surface area (BSA) comparisons. The findings include atrophy or degeneration of the seminiferous tubules, decreased sperm count and motility, and decreased testosterone levels in the serum and testes. There was no effect on testes weight in studies of oral doses of up to 500 mg/kg/day in mice and 700 mg/kg/day in rats (approximately 1.2 and 3.5 times the MRHD respectively based on BSA comparisons). In a published study in 5 men receiving 600 mg of quinine TID for one week, sperm motility was decreased and percent sperm with abnormal morphology was increased; sperm count and serum testosterone were unaffected.
Use In Specific Populations
Pregnancy
Pregnancy Category C
There are extensive published data but few well-controlled studies of QUALAQUIN in pregnant women. Published data on over 1,000 pregnancy exposures to quinine did not show an increase in teratogenic effects over the background rate in the general population; however, the majority of these exposures were not in the first trimester. In developmental and reproductive toxicity studies, central nervous system (CNS) and ear abnormalities and increased fetal deaths occurred in some species when pregnant animals received quinine at doses about 1 to 4 times the human clinical dose. Quinine should be used during pregnancy only if the potential benefit justifies the potential risk to the fetus.
P. falciparum malaria carries a higher risk of morbidity and mortality in pregnant women than in the general population. Pregnant women with P. falciparum malaria have an increased incidence of fetal loss (including spontaneous abortion and stillbirth), preterm labor and delivery, intrauterine growth retardation, low birth weight, and maternal death. Therefore, treatment of malaria in pregnancy is important.
Hypoglycemia, due to increased pancreatic secretion of insulin, has been associated with quinine use, particularly in pregnant women.
Quinine crosses the placenta with measurable blood concentrations in the fetus. In 8 women who delivered live infants 1 to 6 days after starting quinine therapy, umbilical cord plasma quinine concentrations were between 1.0 and 4.6 mg/L (mean 2.4 mg/L) and the mean (±SD) ratio of cord plasma to maternal plasma quinine concentrations was 0.32 ± 0.14. Quinine levels in the fetus may not be therapeutic. If congenital malaria is suspected after delivery, the infant should be evaluated and treated appropriately.
A study from Thailand (1999) of women with P. falciparum malaria who were treated with oral quinine sulfate 10 mg/kg 3 times daily for 7 days at anytime in pregnancy reported no significant difference in the rate of stillbirths at > 28 weeks of gestation in women treated with quinine (10 of 633 women [1.6%]) as compared with a control group without malaria or exposure to antimalarial drugs during pregnancy (40 of 2201 women [1.8%]). The overall rate of congenital malformations (9 of 633 offspring [1.4%]) was not different for women who were treated with quinine sulfate compared with the control group (38 of 2201 offspring [1.7%]). The spontaneous abortion rate was higher in the control group (10.9%) than in women treated with quinine sulfate (3.5%) [OR = 3.1; 95% CI 2.1-4.7]. An epidemiologic survey that included 104 mother-child pairs exposed to quinine during the first 4 months of pregnancy, found no increased risk of structural birth defects was seen (2 fetal malformations [1.9%]). Rare and isolated case reports describe deafness and optic nerve hypoplasia in children exposed in utero due to maternal ingestion of high doses of quinine.
In animal developmental studies conducted in multiple animal species, pregnant animals received quinine by the subcutaneous or intramuscular route at dose levels similar to the maximum recommended human dose (MRHD; 32 mg/kg/day) based on body surface area (BSA) comparisons. There were increases in fetal death in utero in rabbits at maternal doses ≥ 100 mg/kg/day and in dogs at ≥ 15 mg/kg/day corresponding to dose levels approximately 0.5 and 0.25 times the MRHD respectively based on BSA comparisons. Rabbit offspring had increased rates of degenerated auditory nerve and spiral ganglion and increased rates of CNS anomalies such as anencephaly and microcephaly at a dose of 130 mg/kg/day corresponding to a maternal dose approximately 1.3 times the MRHD based on BSA comparison. Guinea pig offspring had increased rates of hemorrhage and mitochondrial change in the cochlea at maternal doses of 200 mg/kg corresponding to a dose level of approximately 1.4 times the MRHD based on BSA comparison. There were no teratogenic findings in rats at maternal doses up to 300 mg/kg/day and in monkeys at doses up to 200 mg/kg/day corresponding to doses approximately 1 and 2 times the MRHD respectively based on BSA comparisons.
In a pre-postnatal study in rats, an estimated oral dose of quinine sulfate of 20 mg/kg/day corresponding to approximately 0.1 times the MRHD based on BSA comparison resulted in offspring with impaired growth, lower body weights at birth and during the lactation period, and delayed physical development of teeth eruption and eye opening during the lactation period.
Labor And Delivery
There is no evidence that quinine causes uterine contractions at the doses recommended for the treatment of malaria. In doses several-times higher than those used to treat malaria, quinine may stimulate the pregnant uterus.
Nursing Mothers
There is limited information on the safety of quinine in breastfed infants. No toxicity was reported in infants in a single study where oral quinine sulfate (10 mg/kg every 8 hours for 1 to 10 days) was administered to 25 lactating women. It is estimated from this study that breastfed infants would receive less than 2 to 3 mg per day of quinine base ( < 0.4% of the maternal dose) via breast milk.
Although quinine is generally considered compatible with breastfeeding, the risks and benefits to infant and mother should be assessed. Caution should be exercised when administered to a nursing woman.
If malaria is suspected in the infant, appropriate evaluation and treatment should be provided. Plasma quinine levels may not be therapeutic in infants of nursing mothers receiving QUALAQUIN.
Pediatric Use
The safety and efficacy of QUALAQUIN in pediatric patients under the age of 16 has not been established.
Geriatric Use
Clinical studies of quinine sulfate did not include sufficient numbers of subjects aged 65 and over to determine whether they respond to treatment differently from younger subjects. Other reported clinical experience has not identified differences in responses between the elderly and younger patients.
Renal Impairment
Clearance of quinine is decreased in patients with severe chronic renal failure. The dosage and dosing frequency should be reduced.
Hepatic Impairment
In patients with severe hepatic impairment (Child-Pugh C), quinine oral clearance (CL/F) is decreased, volume of distribution (Vd/F) is increased, and half-life is prolonged, relative to subjects with normal liver function. Therefore, quinine is not indicated in patients with severe hepatic impairment and alternate therapy should be administered.
Close monitoring is recommended for patients with mild (Child-Pugh A) or moderate (Child-Pugh B) hepatic impairment, as exposure to quinine may be increased relative to subjects with normal liver function.
WARNINGS
Included as part of the PRECAUTIONS section.
PRECAUTIONS
Use Of QUALAQUIN For Treatment Or Prevention Of Nocturnal Leg Cramps
QUALAQUIN may cause unpredictable serious and life-threatening hematologic reactions including thrombocytopenia and hemolytic-uremic syndrome/thrombotic thrombocytopenic purpura (HUS/TTP) in addition to hypersensitivity reactions, QT prolongation, serious cardiac arrhythmias including torsades de pointes, and other serious adverse events requiring medical intervention and hospitalization. Chronic renal impairment associated with the development of TTP, and fatalities have also been reported. The risk associated with the use of QUALAQUIN in the absence of evidence of its effectiveness for treatment or prevention of nocturnal leg cramps, outweighs any potential benefit in treating and/or preventing this benign, self-limiting condition.
Thrombocytopenia
Quinine-induced thrombocytopenia is an immune-mediated disorder. Severe cases of thrombocytopenia that are fatal or life threatening have been reported, including cases of HUS/TTP. Chronic renal impairment associated with the development of TTP has also been reported. Thrombocytopenia usually resolves within a week upon discontinuation of quinine. If quinine is not stopped, a patient is at risk for fatal hemorrhage. Upon re-exposure to quinine from any source, a patient with quinine-dependent antibodies could develop thrombocytopenia that is more rapid in onset and more severe than the original episode.
QT Prolongation And Ventricular Arrhythmias
QT interval prolongation has been a consistent finding in studies which evaluated electrocardiographic changes with oral or parenteral quinine administration, regardless of age, clinical status, or severity of disease. The maximum increase in QT interval has been shown to correspond with peak quinine plasma concentration. Quinine sulfate has been rarely associated with potentially fatal cardiac arrhythmias, including torsades de pointes, and ventricular fibrillation.
QUALAQUIN has been shown to cause concentration-dependent prolongation of the PR and QRS interval. At particular risk are patients with underlying structural heart disease and preexisting conduction system abnormalities, elderly patients with sick sinus syndrome, patients with atrial fibrillation with slow ventricular response, patients with myocardial ischemia or patients receiving drugs known to prolong the PR interval (e.g. verapamil) or QRS interval (e.g. flecainide or quinidine).
QUALAQUIN is not recommended for use with other drugs known to cause QT prolongation, including Class IA antiarrhythmic agents (e.g., quinidine, procainamide, disopyramide), and Class III antiarrhythmic agents (e.g., amiodarone, sotalol, dofetilide).
The use of macrolide antibiotics such as erythromycin should be avoided in patients receiving QUALAQUIN. Fatal torsades de pointes was reported in an elderly patient who received concomitant quinine, erythromycin, and dopamine. Although a causal relationship between a specific drug and the arrhythmia was not established in this case, erythromycin is a CYP3A4 inhibitor and has been shown to increase quinine plasma levels when used concomitantly. A related macrolide antibiotic, troleandomycin, has also been shown to increase quinine exposure in a pharmacokinetic study.
Quinine may inhibit the metabolism of certain drugs that are CYP3A4 substrates and are known to cause QT prolongation, e.g., astemizole, cisapride, terfenadine, pimozide, halofantrine and quinidine. Torsades de pointes has been reported in patients who received concomitant quinine and astemizole. Therefore, concurrent use of QUALAQUIN with these medications, or drugs with similar properties, should be avoided.
Concomitant administration of QUALAQUIN with the antimalarial drugs, mefloquine or halofantrine, may result in electrocardiographic abnormalities, including QT prolongation, and increase the risk for torsades de pointes or other serious ventricular arrhythmias. Concurrent use of QUALAQUIN and mefloquine may also increase the risk of seizures.
QUALAQUIN should also be avoided in patients with known prolongation of QT interval and in patients with clinical conditions known to prolong the QT interval, such as uncorrected hypokalemia, bradycardia, and certain cardiac conditions.
Concomitant Use Of Rifampin
Treatment failures may result from the concurrent use of rifampin with QUALAQUIN, due to decreased plasma concentrations of quinine, and concomitant use of these medications should be avoided.
Concomitant Use Of Neuromuscular Blocking Agents
The use of neuromuscular blocking agents should be avoided in patients receiving QUALAQUIN. In one patient who received pancuronium during an operative procedure, subsequent administration of quinine resulted in respiratory depression and apnea. Although there are no clinical reports with succinylcholine or tubocurarine, quinine may also potentiate neuromuscular blockade when used with these drugs.
Hypersensitivity
Serious hypersensitivity reactions reported with quinine sulfate include anaphylactic shock, anaphylactoid reactions, urticaria, serious skin rashes, including Stevens-Johnson syndrome and toxic epidermal necrolysis, angioedema, facial edema, bronchospasm, and pruritus.
A number of other serious adverse reactions reported with quinine, including thrombotic thrombocytopenic purpura (TTP) and hemolytic uremic syndrome (HUS), thrombocytopenia, immune thrombocytopenic purpura (ITP), blackwater fever, disseminated intravascular coagulation, leukopenia, neutropenia, granulomatous hepatitis, and acute interstitial nephritis may also be due to hypersensitivity reactions.
QUALAQUIN should be discontinued in case of any signs or symptoms of hypersensitivity.
Atrial Fibrillation And Flutter
QUALAQUIN should be used with caution in patients with atrial fibrillation or atrial flutter. A paradoxical increase in ventricular response rate may occur with quinine, similar to that observed with quinidine. If digoxin is used to prevent a rapid ventricular response, serum digoxin levels should be closely monitored, because digoxin levels may be increased with use of quinine.
Hypoglycemia
Quinine stimulates release of insulin from the pancreas, and patients, especially pregnant women, may experience clinically significant hypoglycemia.
Patient Counseling Information
See FDA-approved patient labeling (Medication Guide)
Dosing Instructions
Patients should be instructed to:
- Take all of the medication as directed.
- Take no more of the medication than the amount prescribed.
- Take with food to minimize possible gastrointestinal irritation.
If a dose is missed, patients should also be instructed not to double the next dose. If more than 4 hours has elapsed since the missed dose, the patient should wait and take the next dose as previously scheduled.
Nonclinical Toxicology
Carcinogenesis, Mutagenesis, Impairment Of Fertility
Carcinogenesis
Carcinogenicity studies of quinine have not been conducted.
Mutagenesis
Genotoxicity studies of quinine were positive in the Ames bacterial mutation assay with metabolic activation and in the sister chromatid exchange assay in mice. The sex-linked recessive lethal test performed in Drosophila, the in vivo mouse micronucleus assay, and the chromosomal aberration assay in mice and Chinese hamsters were negative.
Impairment of Fertility
Published studies indicate that quinine produces testicular toxicity in mice at a single intraperitoneal dose of 300 mg/kg corresponding to a dose of approximately 0.75 times the maximum recommended human dose (MRHD; 32 mg/kg/day) and in rats at an intramuscular dose of 10 mg/kg/day, 5 days/week, for 8 weeks corresponding to a daily dose of approximately 0.05 times the MRHD based on body surface area (BSA) comparisons. The findings include atrophy or degeneration of the seminiferous tubules, decreased sperm count and motility, and decreased testosterone levels in the serum and testes. There was no effect on testes weight in studies of oral doses of up to 500 mg/kg/day in mice and 700 mg/kg/day in rats (approximately 1.2 and 3.5 times the MRHD respectively based on BSA comparisons). In a published study in 5 men receiving 600 mg of quinine TID for one week, sperm motility was decreased and percent sperm with abnormal morphology was increased; sperm count and serum testosterone were unaffected.
Use In Specific Populations
Pregnancy
Pregnancy Category C
There are extensive published data but few well-controlled studies of QUALAQUIN in pregnant women. Published data on over 1,000 pregnancy exposures to quinine did not show an increase in teratogenic effects over the background rate in the general population; however, the majority of these exposures were not in the first trimester. In developmental and reproductive toxicity studies, central nervous system (CNS) and ear abnormalities and increased fetal deaths occurred in some species when pregnant animals received quinine at doses about 1 to 4 times the human clinical dose. Quinine should be used during pregnancy only if the potential benefit justifies the potential risk to the fetus.
P. falciparum malaria carries a higher risk of morbidity and mortality in pregnant women than in the general population. Pregnant women with P. falciparum malaria have an increased incidence of fetal loss (including spontaneous abortion and stillbirth), preterm labor and delivery, intrauterine growth retardation, low birth weight, and maternal death. Therefore, treatment of malaria in pregnancy is important.
Hypoglycemia, due to increased pancreatic secretion of insulin, has been associated with quinine use, particularly in pregnant women.
Quinine crosses the placenta with measurable blood concentrations in the fetus. In 8 women who delivered live infants 1 to 6 days after starting quinine therapy, umbilical cord plasma quinine concentrations were between 1.0 and 4.6 mg/L (mean 2.4 mg/L) and the mean (±SD) ratio of cord plasma to maternal plasma quinine concentrations was 0.32 ± 0.14. Quinine levels in the fetus may not be therapeutic. If congenital malaria is suspected after delivery, the infant should be evaluated and treated appropriately.
A study from Thailand (1999) of women with P. falciparum malaria who were treated with oral quinine sulfate 10 mg/kg 3 times daily for 7 days at anytime in pregnancy reported no significant difference in the rate of stillbirths at > 28 weeks of gestation in women treated with quinine (10 of 633 women [1.6%]) as compared with a control group without malaria or exposure to antimalarial drugs during pregnancy (40 of 2201 women [1.8%]). The overall rate of congenital malformations (9 of 633 offspring [1.4%]) was not different for women who were treated with quinine sulfate compared with the control group (38 of 2201 offspring [1.7%]). The spontaneous abortion rate was higher in the control group (10.9%) than in women treated with quinine sulfate (3.5%) [OR = 3.1; 95% CI 2.1-4.7]. An epidemiologic survey that included 104 mother-child pairs exposed to quinine during the first 4 months of pregnancy, found no increased risk of structural birth defects was seen (2 fetal malformations [1.9%]). Rare and isolated case reports describe deafness and optic nerve hypoplasia in children exposed in utero due to maternal ingestion of high doses of quinine.
In animal developmental studies conducted in multiple animal species, pregnant animals received quinine by the subcutaneous or intramuscular route at dose levels similar to the maximum recommended human dose (MRHD; 32 mg/kg/day) based on body surface area (BSA) comparisons. There were increases in fetal death in utero in rabbits at maternal doses ≥ 100 mg/kg/day and in dogs at ≥ 15 mg/kg/day corresponding to dose levels approximately 0.5 and 0.25 times the MRHD respectively based on BSA comparisons. Rabbit offspring had increased rates of degenerated auditory nerve and spiral ganglion and increased rates of CNS anomalies such as anencephaly and microcephaly at a dose of 130 mg/kg/day corresponding to a maternal dose approximately 1.3 times the MRHD based on BSA comparison. Guinea pig offspring had increased rates of hemorrhage and mitochondrial change in the cochlea at maternal doses of 200 mg/kg corresponding to a dose level of approximately 1.4 times the MRHD based on BSA comparison. There were no teratogenic findings in rats at maternal doses up to 300 mg/kg/day and in monkeys at doses up to 200 mg/kg/day corresponding to doses approximately 1 and 2 times the MRHD respectively based on BSA comparisons.
In a pre-postnatal study in rats, an estimated oral dose of quinine sulfate of 20 mg/kg/day corresponding to approximately 0.1 times the MRHD based on BSA comparison resulted in offspring with impaired growth, lower body weights at birth and during the lactation period, and delayed physical development of teeth eruption and eye opening during the lactation period.
Labor And Delivery
There is no evidence that quinine causes uterine contractions at the doses recommended for the treatment of malaria. In doses several-times higher than those used to treat malaria, quinine may stimulate the pregnant uterus.
Nursing Mothers
There is limited information on the safety of quinine in breastfed infants. No toxicity was reported in infants in a single study where oral quinine sulfate (10 mg/kg every 8 hours for 1 to 10 days) was administered to 25 lactating women. It is estimated from this study that breastfed infants would receive less than 2 to 3 mg per day of quinine base ( < 0.4% of the maternal dose) via breast milk.
Although quinine is generally considered compatible with breastfeeding, the risks and benefits to infant and mother should be assessed. Caution should be exercised when administered to a nursing woman.
If malaria is suspected in the infant, appropriate evaluation and treatment should be provided. Plasma quinine levels may not be therapeutic in infants of nursing mothers receiving QUALAQUIN.
Pediatric Use
The safety and efficacy of QUALAQUIN in pediatric patients under the age of 16 has not been established.
Geriatric Use
Clinical studies of quinine sulfate did not include sufficient numbers of subjects aged 65 and over to determine whether they respond to treatment differently from younger subjects. Other reported clinical experience has not identified differences in responses between the elderly and younger patients.
Renal Impairment
Clearance of quinine is decreased in patients with severe chronic renal failure. The dosage and dosing frequency should be reduced.
Hepatic Impairment
In patients with severe hepatic impairment (Child-Pugh C), quinine oral clearance (CL/F) is decreased, volume of distribution (Vd/F) is increased, and half-life is prolonged, relative to subjects with normal liver function. Therefore, quinine is not indicated in patients with severe hepatic impairment and alternate therapy should be administered.
Close monitoring is recommended for patients with mild (Child-Pugh A) or moderate (Child-Pugh B) hepatic impairment, as exposure to quinine may be increased relative to subjects with normal liver function.
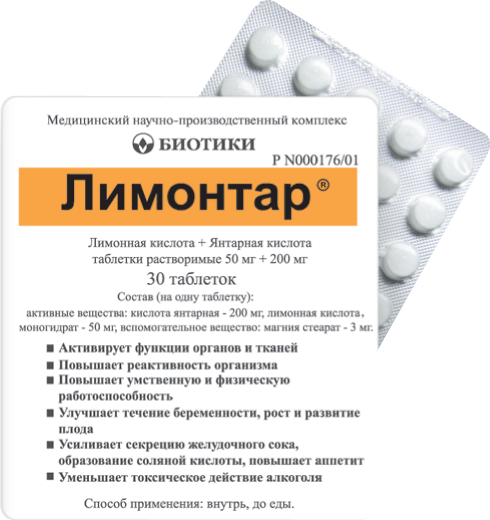
Форма выпуска, упаковка и состав
препарата Лимонтар®
Таблетки растворимые таблетки белого цвета с элементами мраморности, двояковыпуклой формы.
Вспомогательные вещества: магния стеарат — 3 мг.
30 шт. — упаковки ячейковые контурные (1) — пачки картонные.
Фармакологическое действие
Комбинированное лекарственное средство, регулятор тканевого обмена, обладает антигипоксическим и антиоксидантным свойствами, повышает аппетит, уменьшает токсическое действие этанола.
Стимулируя окислительно-восстановительные реакции, процессы дыхания и синтез АТФ, активирует физиологические функции органов и тканей (стимулирует адаптационные и компенсаторно-защитные возможности организма); повышает умственную и физическую работоспособность; улучшает течение беременности, рост и развитие плода; повышает секрецию желудочного сока, образование соляной кислоты и аппетит; уменьшает токсическое действие алкоголя.
Действие проявляется через 10-20 мин после приема внутрь.
Фармакокинетика
Янтарная и лимонная кислоты полностью метаболизируются до воды и углекислого газа, не кумулируют.
Показания активных веществ препарата
Лимонтар®
Повышение неспецифической реактивности организма в период беременности; профилактика осложнений при гипоксии и гипотрофии плода, невынашивании беременности; алкогольная интоксикация (легкой и средней тяжести); лечение запойных состояний у больных с хроническим алкоголизмом (в составе комплексной терапии); алкогольный абстинентный синдром; астеновегетативный синдром (астения, снижение работоспособности, снижение аппетита); в качестве «пробного завтрака» при исследовании секреторной и кислотообразующей функции желудка.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Препарат применяют внутрь, до еды. Перед приемом таблетку измельчают и растворяют в воде с питьевой содой или минеральной воде.
Беременным женщинам назначают по 1 таб./сут в течение 10 дней в I триместре (на сроке беременности 12-14 недель) и во II триместре (срок беременности 24-26 недель). В III триместре назначают за 10-25 дней до родов. Общая доза препарата за период беременности 5-7.5 г.
Для профилактики алкогольной интоксикации — 1 таб. препарата за 20-60 мин до приема алкоголя. При острой алкогольной интоксикации препарат назначают по 1 таб. 2-4 раза/сут с интервалом в 1-2.5 ч. Для купирования запойных состояний при хроническом алкоголизме назначают по 1 таб. 3-4 раза/сут в течение 4-10 дней, как самостоятельно, так и в комплексе с традиционными лекарственными средствами.
В качестве средства для «пробного завтрака» принимают внутрь, натощак, 1 таб. предварительно растворяют в 10-15 мл воды.
Побочное действие
Возможно: гастралгия, гиперсекреция желудочного сока (обычно эти явления проходят самостоятельно через 3-5 мин).
У лиц, склонных к артериальной гипертензии, при систематическом приеме — повышение АД.
Противопоказания к применению
Артериальная гипертензия; ИБС; стенокардия; язвенная болезнь желудка и двенадцатиперстной кишки (в фазе обострения); глаукома; поздний гестоз (тяжелая форма); повышенная чувствительность к компонентам препарата.
Применение при беременности и кормлении грудью
Беременным женщинам препарат назначают по показаниям.
Особые указания
При появлении чувства тяжести в эпигастральной области назначают после еды.
Лекарственное взаимодействие
Ослабляет действие снотворных лекарственных средств, транквилизаторов.
Регистрационный номер: Р N000176/01
Торговое наименование: Лимонтар®
Международное непатентованное или группировочное наименование: Лимонная кислота + Янтарная кислота.
Лекарственная форма: таблетки растворимые.
Состав на одну таблетку: действующие вещества: янтарная кислота – 200 мг, лимонной кислоты моногидрат – 50 мг; вспомогательное вещество: магния стеарат – 3 мг.
Описание: круглые двояковыпуклые таблетки белого или почти белого цвета.
Фармакологические свойства
Фармакотерапевтическая группа: метаболическое средство.
Код АТХ: А15.
Фармакодинамика: препарат Лимонтар® является регулятором тканевого обмена, усиливает окислительно-восстановительные процессы, образование аденозинтрифосфата (АТФ), чем обусловлены его антигипоксические и антиоксидантные свойства, за счет чего препарат обладает способностью:
- активировать функции органов и тканей,
- повышать реактивность организма,
- улучшать течение беременности, рост и развитие плода,
- повышать умственную и физическую работоспособность,
- усиливать секрецию желудочного сока, образование соляной кислоты, повышать аппетит,
- уменьшать токсическое действие алкоголя.
Действие препарата Лимонтар® проявляется через 10-20 минут после приема внутрь.
Фармакокинетика: янтарная и лимонная кислоты полностью разлагаются до воды и углекислого газа, накопления в организме не происходит.
Показания к применению.
В качестве средства для повышения неспецифической реактивности организма беременных женщин, улучшения его адаптационных и компенсаторно-защитных возможностей в целях профилактики осложнений при гипоксии, гипотрофии плода, при невынашивании беременности.
В качестве «пробного завтрака» при исследовании секреторной и кислотообразующей функции желудка (диагностическая значимость лекарственного препарата Лимонтар® и гистамина равноценна).
Для профилактики алкогольного опьянения; при лечении острого алкогольного опьянения легкой и средней степени тяжести для уменьшения токсического влияния алкоголя и постинтоксикационных расстройств; в комплексной терапии для лечения запойных состояний у больных с хроническим алкоголизмом.
В период алкогольного абстинентного синдрома, для комплексного лечения астеновегетативных расстройств (общая слабость, снижение работоспособности, аппетита).
Противопоказания: повышенная чувствительность к компонентам препарата, артериальная гипертензия, ишемическая болезнь сердца (в т.ч. стенокардия), глаукома, язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, поздний гестоз (тяжелая форма).
Применение при беременности и в период грудного вскармливания:
Применение препарата при беременности возможно в первом триместре (на сроке беременности 12-14 недель), втором триместре (на сроке беременности 24-26 недель) и третьем триместре (за 10-25 дней до родов), по рекомендации врача акушера-гинеколога (см. разделы «Показания к применению», «Способ применения и дозы»).
Применение препарата в период грудного вскармливания не рекомендуется (в связи с отсутствием результатов исследований эффективности и безопасности применения препарата в данный период).
Способ применения и дозы
Применяют внутрь до еды. Перед приемом таблетку измельчают и растворяют в питьевой воде с пищевой содой (сода – на кончике ножа) либо в минеральной воде.
Беременным женщинам препарат Лимонтар® назначают в первом триместре (на сроке беременности 12-14 недель), во втором триместре (на сроке беременности 24-26 недель) и в третьем триместре (за 10-25 дней до родов) по 1 таблетке в день в течение 10 дней. Общая доза препарата Лимонтар® за период беременности 5-7,5 г.
При назначении в качестве «пробного завтрака» для исследования секреторной и кислотообразующей функции желудка принимают внутрь, натощак 1 таблетку, предварительно растворив в 10-15 мл воды.
В качестве средства для профилактики алкогольного опьянения – 1 таблетка препарата Лимонтар® за 20-60 мин до приема алкоголя.
В состоянии острого алкогольного опьянения препарат назначают по 1 таблетке 2-4 раза в сутки с интервалом в 1-2,5 часа.
При купировании запойных состояний препарат Лимонтар® назначают по 1 таблетке 3-4 раза в сутки в течение 4-10 дней, как самостоятельно, так и на фоне стандартной терапии.
При появлении чувства тяжести в подложечной области препарат Лимонтар® назначают после еды.
Побочное действие: возможно появление болей в подложечной области (обычно эти явления проходят самостоятельно через 3-5 мин); аллергические реакции; повышение секреции желудочного сока; повышение артериального давления.
Передозировка: до настоящего времени случаев передозировки не зарегистрировано.
Взаимодействие с другими лекарственными средствами: ослабляет действие снотворных лекарственных средств, транквилизаторов.
Особые указания: перед применением таблетку необходимо растворить.
Влияние на способность управлять транспортными средствами, механизмами:
Применение препарата не оказывает влияния на способность к выполнению потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций (управление транспортными средствами, работа с движущимися механизмами, работа диспетчера, оператора).
Форма выпуска: таблетки растворимые 50 мг + 200 мг. По 30 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой. По 1 контурной ячейковой упаковке вместе с инструкцией по применению в пачку из картона.
Условия хранения: при температуре не выше 25 °С в оригинальной упаковке (контурная ячейковая упаковка в пачке).
Хранить в недоступном для детей месте.
Срок годности: 3 года. Не применять по истечении срока годности.
Условия отпуска: отпускают без рецепта.
Наименование и адрес места производства лекарственного препарата / организации, принимающей претензии от потребителя: ООО «Медицинский научно-производственный комплекс «БИОТИКИ». Россия, 115404, г. Москва, ул. 6-я Радиальная, д. 24, стр. 1, 2, 14, 15.
Тел.: +7 (495) 327-86-30.
Телефон бесплатной горячей линии: 8-800-100-32-22.
Описание препарата Лимонтар® (таблетки растворимые, 50 мг+200 мг) основано на официальной инструкции, утверждено компанией-производителем в 2014 году
Дата согласования: 10.04.2014
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Лимонтар®
- Заказ в аптеках Москвы
Фотографии упаковок
10.04.2014
Действующее вещество
ATX
Фармакологическая группа
Нозологическая классификация (МКБ-10)
Список кодов МКБ-10
- F06.6 Органическое эмоционально лабильное [астеническое] расстройство
- F10.0 Острая интоксикация алкоголем
- F10.2 Синдром алкогольной зависимости
- F10.3 Абстинентное состояние
- G90 Расстройства вегетативной [автономной] нервной системы
- K94* Диагностика заболеваний ЖКТ
- O26.2 Медицинская помощь женщине с привычным невынашиванием беременности
- P05 Замедленный рост и недостаточность питания плода
- P20 Внутриутробная гипоксия
- R53 Недомогание и утомляемость
- R63.0 Анорексия
- T51 Токсическое действие алкоголя
- Z73.0 Переутомление
- Z73.6 Ограничения деятельности, вызванные снижением трудоспособности
Состав
| Таблетки растворимые | 1 табл. |
| активные вещества: | |
| кислота янтарная | 200 мг |
| лимонная кислота, моногидрат | 50 мг |
| вспомогательные вещества: магния стеарат — 3 мг |
Описание лекарственной формы
Таблетки белого цвета с элементами мраморности, двояковыпуклой формы.
Фармакологическое действие
Фармакологическое действие
—
метаболическое, антиоксидантное, антиалкогольное.
Фармакодинамика
Лимонтар® является регулятором тканевого обмена, усиливает окислительно-восстановительные процессы, образование АТФ, чем обусловлены его антигипоксические и антиоксидантные свойства, и способность препарата:
— активировать функции органов и тканей;
— повышать реактивность организма;
— повышать умственную и физическую работоспособность;
— улучшать течение беременности, рост и развитие плода;
— усиливать секрецию желудочного сока, образование соляной кислоты, повышать аппетит;
— уменьшать токсическое действие алкоголя.
Действие препарата Лимонтар® проявляется через 10–20 мин после приема внутрь.
Фармакокинетика
Янтарная и лимонная кислоты полностью метаболизируются до воды и углекислого газа, накопление в организме не происходит.
Показания
- повышение неспецифической реактивности организма беременных женщин, улучшение адаптационных и компенсаторно-защитных возможностей в целях профилактики осложнений при гипоксии и гипотрофии плода, при невынашивании беременности;
- профилактика опьянения;
- уменьшение токсического влияния алкоголя при остром алкогольном опьянении легкой и средней тяжести и постинтоксикационных расстройствах;
- комплексная терапия запойных состояний у больных хроническим алкоголизмом и астеновегетативных расстройств (выраженная общая слабость, снижение работоспособности, аппетита) в период алкогольного абстинентного синдрома;
- в качестве «пробного завтрака» при исследовании секреторной и кислотообразующей функции желудка.
Противопоказания
- гиперчувствительность;
- артериальная гипертензия;
- ишемическая болезнь сердца (в т.ч. стенокардия);
- глаукома;
- язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения;
- поздний гестоз (тяжелая форма).
Способ применения и дозы
Реклама: ООО «РЛС-Библиомед», ИНН 7714758963, erid=4CQwVszH9pUmKjt23pm
Внутрь, до еды. Перед приемом таблетку измельчают и растворяют в воде с питьевой содой (сода — на кончике ножа). Для растворения можно использовать минеральную воду.
Беременным Лимонтар® назначают по 1 табл. в день в течение 10 дней в I триместре (на сроке беременности 12–14 нед) и во II триместре (срок беременности 24–26 нед). В III триместре назначают за 10–25 дней до родов. Общая доза препарата Лимонтар® за период беременности — 5–7,5 г.
В качестве средства для профилактики опьянения — 1 табл. препарата Лимонтар® за 20–60 мин до приема алкоголя.
В состоянии острого алкогольного опьянения препарат назначают по 1 табл. 2–4 раза в сутки с интервалом в 1–2,5 ч.
При купировании запойных состояний Лимонтар® назначают по 1 табл. 3–4 раза в сутки в течение 4–10 дней, как самостоятельно, так и в комплексе с традиционными ЛС.
При назначении в качестве «пробного завтрака» для исследования секреторной и кислотообразующей функции желудка принимают внутрь, натощак 1 табл., предварительно растворив в 10–15 мл воды.
При появлении чувства тяжести в подложечной области, Лимонтар® назначают после еды.
Побочные действия
Возможно появление болей в подложечной области (обычно эти явления проходят самостоятельно через 3–5 мин), повышенная секреция желудочного сока. У лиц, склонных к артериальной гипертензии, после приема препарата может повышаться АД.
Взаимодействие
Ослабляет действие снотворных ЛС, транквилизаторов.
Форма выпуска
Таблетки растворимые, 50 мг + 200 мг. По 30 табл. в контурной ячейковой упаковке, в пачке картонной 1 упаковка.
Производитель
ООО «Медицинский научно-производственный комплекс «БИОТИКИ». Россия, 115404, Москва, ул. 6-я Радиальная, 24, стр.14.
Тел.: + 7(495)327-53-53.
Условия отпуска из аптек
Без рецепта.
Условия хранения
При температуре не выше 25 °C, в оригинальной упаковке (контурная ячейковая упаковка в пачке).
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Дата обновления: 31.07.2023
Аналоги (синонимы) препарата Лимонтар®
Аналоги по действующему веществу не найдены.
Заказ в аптеках
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Посмотреть перевод в
Google,
Yandex,
Bing
Allgemeine Informationen zu Limptar® N
Zusammensetzung von Limptar® N
1 Tabl. enthält
Wirkstoffe
- 165.74 mg Chinin
- 200 mg Chinin hemisulfat-2-Wasser
Hilfsstoffe
- Magnesium stearat
- Rizinusöl, raffiniertes
- Siliciumdioxid, hochdisperses
- Cellulose, mikrokristalline
- Butylmethacrylat-Copolymer, basisches
- Gelatine
- Carmellose natrium
- Talkum
Anwendungsgebiete von Limptar® N
Muskelentkrampfendes Mittel bei Wadenkrämpfen. Wird angewendet zur Verhütung und Behandlung nächtlicher Wadenkrämpfe.
Dosierung von Limptar® N
Falls vom Arzt nicht anders verordnet, ist die übliche Dosis:
Bei leichten Beschwerden 1 Filmtablette pro Tag, bei einem mittleren bis schweren Beschwerdebild 2 Filmtabletten pro Tag.
Behandlungsdauer:
Bei leichten Beschwerden kann die Dauer der Behandlung in Abhängigkeit vom Beschwerdebild ca. 2-3 Wochen betragen. Bei einem mittleren bis schweren Beschwerdebild sollte die Einnahme über einen Zeitraum von ca. 14 Tagen erfolgen. Anschließend kann der Versuch einer Dosisreduktion auf eine Filmtablette pro Tag vorgenommen werden. Die Behandlung kann noch 2-3 Wochen fortgesetzt werden.
Tritt nach Absetzen des Präparates oder Verringerung der Dosis eine Verschlechterung des Beschwerdebildes ein, was besonders bei den Patienten geschehen kann, bei denen sich die Ursache der nächtlichen Wadenkrämpfe nicht oder nur schwer beheben lässt, so kann entweder die Dosis erhöht werden oder die Therapiedauer über längere Zeiträume hindurch fortgesetzt werden.
Hinweis für Dialysepatienten:
Chinin kann zur Behandlung von Wadenkrämpfen bei Dialysepatienten gegeben werden. Die Dosierung entspricht der vorher genannten.
Überdosierung:
Wenn Sie eine größere Menge eingenommen haben, als Sie sollten, unterbrechen Sie die Einnahme und wenden Sie sich an Ihren Arzt.
Vergessene Anwendung:
Nehmen Sie nicht die doppelte Dosis ein, wenn Sie die vorherige Einnahme vergessen haben.
Wechselwirkungen von Limptar® N
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen / anwenden bzw. vor kurzem eingenommen / angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Chinin kann die Wirkung von Digitalis-Präparaten, Muskelrelaxanzien (muskelentspannende Arzneimittel) und Antikoagulanzien (Hemmern der Blutgerinnung) verstärken. Antazida (Al-, Mg-haltige Arzneimittel zur Neutralisation der Magensäure) können die Chinin-Resorption vermindern, mit anderen Chinin-haltigen Arzneimitteln (Antimalariamedikamenten, Mittel zur Behandlung von Herzrhythmusstörungen) kann es zur gegenseitigen Wirkungsverstärkung kommen, harnalkalisierende Mittel können die Chinin- Ausscheidung verzögern.
Andere Arzneimittel, die von sich aus häufiger zu unerwünschten Herzrhythmusstörungen führen können, dürfen nicht zusammen mit Chinin eingenommen werden.
Hierbei handelt es sich um bestimmte Arzneimittel:
— zur Behandlung von Herzrhythmusstörungen (Antiarrhythmika der Klasse Ia und III)
— Arzneimittel zur Behandlung psychischer Erkrankungen (Neuroleptika, tri- und tetrazyklische Antidepressiva)
— einige Antibiotika (einige Makrolid-Antibiotika, Fluorchinolone, Imidazol-Antimykotika) einige Antimalariamittel
— einige Arzneimittel zur Chemotherapie bei Tumorerkrankungen (z.B. Arsentrioxid)
— einige Arzneimittel zur Behandlung von allergischen Erkrankungen (einige nicht-sedierende Antihistaminika, wie z.B. Terfenadin, Ebastin)
— einige starke Schmerzmittel vom Opioidtyp (z.B. Methadon).
Nebenwirkungen von Limptar® N
Zu Nebenwirkungen kann es besonders bei Überdosierung bzw. individueller Überempfindlichkeit kommen.
Sehr selten: Die Einnahme von Chinin kann in vereinzelten Fällen zu Magen-Darm-Störungen mit Übelkeit, Erbrechen und Durchfällen führen. Chinin kann in Einzelfällen Ohrensausen, Schwindel und Überempfindlichkeitsreaktionen wie z.B. Hautreaktionen (Juckreiz, Hautausschläge), Arzneimittelfieber, zum Teil mit Blutbildveränderungen, Atemnot (Bronchospasmen) und Leberfunktionsstörungen hervorrufen.
In sehr seltenen Fällen kann es zum Auftreten kleinster Blutungen (thrombozytopenische Purpura) mit Blutergüssen oder Petechien kommen. Dies ist ein Hinweis für eine besondere allergische Empfindlichkeit auf Chinin (die dann auch für chininhaltige Lebensmittel gilt), die von der eigentlichen Chinindosis unabhängig ist. Diese wiederum kann extrem selten mit disseminierter intravaskulärer Gerinnung (DIC, Gerinnungsstörung) oder Nierenversagen einhergehen. Nach Absetzen jeglicher Einnahme von Chinin bilden sich die Blutergüsse wieder zurück. Das Arzneimittel ist abzusetzen, falls Klingen in den Ohren, Hör- und Sehstörungen sowie Hautausschlag auftreten.
Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht angegeben sind.
Gegenanzeigen zu Limptar® N
Darf nicht eingenommen werden:
— wenn Sie überempfindlich (allergisch) gegen Chininsulfat oder einen der sonstigen Bestandteile sind.
— wenn Sie schwanger sind.
— wenn Sie unter angeborenen oder erworbenen Herzrhythmusstörungen leiden, insbesondere wenn diese mit einer Verlangsamung des Herzschlags einhergehen oder, wenn Sie andere Arzneimittel einnehmen müssen, die die Entstehung von Herzrhythmusstörungen begünstigen können.
Weiterhin darf das Arzneimittel nicht bei den sehr seltenen Erkrankungen Glucose-6-Phosphat-Dehydrogenasemangel (Symptom: hämolytische Anämie) und Myasthenia gravis (Muskelschwäche) eingenommen werden, ebenso nicht bei bekannten Ohrgeräuschen (Klingen in den Ohren; Tinnitus) und Vorschädigungen des Sehnervs.
Schwangerschaft und Stillzeit zu Limptar® N
Fragen Sie vor der Einnahme /Anwendung von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat.
Chinin, der Wirkstoff des Arzneimittels, kann in hohen Dosen schwerwiegende Schädigungen des Ungeborenen verursachen, wenn es während der Schwangerschaft eingenommen wird. Sie dürfen das Arzneimittel während der Schwangerschaft nicht einnehmen.
Da Chinin, der Wirkstoff, in die Muttermilch übergeht, sollen Sie das Arzneimittel während der Stillzeit nicht einnehmen.
Anwendung zu Limptar® N
Bei leichten Beschwerden sollte 1 Filmtablette unzerkaut mit reichlich Flüssigkeit nach dem Abendessen eingenommen werden (vorzugsweise ein Glas Trinkwasser [200 ml]).
Bei einem mittleren bis schweren Beschwerdebild sollte nach dem Abendessen und vor dem Schlafengehen jeweils 1 Filmtablette unzerkaut mit reichlich Flüssigkeit eingenommen werden.
Patientenhinweise zu Limptar® N
Bei Störungen des Salzhaushaltes (z.B. Verminderung von Kalium im Blut) etwa durch Erbrechen, Durchfall oder Medikamente sind ebenso wie bei Veränderungen der anderen eingenommenen Arzneimittel entsprechende EKG-Kontrollen und ggf. Blutuntersuchungen durchzuführen.
Kommt es unter Behandlung zum Auftreten von Herzstolpern, Schwindel oder Ohnmachtzuständen, die Zeichen für Herzrhythmusstörungen sein können, sollte eine Untersuchung des Patienten erfolgen (einschließlich EKG).
Verkehrstüchtigkeit und das Bedienen von Maschinen:
Es sind keine besonderen Vorsichtsmaßnahmen erforderlich.
Arzneimittel für Kinder unzugänglich aufbewahren.
Allgemeine Informationen zu Limptar® N
Zusammensetzung von Limptar® N
1 Tabl. enthält
Wirkstoffe
- 165.74 mg Chinin
- 200 mg Chinin hemisulfat-2-Wasser
Hilfsstoffe
- Magnesium stearat
- Rizinusöl, raffiniertes
- Siliciumdioxid, hochdisperses
- Cellulose, mikrokristalline
- Butylmethacrylat-Copolymer, basisches
- Gelatine
- Carmellose natrium
- Talkum
Anwendungsgebiete von Limptar® N
Muskelentkrampfendes Mittel bei Wadenkrämpfen. Wird angewendet zur Verhütung und Behandlung nächtlicher Wadenkrämpfe.
Dosierung von Limptar® N
Falls vom Arzt nicht anders verordnet, ist die übliche Dosis:
Bei leichten Beschwerden 1 Filmtablette pro Tag, bei einem mittleren bis schweren Beschwerdebild 2 Filmtabletten pro Tag.
Behandlungsdauer:
Bei leichten Beschwerden kann die Dauer der Behandlung in Abhängigkeit vom Beschwerdebild ca. 2-3 Wochen betragen. Bei einem mittleren bis schweren Beschwerdebild sollte die Einnahme über einen Zeitraum von ca. 14 Tagen erfolgen. Anschließend kann der Versuch einer Dosisreduktion auf eine Filmtablette pro Tag vorgenommen werden. Die Behandlung kann noch 2-3 Wochen fortgesetzt werden.
Tritt nach Absetzen des Präparates oder Verringerung der Dosis eine Verschlechterung des Beschwerdebildes ein, was besonders bei den Patienten geschehen kann, bei denen sich die Ursache der nächtlichen Wadenkrämpfe nicht oder nur schwer beheben lässt, so kann entweder die Dosis erhöht werden oder die Therapiedauer über längere Zeiträume hindurch fortgesetzt werden.
Hinweis für Dialysepatienten:
Chinin kann zur Behandlung von Wadenkrämpfen bei Dialysepatienten gegeben werden. Die Dosierung entspricht der vorher genannten.
Überdosierung:
Wenn Sie eine größere Menge eingenommen haben, als Sie sollten, unterbrechen Sie die Einnahme und wenden Sie sich an Ihren Arzt.
Vergessene Anwendung:
Nehmen Sie nicht die doppelte Dosis ein, wenn Sie die vorherige Einnahme vergessen haben.
Wechselwirkungen von Limptar® N
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen / anwenden bzw. vor kurzem eingenommen / angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Chinin kann die Wirkung von Digitalis-Präparaten, Muskelrelaxanzien (muskelentspannende Arzneimittel) und Antikoagulanzien (Hemmern der Blutgerinnung) verstärken. Antazida (Al-, Mg-haltige Arzneimittel zur Neutralisation der Magensäure) können die Chinin-Resorption vermindern, mit anderen Chinin-haltigen Arzneimitteln (Antimalariamedikamenten, Mittel zur Behandlung von Herzrhythmusstörungen) kann es zur gegenseitigen Wirkungsverstärkung kommen, harnalkalisierende Mittel können die Chinin- Ausscheidung verzögern.
Andere Arzneimittel, die von sich aus häufiger zu unerwünschten Herzrhythmusstörungen führen können, dürfen nicht zusammen mit Chinin eingenommen werden.
Hierbei handelt es sich um bestimmte Arzneimittel:
— zur Behandlung von Herzrhythmusstörungen (Antiarrhythmika der Klasse Ia und III)
— Arzneimittel zur Behandlung psychischer Erkrankungen (Neuroleptika, tri- und tetrazyklische Antidepressiva)
— einige Antibiotika (einige Makrolid-Antibiotika, Fluorchinolone, Imidazol-Antimykotika) einige Antimalariamittel
— einige Arzneimittel zur Chemotherapie bei Tumorerkrankungen (z.B. Arsentrioxid)
— einige Arzneimittel zur Behandlung von allergischen Erkrankungen (einige nicht-sedierende Antihistaminika, wie z.B. Terfenadin, Ebastin)
— einige starke Schmerzmittel vom Opioidtyp (z.B. Methadon).
Nebenwirkungen von Limptar® N
Zu Nebenwirkungen kann es besonders bei Überdosierung bzw. individueller Überempfindlichkeit kommen.
Sehr selten: Die Einnahme von Chinin kann in vereinzelten Fällen zu Magen-Darm-Störungen mit Übelkeit, Erbrechen und Durchfällen führen. Chinin kann in Einzelfällen Ohrensausen, Schwindel und Überempfindlichkeitsreaktionen wie z.B. Hautreaktionen (Juckreiz, Hautausschläge), Arzneimittelfieber, zum Teil mit Blutbildveränderungen, Atemnot (Bronchospasmen) und Leberfunktionsstörungen hervorrufen.
In sehr seltenen Fällen kann es zum Auftreten kleinster Blutungen (thrombozytopenische Purpura) mit Blutergüssen oder Petechien kommen. Dies ist ein Hinweis für eine besondere allergische Empfindlichkeit auf Chinin (die dann auch für chininhaltige Lebensmittel gilt), die von der eigentlichen Chinindosis unabhängig ist. Diese wiederum kann extrem selten mit disseminierter intravaskulärer Gerinnung (DIC, Gerinnungsstörung) oder Nierenversagen einhergehen. Nach Absetzen jeglicher Einnahme von Chinin bilden sich die Blutergüsse wieder zurück. Das Arzneimittel ist abzusetzen, falls Klingen in den Ohren, Hör- und Sehstörungen sowie Hautausschlag auftreten.
Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht angegeben sind.
Gegenanzeigen zu Limptar® N
Darf nicht eingenommen werden:
— wenn Sie überempfindlich (allergisch) gegen Chininsulfat oder einen der sonstigen Bestandteile sind.
— wenn Sie schwanger sind.
— wenn Sie unter angeborenen oder erworbenen Herzrhythmusstörungen leiden, insbesondere wenn diese mit einer Verlangsamung des Herzschlags einhergehen oder, wenn Sie andere Arzneimittel einnehmen müssen, die die Entstehung von Herzrhythmusstörungen begünstigen können.
Weiterhin darf das Arzneimittel nicht bei den sehr seltenen Erkrankungen Glucose-6-Phosphat-Dehydrogenasemangel (Symptom: hämolytische Anämie) und Myasthenia gravis (Muskelschwäche) eingenommen werden, ebenso nicht bei bekannten Ohrgeräuschen (Klingen in den Ohren; Tinnitus) und Vorschädigungen des Sehnervs.
Schwangerschaft und Stillzeit zu Limptar® N
Fragen Sie vor der Einnahme /Anwendung von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat.
Chinin, der Wirkstoff des Arzneimittels, kann in hohen Dosen schwerwiegende Schädigungen des Ungeborenen verursachen, wenn es während der Schwangerschaft eingenommen wird. Sie dürfen das Arzneimittel während der Schwangerschaft nicht einnehmen.
Da Chinin, der Wirkstoff, in die Muttermilch übergeht, sollen Sie das Arzneimittel während der Stillzeit nicht einnehmen.
Anwendung zu Limptar® N
Bei leichten Beschwerden sollte 1 Filmtablette unzerkaut mit reichlich Flüssigkeit nach dem Abendessen eingenommen werden (vorzugsweise ein Glas Trinkwasser [200 ml]).
Bei einem mittleren bis schweren Beschwerdebild sollte nach dem Abendessen und vor dem Schlafengehen jeweils 1 Filmtablette unzerkaut mit reichlich Flüssigkeit eingenommen werden.
Patientenhinweise zu Limptar® N
Bei Störungen des Salzhaushaltes (z.B. Verminderung von Kalium im Blut) etwa durch Erbrechen, Durchfall oder Medikamente sind ebenso wie bei Veränderungen der anderen eingenommenen Arzneimittel entsprechende EKG-Kontrollen und ggf. Blutuntersuchungen durchzuführen.
Kommt es unter Behandlung zum Auftreten von Herzstolpern, Schwindel oder Ohnmachtzuständen, die Zeichen für Herzrhythmusstörungen sein können, sollte eine Untersuchung des Patienten erfolgen (einschließlich EKG).
Verkehrstüchtigkeit und das Bedienen von Maschinen:
Es sind keine besonderen Vorsichtsmaßnahmen erforderlich.
Arzneimittel für Kinder unzugänglich aufbewahren.


