Состав:
Применение:
Противоаллергическое,Антиконгестивное,Антиэкссудативное,Противовоспалительное,Противозудное,Кортикостероиды, Дерматологические Препараты,Препараты Для Лечения Обструктивных Заболеваний Дыхательных Путей,Глюкокортикоидное,Глюкокортикоидное (Местное),Назальные Препараты
Применяется при лечении:
Астма,Атопический дерматит,Бляшковый Псориаз,Дерматит,Дерматит,Атопический,Зуд,Носовой полип,Псориаз,Ринит,Риносинусит
Страница осмотрена фармацевтом Коваленко Светланой Олеговной Последнее обновление 2022-03-21

Внимание!
Информация на странице предназначена только для медицинских работников!
Информация собрана в открытых источниках и может содержать значимые ошибки!
Будьте внимательны и перепроверяйте всю информацию с этой страницы!
Топ 20 лекарств с такими-же компонентами:
Топ 20 лекарств с таким-же применением:
Название медикамента
Предоставленная в разделе Название медикамента Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Название медикамента
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
Nazofix
Состав
Предоставленная в разделе Состав Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Состав
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
Mometasone Furoate
Терапевтические показания
Предоставленная в разделе Терапевтические показания Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Терапевтические показания
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
Крем; Крем для наружного применения; Кожное решение; Лосьон; Мазь; Мазь для наружного применения
Спрей назальный; Таблетки
Спрей назальный дозированный
Раствор для наружного применения
Ослабление и ликвидация воспалительных явлений и зуда при дерматозах, поддающихся глюкокортикостероидной терапии у взрослых и детей в возрасте от 2 лет.
лечение аллергического ринита (сезонного и круглогодичного) у взрослых, подростков и детей с 2 лет;
обострение синусита (комплексная терапия с антибиотиками) у взрослых (в т.ч. старческого возраста) и детей с 12 лет;
профилактика сезонного аллергического ринита среднетяжелого и тяжелого течения (рекомендуется за 2–4 нед до предполагаемого начала сезона пыления).
сезонный и круглогодичный аллергические риниты у взрослых, подростков и детей с 2-летнего возраста;
острый синусит или обострение хронического синусита у взрослых (в т.ч. пожилого возраста) и подростков с 12 лет (в качестве вспомогательного терапевтического средства при лечении антибиотиками);
острый риносинусит с легкими и умеренно выраженными симптомами без признаков тяжелой бактериальной инфекции у пациентов от 12 лет и более;
профилактическое лечение сезонного аллергического ринита среднетяжелого и тяжелого течения у взрослых и подростков с 12 лет (рекомендуется за 2–4 нед до предполагаемого начала сезона пыления);
полипоз носа, сопровождаемый нарушением носового дыхания и обоняния у взрослых (от 18 лет).
Воспалительные явления и зуд при дерматозах, поддающихся ГКС-терапии (в т.ч. псориаз), с поражением волосистых участков кожных покровов (для лечения других участков кожи могут применяться Элоком® мазь и Элоком® крем).
Способ применения и дозы
Предоставленная в разделе Способ применения и дозы Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Способ применения и дозы
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
Крем; Крем для наружного применения; Кожное решение; Лосьон; Мазь; Мазь для наружного применения
Спрей назальный; Таблетки
Спрей назальный дозированный
Раствор для наружного применения
Местно.
Элоком®
Крем или мазь наносят тонким слоем на пораженные участки кожи 1 раз в день.
Лосьон — наносят несколько капель на пораженные участки кожи 1 раз в день; после нанесения лосьон втирают мягкими движениями до исчезновения его с поверхности кожи. Для наиболее эффективного и экономичного использования препарата необходимо поднести носик флакона поближе к пораженному участку кожи и слегка сжать флакон.
Элоком® Лосьон
Лосьон — наносят несколько капель на пораженные участки кожи 1 раз в день; после нанесения лосьон втирают мягкими движениями до исчезновения его с поверхности кожи. Для наиболее эффективного и экономичного использования препарата необходимо поднести носик флакона поближе к пораженному участку кожи и слегка сжать флакон.
Продолжительность курса лечения определяется его эффективностью, а также переносимостью пациентом, наличием и выраженностью побочных эффектов.
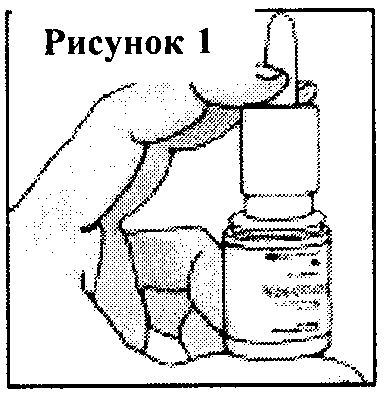
Интраназально. Nazofix® применяется в виде интраназальных ингаляций суспензии, содержащейся во флаконе спрея. Ингаляции осуществляются при помощи специальной дозирующей насадки на флаконе.
Перед первым применением назального спрея Nazofix® необходимо провести его «калибровку» путем нажатия дозирующего устройства 6–7 раз. После «калибровки» устанавливается стереотипная подача лекарственного вещества, при которой с каждым нажатием кнопки происходит выброс приблизительно 100 мг суспензии мометазона фуроата, содержащей моногидрат мометазона фуроата в количестве, эквивалентном 50 мкг химически чистого мометазона фуроата. Если назальный спрей не использовался в течение 14 дней или дольше, перед новым применением необходима повторная «калибровка».
Перед каждым использованием необходимо энергично встряхивать флакон спрея.
Лечение сезонного или круглогодичного аллергического ринита
Взрослым (в т.ч. старческого возраста) и подросткам с 12 лет обычно рекомендуемая профилактическая и терапевтическая доза препарата составляет 2 ингаляции (по 50 мкг каждая) в каждую ноздрю, однократно (общая суточная доза 200 мкг). После достижения желаемого лечебного эффекта для поддерживающей терапии целесообразно уменьшение дозы до 1 ингаляции в каждую ноздрю 1 раз в день (общая суточная доза 100 мкг).
В случае, если уменьшения симптомов заболевания не удалось достичь применением препарата в рекомендуемой терапевтической дозе, суточная доза может быть увеличена до 4 ингаляций в каждую ноздрю 1 раз в день (общая суточная доза 400 мкг). После уменьшения симптомов заболевания рекомендуется снижение дозы.
Начало действия препарата обычно отмечается клинически в течение первых 12 ч после первого применения препарата.
Дети 2–11 лет: рекомендуемая терапевтическая доза — 1 ингаляция (50 мкг) в каждую ноздрю один раз в день (общая суточная доза — 100 мкг).
Вспомогательное лечение обострений синуситов
Взрослым (в т.ч. старческого возраста) и подросткам с 12 лет: рекомендуемая терапевтическая доза составляет 2 ингаляции (по 50 мкг) в каждую ноздрю 2 раза в день (общая суточная доза 400 мкг).
В случае, если уменьшения симптомов заболевания не удалось достичь применением препарата в рекомендуемой терапевтической дозе, суточная доза может быть увеличена до 4 ингаляций в каждую ноздрю 2 раза в день (общая суточная доза — 800 мкг). После уменьшения симптомов заболевания рекомендуется снижение дозы.
После 12-месячного лечения назальным спреем Nazofix® не возникало признаков атрофии слизистой носа; кроме того, мометазона фуроат проявлял тенденцию способствовать нормализации гистологической картины при исследовании биоптатов слизистой носа.
Интраназально. Ингаляция суспензии, содержащейся во флаконе, осуществляется при помощи специальной дозирующей насадки на флаконе.
Перед первым применением назального спрея Nazofix необходимо провести его калибровку. Не прокалывать носовой аппликатор. Для проведения калибровки необходимо нажимать на дозирующую насадку, до тех пор, пока не появятся брызги (до 10 раз), что свидетельствует о готовности препарата к использованию.
Если лекарственный препарат не использовался в течение 14 дней или большего промежутка времени, необходимо нажимать на дозирующую насадку, до тех пор, пока не появятся брызги (2 раза).
Наклонить голову и впрыснуть ЛС в каждую ноздрю так, как рекомендовал лечащий врач.
Чистка дозирующей насадки. Важно регулярно чистить дозирующую насадку, чтобы избежать ее неправильной работы. Снять колпачок, защищающий насадку от пыли, затем аккуратно снять наконечник для распыления. Промыть тщательно наконечник для распыления и колпачок для защиты от пыли в теплой воде и ополоснуть под краном.
Не пытаться открыть назальный аппликатор с помощью иголки или другого острого предмета, т.к. это приведет к повреждению аппликатора, в результате чего возможен прием неправильной дозы препарата.
Высушить колпачок и наконечник в теплом месте. После этого прикрепить наконечник для распыления на флакон и снова прикрутить к флакону колпачок для защиты от пыли. При первом использовании назального спрея после очистки необходимо провести калибровку путем нажатия на дозирующую насадку 2 раза.
Перед каждым использованием необходимо интенсивно встряхивать флакон.
Лечение сезонного или круглогодичного аллергического ринита
Взрослые (в т.ч. пожилого возраста) и подростки с 12 лет. Рекомендуемая профилактическая и терапевтическая доза препарата составляет 2 ингаляции (по 50 мкг каждая) в каждую ноздрю 1 раз в день (суммарная суточная доза — 200 мкг). По достижении лечебного эффекта для поддерживающей терапии возможно уменьшение дозы до 1 ингаляции в каждую ноздрю 1 раз в день (суммарная суточная доза — 100 мкг). В случае, если уменьшения симптомов заболевания не удается достичь применением препарата в рекомендуемой терапевтической дозе, суточная доза может быть увеличена до 4 ингаляций в каждую ноздрю 1 раз в день (суммарная суточная доза — 400 мкг). После уменьшения симптомов заболевания рекомендуется снижение дозы. Начало действия препарата обычно отмечается клинически уже через 12 ч после первого применения препарата.
Дети 2–11 лет. Рекомендуемая терапевтическая доза — 1 ингаляция (50 мкг) в каждую ноздрю 1 раз в день (суммарная суточная доза — 100 мкг). Для применения препарата у детей младшего возраста требуется помощь взрослых.
Вспомогательное лечение острого синусита или обострения хронического синусита
Взрослые (в т.ч. пожилого возраста) и подростки с 12 лет. Рекомендуемая профилактическая и терапевтическая доза препарата составляет 2 ингаляции (по 50 мкг каждая) в каждую ноздрю 2 раза в день (суммарная суточная доза — 400 мкг). В случае если уменьшения симптомов заболевания не удается достичь применением препарата в рекомендуемой терапевтической дозе, суточная доза может быть увеличена до 4 ингаляций в каждую ноздрю 2 раза в день (суммарная суточная доза — 800 мкг). После уменьшения симптомов заболевания рекомендуется снижение дозы.
Лечение острого риносинусита без признаков тяжелой бактериальной инфекции
Рекомендуемая доза для взрослых и подростков составляет 2 ингаляции (по 50 мкг в каждый носовой ход) 2 раза в сутки (суммарная суточная доза — 400 мкг). При ухудшении симптомов в ходе лечения необходима консультация специалиста.
Лечение полипоза носа.
Взрослые от 18 лет (в т.ч. пожилого возраста). Рекомендуемая терапевтическая доза препарата составляет 2 ингаляции (по 50 мкг каждая) в каждую ноздрю 2 раза в день (суммарная суточная доза — 400 мкг). После уменьшения симптомов заболевания рекомендуется снижение дозы до 2 ингаляций (по 50 мкг каждая) в каждую ноздрю 1 раз в день (суммарная суточная доза — 200 мкг).
Наружно, наносить по нескольку капель на пораженные участки кожи 1 раз в сутки. После нанесения втирать мягкими движениями до полного всасывания с поверхности кожи. Для наиболее эффективного и экономичного использования препарата поднесите носик флакона к пораженному участку кожи и слегка сожмите флакон.
Продолжительность курса лечения определяется его эффективностью, а также переносимостью пациентом, наличием и выраженностью побочных эффектов.
Противопоказания
Предоставленная в разделе Противопоказания Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Противопоказания
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
Крем; Крем для наружного применения; Кожное решение; Лосьон; Мазь; Мазь для наружного применения
Спрей назальный; Таблетки
Спрей назальный дозированный
Раствор для наружного применения
Гиперчувствительность.
гиперчувствительность к какому-либо компоненту препарата;
наличие нелеченной местной инфекции с вовлечением в процесс слизистой оболочки носовой полости;
недавнее оперативное вмешательство или травма носа (до заживления раны);
туберкулезная инфекция (активная или латентная) респираторного тракта, нелеченная грибковая, бактериальная, вирусная системная инфекция или инфекция, вызванная Herpes simplex c поражением глаз (в виде исключения назначение препарата в этих случаях возможно по указанию врача с большой осторожностью);
детский возраст до 2 лет (отсутствуют данные о безопасности применения).
гиперчувствительность к любому из компонентов препарата;
недавнее оперативное вмешательство или травма носа с повреждением слизистой оболочки носовой полости — до заживления раны (в связи с ингибирующим действием ГКС на процесс заживления);
детский возраст (при сезонном и круглогодичном аллергических ринитах — до 2 лет, при остром синусите или обострении хронического синусита — до 12 лет, при полипозе — до 18 лет) — в связи с отсутствием соответствующих данных.
С осторожностью: туберкулезная инфекция (активная и латентная) респираторного тракта; нелеченная грибковая, бактериальная, системная вирусная инфекция или инфекция, вызванная Herpes simplex, с поражением глаз (в виде исключения возможно назначение препарата при перечисленных инфекциях по указанию врача); наличие нелеченной местной инфекции с вовлечением в процесс слизистой оболочки носовой полости.
повышенная чувствительность к какому-либо компоненту препарата или к ГКС;
розовые угри;
периоральный дерматит;
бактериальная, вирусная (Herpes simplex, ветряная оспа, Herpes zoster) или грибковая инфекция кожи;
туберкулез;
сифилис;
поствакцинальные реакции;
детский возраст до 2 лет;
беременность (лечение обширных участков кожи, длительное лечение);
период лактации (применение в больших дозах и/или в течение длительного времени).
С осторожностью:
нанесение на кожу лица и интертригинозную кожу;
применение окклюзионных повязок;
лечение больших участков кожи и/или длительное лечение (особенно у детей).
Побочные эффекты
Предоставленная в разделе Побочные эффекты Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Побочные эффекты
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
Крем; Крем для наружного применения; Кожное решение; Лосьон; Мазь; Мазь для наружного применения
Спрей назальный; Таблетки
Спрей назальный дозированный
Раствор для наружного применения
Крем. В контролируемых клинических исследованиях на 319 пациентах частота возникновения нежелательных явлений, связанных с применением крема Элоком, составляла 1,6%. Отмечались жжение, зуд, атрофия кожи; имелись сообщения о появлении розовых угрей. В контролируемых клинических исследованиях на детях в возрасте от 2 до 12 лет (n=74) частота нежелательных явлений (жжение, зуд, фурункулез), связанных с применением крема, составляла примерно 7%.
Мазь. В контролируемых клинических исследованиях на 812 пациентах частота возникновения нежелательных явлений, связанных с применением мази Элоком, составляла 4,8%. Отмечались жжение, покалывания, зуд, атрофия кожи, фурункулез; имелись сообщения о появлении розовых угрей. В контролируемых клинических исследованиях на детях в возрасте от 2 до 12 лет (n=74) частота нежелательных явлений (жжение, зуд, фурункулез), связанных с применением мази, составляла примерно 7%.
Лосьон. В клинических исследованиях на 209 пациентах были отмечены следующие нежелательные явления: жжение (4 случая), угревидная сыпь (2 случая), зуд (1 случай). В исследовании повышенной/болезненной чувствительности на 156 здоровых добровольцах отмечалось возникновение фолликулита (4 случая).
При местном применении глюкокортикостероидных препаратов редко могут возникать следующие нежелательные явления в порядке убывания частоты появления — раздражение и сухость кожи, фолликулит, гипертрихоз, угревидная сыпь, гипопигментация, периоральный дерматит, аллергический контактный дерматит, мацерация кожи, вторичная инфекция, стрии и потница. Вероятность возникновения перечисленных нежелательных явлений увеличивается при применении окклюзионных повязок.
При лечении сезонного или круглогодичного аллергического ринита.
У взрослых:
— носовые кровотечения (явные или выделение окрашенной кровью слизи или сгустков крови)
— фарингит,
— ощущение жжения в носу,
— раздражение слизистой оболочки носа.
Носовые кровотечения, как правило, прекращались самостоятельно, не являлись тяжелыми; они возникали с частотой, несколько большей, чем при использовании плацебо (5%), но равной или меньшей, чем при использовании других ГКС для интраназального применения, которые использовались в качестве активного контроля (у некоторых из них частота возникновения носовых кровотечений составляла до 15%). Частота возникновения всех других нежелательных явлений была сопоставима с частотой их возникновения при назначении плацебо.
У детей:
— носовые кровотечения,
— головная боль,
— ощущение раздражения в носу,
— чихание.
Частота возникновения указанных нежелательных явлений у детей была сравнима с частотой их возникновения при применении плацебо.
При лечении обострений синуситов (при использовании спрея Nazofix в качестве вспомогательного средства).
У взрослых и подростков:
— головная боль,
— фарингит,
— ощущение жжения в носу,
— раздражение слизистой носа.
Носовые кровотечения были умеренно выражены, частота их возникновения при применении Nazofixа была также сопоставима с частотой носовых кровотечений при применении плацебо (5% по сравнению с 4%, соответственно).
Очень редко при интраназальном применении ГКС отмечались случаи перфорации носовой перегородки или повышения внутриглазного давления.
Взрослые и подростки
Нежелательные явления, связанные с применением препарата (≥1%), выявленные в ходе клинических исследований у пациентов с аллергическим ринитом или полипозом носа и в период пострегистрационного применения препарата, независимо от показания к применению, представлены ниже.
Нежелательные реакции перечислены в соответствии с классификацией системно-органного класса и классифицированы по частоте возникновения.
Носовые кровотечения, как правило, были умеренными и прекращались самостоятельно, частота их возникновения была несколько большей, чем при использовании плацебо (5%), но равной или меньшей, чем при назначении других интраназальных ГКС, которые использовались в качестве активного контроля (у некоторых из них частота возникновения носовых кровотечений составила до 15%).
Частота возникновения всех других нежелательных явлений была сопоставимой с частотой их возникновения при назначении плацебо.
Частота нежелательных реакций установлена следующим образом: очень часто (≥1/10); часто (≥1/100, <1/10); редко (≥1/1000, <1/100). Для нежелательных реакций в период пострегистрационного наблюдения частота не установлена (не может быть определена на основании имеющихся данных).
Инфекционные и паразитарные заболевания: часто — фарингит, инфекции верхних дыхательных путей*.
Со стороны иммунной системы: частота не установлена — реакции повышенной чувствительности, включая анафилактические реакции, ангионевротический отек, бронхоспазм, одышку.
Со стороны нервной системы: часто — головная боль.
Со стороны органа зрения: частота не установлена — повышение ВГД, глаукома, катаракта.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — носовые кровотечения**; часто — носовые кровотечения (т.е. явное кровотечение, а также выделение окрашенной кровью слизи или сгустков крови), ощущение жжения в носу, раздражение слизистой оболочки носа, изъязвление слизистой оболочки носа; частота не установлена — перфорация носовой перегородки.
Со стороны ЖКТ: часто —раздражение глотки (ощущение раздражения слизистой оболочки глотки)**; частота не установлена — нарушение вкуса и обоняния.
Дети
Со стороны дыхательной системы, органов грудной клетки и средостения: носовые кровотечения (6%), раздражение слизистой оболочки носа (2%), чихание (2%).
Со стороны нервной системы: головная боль (3%).
Частота возникновения указанных нежелательных явлений у детей была сопоставима с частотой их возникновения при применении плацебо.
При применении интраназальных ГКС возможно развитие системных побочных эффектов, особенно при длительном применении их в высоких дозах.
*Выявлено с частотой «редко» при применении препарата 2 раза в день при полипозе носа.
**Выявлено при применении препарата 2 раза в день при полипозе носа.
Редко — раздражение и сухость кожи, ощущение жжения, зуд, фолликулит, гипертрихоз, угревая сыпь, гипопигментация, периоральный дерматит, аллергический контактный дерматит, мацерация кожи, присоединение вторичной инфекции, признаки атрофии кожи, стрии, потница. Менее чем в 1% случаев — образование папул, пустул.
При применении наружных форм ГКС в течение длительного времени и/или для лечения больших участков кожи, или с использованием окклюзионных повязок, особенно у детей и подростков, могут возникнуть побочные эффекты, характерные для ГКС системного действия, включая надпочечниковую недостаточность и синдром Кушинга.
Передозировка
Предоставленная в разделе Передозировка Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Передозировка
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
Крем; Крем для наружного применения; Кожное решение; Лосьон; Мазь; Мазь для наружного применения
Спрей назальный; Таблетки
Спрей назальный дозированный
Раствор для наружного применения
При местном применении в больших дозах возможна абсорбция препарата в количествах, достаточных для проявления системных побочных эффектов.
Симптомы: при длительном применении ГКС в высоких дозах, а также при одновременном использовании нескольких ГКС возможно угнетение функции гипоталамо-гипофизарно-надпочечниковой системы.
Лечение: вследствие малой (менее 0,1%) системной биодоступности маловероятно, что при случайной или намеренной передозировке потребуется принятие каких-либо мер, кроме наблюдения за больным с последующим продолжением лечения в рекомендованной дозе.
При длительном применении ГКС в высоких дозах, а также при одновременном использовании нескольких ГКС возможно угнетение функции гипоталамо-гипофизарно-надпочечниковой системы. Вследствие малой системной биодоступности препарата (<1%, при чувствительности метода определения 0,25 пг/мл) маловероятно, что при случайной или намеренной передозировке потребуется принятие каких-либо мер помимо наблюдения с возможным последующим возобновлением приема препарата в рекомендованной дозе.
Симптомы: угнетение функции гипоталамо-гипофизарно-надпочечниковой системы, включая вторичную надпочечниковую недостаточность.
Лечение: симптоматическое, при необходимости — коррекция электролитного дисбаланса, отмена препарата (при длительной терапии — постепенная отмена).
Фармакодинамика
Предоставленная в разделе Фармакодинамика Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Фармакодинамика
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
Спрей назальный; Таблетки
Спрей назальный дозированный
Раствор для наружного применения
Мометазона фуроат является синтетическим глюкокортикостероидом для местного применения. Оказывает противовоспалительное и противоаллергическое действие при применении в дозах, при которых не возникает системных эффектов. Тормозит высвобождение медиаторов воспаления, повышает продукцию липомодулина, являющегося ингибитором фосфолипазы А, что обусловливает снижение высвобождения арахидоновой кислоты и, соответственно, угнетение синтеза продуктов метаболизма арахидоновой кислоты — циклических эндоперекисей, ПГ. Предупреждает краевое скопление нейтрофилов, уменьшает воспалительный экссудат и продукцию лимфокинов, тормозит миграцию макрофагов, приводит к уменьшению процессов инфильтрации и грануляции. Уменьшает воспаление за счет снижения образования субстанции хемотаксиса (влияние на «поздние» реакции аллергии), тормозит развитие «немедленной» аллергической реакции (обусловлено торможением продукции метаболитов арахидоновой кислоты и снижением высвобождения из тучных клеток медиаторов воспаления).
В исследованиях с провокационными тестами при нанесении антигенов на слизистую оболочку полости носа была продемонстрирована высокая противовоспалительная активность Nazofixа как в ранней, так и в поздней стадии аллергической реакции, что подтверждалось понижением (по сравнению с плацебо) уровня гистамина и активности эозинофилов, а также уменьшением (по сравнению с исходным уровнем) числа эозинофилов, нейтрофилов и белков адгезии эпителиальных клеток.
Мометазон является синтетическим ГКС для местного применения. Оказывает противовоспалительное и противоаллергическое действие при применении в дозах, при которых не возникает системных эффектов. Тормозит высвобождение медиаторов воспаления. Повышает продукцию липомодулина, являющегося ингибитором фосфолипазы А, что обусловливает снижение высвобождения арахидоновой кислоты и, соответственно, угнетение синтеза продуктов метаболизма арахидоновой кислоты — циклических эндоперекисей, ПГ. Предупреждает краевое скопление нейтрофилов, что уменьшает воспалительный экссудат и продукцию лимфокинов, тормозит миграцию макрофагов, приводит к уменьшению процессов инфильтрации и грануляции. Уменьшает воспаление за счет снижения образования субстанции хемотаксиса (влияние на поздние реакции аллергии), тормозит развитие аллергической реакции немедленного типа (обусловлено торможением продукции метаболитов арахидоновой кислоты и снижением высвобождения из тучных клеток медиаторов воспаления).
Мометазон — ГКС, обладающий противовоспалительным, противозудным и антиэкссудативным действием. ГКС индуцируют выделение белков, ингибирующих фосфолипазу А2 и известных под общим названием липокортины, которые контролируют биосинтез таких медиаторов воспаления, как ПГ и ЛТ, путем торможения высвобождения их общего предшественника — арахидоновой кислоты.
Фармакокинетика
Предоставленная в разделе Фармакокинетика Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Фармакокинетика
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
Крем; Крем для наружного применения; Кожное решение; Лосьон; Мазь; Мазь для наружного применения
Спрей назальный; Таблетки
Спрей назальный дозированный
Раствор для наружного применения
Степень проникновения глюкокортикостероидов местного применения через кожу зависит от многих факторов, включая состав препарата и целостность эпидермального барьера. Воспаления и иные процессы, протекающие в коже, могут привести к усилению проникновения препарата через кожу. При однократной местной аппликации на неповрежденную кожу (без окклюзионной повязки) примерно 0,7% дозы мази и примерно 0,4% крема обнаруживаются в крови через 8 ч. Есть основания полагать, что уровень абсорбции глюкокортикостероида в лекарственной форме лосьона также незначителен.
Мометазона фуроату свойственна пренебрежимо малая биодоступность (≤0,1%) и при назначении в виде интраназальной ингаляции он практически не определяется в плазме крови (даже при использовании чувствительного метода определения с порогом чувствительности, равным 50 пг/мл). В связи с этим соответствующих фармакокинетических данных для данной лекарственной формы не существует. Суспензия очень слабо всасывается из ЖКТ, поэтому то небольшое количество, которое может попасть в ЖКТ после ингаляции в полость носа, еще до экскреции с мочой или желчью подвергается активному первичному метаболизму.
При интраназальном применении системная биодоступность мометазона фуроата составляет <1% (при чувствительности метода определения 0,25 пг/мл). Суспензия мометазона очень плохо всасывается в ЖКТ, и то небольшое количество суспензии мометазона, которое может попасть в ЖКТ после носовой ингаляции, еще до экскреции с мочой или желчью подвергается активному первичному метаболизму.
Абсорбция препарата Элоком® Лосьон (0,1% раствор для наружного применения) незначительна. Через 8 ч после нанесения на неповрежденную кожу (без окклюзионной повязки) в системном кровотоке обнаруживается около 0,7%.
Фармокологическая группа
Предоставленная в разделе Фармокологическая группа Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Фармокологическая группа
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
- Глюкокортикоид для местного применения [Глюкокортикостероиды]
Взаимодействие
Предоставленная в разделе Взаимодействие Nazofixинформация составлена на основе данных о другом лекарстве с точно таким же составом как лекарство Nazofix. Будьте
внимательны и обязательно уточняйте информацию по разделу Взаимодействие
в инструкции к лекарству Nazofix непосредственно из упаковки или у фармацевта в аптеке.
more…
Крем; Крем для наружного применения; Кожное решение; Лосьон; Мазь; Мазь для наружного применения
Спрей назальный; Таблетки
Спрей назальный дозированный
Соответствующих данных не имеется.
Сочетанная терапия с лоратадином хорошо переносилась больными. Исследования взаимодействия с другими препаратами не проводились.
Комбинированная терапия с лоратадином хорошо переносится пациентами. При этом не отмечается какого-либо влияния препарата на концентрацию в плазме лоратадина или его основного метаболита.
Источники:
- https://www.drugs.com/search.php?searchterm=nazofix
- https://pubmed.ncbi.nlm.nih.gov/?term=nazofix
Доступно в странах
Найти в стране:
А
Б
В
Г
Д
Е
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ч
Ш
Э
Ю
Я
Top 20 medicines with the same components:
Top 20 medicines with the same treatments:
Name of the medicinal product
The information provided in Name of the medicinal product of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Name of the medicinal product in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Nazofix
Qualitative and quantitative composition
The information provided in Qualitative and quantitative composition of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Qualitative and quantitative composition in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Mometasone Furoate
Therapeutic indications
The information provided in Therapeutic indications of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Therapeutic indications in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Inhalation powder; Powder for inhalation dosed
Cream for external use; Ointment for external use
Nasal dosing spray
Substance-powder
Nazofix 200 micrograms Inhalation Powder is indicated in adults and adolescents 12 years of age and older for regular treatment to control persistent asthma.
Nazofix Furoate 1mg/g Cream is indicated for the treatment of inflammatory and pruritic manifestations of psoriasis (excluding widespread plaque psoriasis) and atopic dermatitis.
This medicinal product is indicated in adults and children above 6 years of age.
Nazofix Nasal Spray is indicated for use in adults and children 3 years of age and older to treat the symptoms of seasonal allergic or perennial rhinitis.
Nazofix Nasal Spray is indicated for the treatment of nasal polyps in adults 18 years of age and older.
Nazofix 1mg/g Cream is indicated for the treatment of inflammatory and pruritic manifestations of psoriasis (excluding widespread plaque psoriasis) and atopic dermatitis.
This medicinal product is indicated in adults and children above 6 years of age.
Dosage (Posology) and method of administration
The information provided in Dosage (Posology) and method of administration of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Dosage (Posology) and method of administration in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Inhalation powder; Powder for inhalation dosed
Cream for external use; Ointment for external use
Nasal dosing spray
Substance-powder
Posology
Dosage recommendations are based on severity of asthma (see criteria below).
Patients with persistent mild to moderate asthma: The recommended starting dose for most of these patients is 400 micrograms once daily. Data suggest that better asthma control is achieved if once daily dosing is administered in the evening. Some patients may be more adequately controlled on 400 micrograms daily, given in two divided doses (200 micrograms twice daily).
The dose of Nazofix 200 micrograms Inhalation Powder should be individualised and titrated to the lowest dose at which effective control of asthma is maintained. Dose reduction to 200 micrograms once daily given in the evening may be an effective maintenance dose for some patients.
Patients with severe asthma: The recommended starting dose is 400 micrograms twice daily, which is the maximum recommended dose. When symptoms are controlled, titrate Nazofix 200 micrograms Inhalation Powder to the lowest effective dose.
In patients with severe asthma and previously receiving oral corticosteroids, Nazofix 200 micrograms Inhalation Powder will be initiated concurrently with the patient’s usual maintenance dose of systemic corticosteroid. After approximately one week, gradual withdrawal of the systemic corticosteroid can be initiated by reducing the daily or alternate daily dose. The next reduction is made after an interval of one to two weeks, depending on the response of the patient. Generally, these decrements are not to exceed 2.5 mg of prednisone daily, or its equivalent.
A slow rate of withdrawal is strongly recommended. During withdrawal of oral corticosteroids, patients must be carefully monitored for signs of unstable asthma, including objective measures of airway function, and for adrenal insufficiency (see 4.4).
The patient should be instructed that Nazofix 200 micrograms Inhalation Powder is not intended to be used «on demand» as a reliever medication to treat acute symptoms and that this product must be taken regularly to maintain therapeutic benefit even when he or she is asymptomatic.
Criteria:
Mild asthma: symptoms > 1 time a week but < 1 time per day; exacerbations may affect activity and sleep; night-time asthma symptoms > 2 times a month; PEF or FEV1 > 80 % predicted, variability 20 — 30 %
Moderate asthma: symptoms daily; exacerbations affect activity and sleep; night-time asthma symptoms > 1 time a week; daily use of short-acting beta2 -agonist; PEF or FEV1 > 60-< 80 % predicted, variability > 30 %
Severe asthma: continuous symptoms; frequent exacerbations; frequent night-time asthma symptoms; physical activities limited by asthma symptoms; PEF or FEV1≤ 60% predicted, variability > 30%
Special populations
Paediatric population
The safety and efficacy of Nazofix 200 mcg in children less than 12 years of age have not been established. No data are available.
Elderly patients older than 65 years of age
No dosage adjustment is necessary.
Method of administration
This product is for inhalation use only.
The patient needs to be instructed how to use the inhaler correctly (see below).
Patients should be in an upright position when inhaling the product.
Prior to removing the cap, be sure the counter and the pointer on the cap are aligned. The inhaler can be opened by removing the white cap while holding unit upright (the pink-coloured base down), gripping the base, and twisting the cap counterclockwise. The counter will register the number down by one count. Instruct the patient to place the inhaler in the mouth, closing the lips around the mouthpiece, and to breathe in rapidly and deeply. Then, the inhaler is removed from the mouth, and the breath held for about 10 seconds, or as long as is comfortable. The patient is not to breathe out through the inhaler. To close, while holding the unit in an upright position, replace the cap immediately after each inhalation, loading for the next dose by rotating the cap clockwise while gently pressing down until a click sound is heard and the cap is fully closed. The arrow on the cap will be fully aligned with the counter window. After inhalation, patients are advised to rinse the mouth and spit out the water. This helps to reduce the risk of candidiasis.
The digital display will indicate when the last dose has been delivered; after dose 01, the counter will read 00 and the cap will lock, at which time the unit must be discarded. The inhaler is to be kept clean and dry at all times. The outside of the mouthpiece can be cleaned with a dry cloth or tissue; do not wash the inhaler; avoid contact with water.
For detailed instructions see Package Leaflet.
Posology
Adults, including elderly patients, adolescents and children aged 6 years and over: A thin film of Nazofix Furoate 1mg/g Cream should be applied to the affected areas of skin once daily. One fingertip unit (a line from the tip of an adult index finger to the first crease) is enough to cover an area twice the size of an adult hand.
Use of a weaker corticosteroid is often advisable when there is a clinical improvement.
Paediatric population
Nazofix Furoate 1mg/g Cream should not be used for long periods (over 3 weeks) or on large areas (over 20% of body surface area). In children a maximum of 10% of body surface area should be treated.
Use of topical corticosteroids in children aged 6 years and over, or on the face should be limited to the least amount compatible with an effective therapeutic regimen and duration of treatment should be no more than 5 days.
Children below 6 years: Nazofix Furoate 1mg/g Cream is not recommended for use in children below 6 years of age due to insufficient data on safety.
After initial priming of the Nazofix Nasal Spray pump, each actuation delivers approximately 100 mg of mometasone furoate suspension, containing mometasone furoate monohydrate equivalent to 50 micrograms mometasone furoate.
Posology
Seasonal Allergic or Perennial Rhinitis
Adults (including older patients) and children 12 years of age and older: The usual recommended dose is two actuations (50 micrograms/actuation) in each nostril once daily (total dose 200 micrograms). Once symptoms are controlled, dose reduction to one actuation in each nostril (total dose 100 micrograms) may be effective for maintenance. If symptoms are inadequately controlled, the dose may be increased to a maximum daily dose of four actuations in each nostril once daily (total dose 400 micrograms). Dose reduction is recommended following control of symptoms.
Children between the ages of 3 and 11 years: The usual recommended dose is one actuation (50 micrograms/actuation) in each nostril once daily (total dose 100 micrograms).
Nazofix Nasal Spray demonstrated a clinically significant onset of action within 12 hours after the first dose in some patients with seasonal allergic rhinitis; however, full benefit of treatment may not be achieved in the first 48 hours. Therefore, the patient should continue regular use to achieve full therapeutic benefit.
Treatment with Nazofix Nasal Spray may need to be initiated some days before the expected start of the pollen season in patients who have a history of moderate to severe symptoms of seasonal allergic rhinitis.
Nasal Polyposis
The usual recommended starting dose for polyposis is two actuations (50 micrograms/actuation) in each nostril once daily (total daily dose of 200 micrograms). If after 5 to 6 weeks symptoms are inadequately controlled, the dose may be increased to a daily dose of two sprays in each nostril twice daily (total daily dose of 400 micrograms). The dose should be titrated to the lowest dose at which effective control of symptoms is maintained. If no improvement in symptoms is seen after 5 to 6 weeks of twice daily administration, the patient should be re-evaluated and treatment strategy reconsidered.
Efficacy and Safety studies of Nazofix Nasal Spray for the treatment of nasal polyposis were four months in duration.
Paediatric population
Seasonal Allergic Rhinitis and Perennial Rhinitis
The safety and efficacy of Nazofix Nasal Spray in children under 3 years of age have not been established.
Nasal Polyposis
The safety and efficacy of Nazofix Nasal Spray in children and adolescents under 18 years of age have not been established.
Method of administration
Prior to administration of the first dose, shake container well and actuate the pump 10 times (until a uniform spray is obtained). If the pump is not used for 14 days or longer, reprime the pump with 2 actuations until a uniform spray is observed, before next use.
Shake container well before each use. The bottle should be discarded after the labelled number of actuations or within 2 months of first use.
Posology
Adults, including elderly patients, adolescents and children aged 6 years and over: A thin film of Nazofix 1mg/g Cream should be applied to the affected areas of skin once daily. One fingertip unit (a line from the tip of an adult index finger to the first crease) is enough to cover an area twice the size of an adult hand.
Use of a weaker corticosteroid is often advisable when there is a clinical improvement.
Paediatric population
Nazofix 1mg/g Cream should not be used for long periods (over 3 weeks) or on large areas (over 20% of body surface area). In children a maximum of 10% of body surface area should be treated.
Use of topical corticosteroids in children aged 6 years and over, or on the face should be limited to the least amount compatible with an effective therapeutic regimen and duration of treatment should be no more than 5 days.
Children below 6 years: Nazofix 1mg/g Cream is not recommended for use in children below 6 years of age due to insufficient data on safety.
Contraindications
The information provided in Contraindications of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Contraindications in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Cream for external use; Ointment for external use
Nasal dosing spray
Substance-powder
Nazofix Furoate 1mg/g Cream is contraindicated in facial rosacea, acne vulgaris, skin atrophy, perioral dermatitis, perianal and genital pruritis, napkin eruptions, bacterial (e.g. impetigo, pyodermas), viral (e.g. herpes simplex, herpes zoster, chickenpox, verrucae vulgares, condylomata acuminate and molluscum contagiosum), parasitical and fungal (e.g. candida or dermatophyte) infections, varicella, tuberculosis, syphilis or post-vaccine reactions. Nazofix Furoate 1mg/g Cream should not be used on wounds or on skin which is ulcerated.
Nazofix Nasal Spray should not be used in the presence of untreated localised infection involving the nasal mucosa, such as herpes simplex.
Because of the inhibitory effect of corticosteroids on wound healing, patients who have experienced recent nasal surgery or trauma should not use a nasal corticosteroid until healing has occurred.
Nazofix 1mg/g Cream is contraindicated in facial rosacea, acne vulgaris, skin atrophy, perioral dermatitis, perianal and genital pruritis, napkin eruptions, bacterial (e.g. impetigo, pyodermas), viral (e.g. herpes simplex, herpes zoster, chickenpox, verrucae vulgares, condylomata acuminate and molluscum contagiosum), parasitical and fungal (e.g. candida or dermatophyte) infections, varicella, tuberculosis, syphilis or post-vaccine reactions. Nazofix 1mg/g Cream should not be used on wounds or on skin which is ulcerated.
Special warnings and precautions for use
The information provided in Special warnings and precautions for use of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Special warnings and precautions for use in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Inhalation powder; Powder for inhalation dosed
Cream for external use; Ointment for external use
Nasal dosing spray
Substance-powder
Oral candidiasis
During clinical trials, oral candidiasis, which is associated with the use of this class of medicinal product, occurred in some patients. This infection may require treatment with appropriate antifungal therapy and in some patients discontinuance of Nazofix 200 micrograms Inhalation Powder may be necessary (see 4.8).
Systemic effects of inhaled corticosteroids
Systemic effects of inhaled corticosteroids may occur, particularly at high doses prescribed for prolonged periods. These effects are much less likely to occur than with oral corticosteroids and may vary in individual patients and between different corticosteroid preparations. Possible systemic effects may include Cushing’s syndrome, Cushingoid features, adrenal suppression, growth retardation in children and adolescents, decrease in bone mineral density, cataracts, glaucoma, and more rarely, a range of psychological or behavioural effects including psychomotor hyperactivity, sleep disorders, anxiety, depression or aggression (particularly in children). Therefore, it is important that the dose of inhaled corticosteroid is titrated to the lowest dose at which effective control of asthma is maintained.
Visual disturbance may be reported with systemic and topical (including, intranasal, inhaled and intraocular) corticosteroid use. If a patient presents with symptoms such as blurred vision or other visual disturbances, the patient should be considered for referral to an ophthalmologist for evaluation of possible causes of visual disturbances which may include cataract, glaucoma or rare diseases such as central serous chorioretinopathy (CSCR) which have been reported after use of systemic and topical corticosteroids.
Transferring from systemic corticosteroid therapy
Particular care is needed for patients who are transferred from systemically active corticosteroids to inhaled mometasone furoate, because deaths due to adrenal insufficiency have occurred in asthmatic patients during and after transfer from systemic corticosteroids to less systemically available inhaled corticosteroids. After withdrawal from systemic corticosteroids, a number of months are required for recovery of hypothalamic-pituitary-adrenal (HPA) axis function.
During dose reduction some patients may experience symptoms of systemic corticosteroid withdrawal, e.g. joint and/or muscular pain, lassitude and depression, despite maintenance or even improvement in pulmonary function. Such patients are to be encouraged to continue with both Nazofix 200 micrograms Inhalation Powder treatment and withdrawal of the systemic corticosteroids, unless objective signs of adrenal insufficiency are present. If evidence of adrenal insufficiency occurs, increase the systemic corticosteroid doses temporarily and thereafter continue withdrawal more slowly.
During periods of stress, including trauma, surgery, or infection, or a severe asthma attack, patients transferred from systemic corticosteroids will require supplementary treatment with a short course of systemic corticosteroids, which is gradually tapered as symptoms subside.
It is recommended that such patients carry a supply of oral corticosteroids and a warning card indicating their need and recommended dosage of systemic corticosteroids during stressful periods. Periodic testing of adrenocortical function, particularly measurement of early morning plasma cortisol levels, is recommended.
Transfer of patients from systemic corticosteroid therapy to Nazofix 200 micrograms Inhalation Powder may unmask pre-existing allergic conditions previously suppressed by systemic corticosteroid therapy. If this occurs, symptomatic treatment is recommended.
Effects on HPA axis function
Use of Nazofix 200 micrograms Inhalation Powder will often permit control of asthma symptoms with less suppression of HPA axis function than therapeutically equivalent oral doses of prednisone. Although mometasone furoate has demonstrated low systemic bioavailability at the recommended dosage, it is absorbed into the circulation and can be systemically active at higher doses. Thus, to maintain its profile of limited potential for HPA axis suppression, recommended doses of this product must not be exceeded, and must be titrated to the lowest effective dose for each individual patient.
Bronchospasm
As with other inhaled asthma medications, bronchospasm may occur with an immediate increase in wheezing after dosing. If bronchospasm occurs following dosing with the Nazofix 200 micrograms Inhalation Powder, immediate treatment with a fast-acting inhaled bronchodilator is recommended; thus, the patient should be told to keep an appropriate bronchodilator inhaler on hand at all times. In such cases, treatment with Nazofix 200 micrograms Inhalation Powder is then discontinued immediately and alternative therapy instituted.
Mometasone furoate is not to be regarded as a bronchodilator and is not indicated for rapid relief of bronchospasm or asthma attacks; thus, patients should be instructed to keep an appropriate short-acting bronchodilator inhaler on hand for use when needed.
Instruct patients to contact their physician immediately when asthmatic episodes are not responsive to bronchodilators during treatment with this product or if peak-flow falls. This may indicate worsening asthma. During such episodes, patients may require systemic corticosteroid therapy. In these patients, dose titration to the maximum recommended maintenance dose of inhaled mometasone furoate may be considered.
Immunosuppression
Use Nazofix 200 micrograms Inhalation Powder with caution, if at all, in patients with untreated active or quiescent tuberculous infections of the respiratory tract, or in untreated fungal, bacterial, systemic viral infections or ocular herpes simplex.
Advise patients who are receiving corticosteroids or other immunosuppressant medicines of the risk of exposure to certain infections (e.g., chickenpox, measles) and of the importance of obtaining medical advice if such exposure occurs. This is of particular importance in children.
Effects on growth
A reduction of growth velocity in children or adolescents may occur as a result of inadequate control of chronic diseases such as asthma or from use of corticosteroids for treatment. Physicians are advised to closely follow the growth of adolescents taking corticosteroids by any route and weigh the benefits of corticosteroid therapy and asthma control against the possibility of growth suppression if an adolescent’s growth appears slowed.
If growth is slowed, review therapy with the aim of reducing the dose of inhaled corticosteroids if possible, to the lowest dose at which effective control of symptoms is achieved. In addition, consideration should be given to referring the patient to a paediatric respiratory specialist.
Effects on adrenal suppression
When using inhaled corticosteroids, the possibility for clinically significant adrenal suppression may occur, especially after prolonged treatment with high doses and particularly with higher than recommended doses. This is to be considered during periods of stress or elective surgery, when additional systemic corticosteroids may be needed. However, during clinical trials there was no evidence of HPA axis suppression after prolonged treatment with inhaled mometasone furoate at doses of ≤ 800 micrograms per day.
Dosing considerations
Lack of response or severe exacerbations of asthma should be treated by increasing the maintenance dose of inhaled mometasone furoate, and if necessary, by giving a systemic corticosteroid and/or an antibiotic if infection is suspected, and by use of beta-agonist therapy.
The patient should be advised against abrupt discontinuation of therapy with Nazofix 200 micrograms Inhalation Powder.
There is no evidence that the administration of this product in amounts greater than recommended doses increases efficacy.
Patients with lactose intolerance
The maximum recommended daily dose contains lactose 4.64 mg per day. This amount does not normally cause problems in lactose intolerant people.
If irritation or sensitisation develop with the use of Nazofix Furoate 1mg/g Cream, treatment should be withdrawn and appropriate therapy instituted.
Should an infection develop, use of an appropriate antifungal or antibacterial agent should be instituted. If a favourable response does not occur promptly, the corticosteroid should be discontinued until the infection is adequately controlled.
Systemic absorption of topical corticosteroids can produce reversible hypothalamic-pituitaryadrenal (HPA) axis suppression with the potential for glucocorticosteroid insufficiency after withdrawal of treatment. Manifestations of Cushing’s syndrome, hyperglycaemia, and glucosuria can also be produced in some patients by systemic absorption of topical corticosteroids while on treatment. Patients applying a topical steroid to a large surface area or areas under occlusion should be evaluated periodically for evidence of HPA axis suppression.
Any of the side effects that are reported following systemic use of corticosteroids, including adrenal suppression, may also occur with topical corticosteroids, especially in infants and children.
Paediatric patients may be more susceptible to systemic toxicity from equivalent doses due to their larger skin surface to body mass ratios. As the safety and efficacy of Nazofix Furoate in paediatric patients below 6 years of age have not been established, its use in this age group is not recommended.
Local and systemic toxicity is common especially following long continued use on large areas of damaged skin, in flexures and with polythene occlusion. If used in childhood, or on the face, occlusion should not be used. If used on the face, courses should be limited to 5 days and occlusion should not be used. Long term continuous therapy should be avoided in all patients irrespective of age.
Topical steroids may be hazardous in psoriasis for a number of reasons including rebound relapses following development of tolerance, risk of centralised pustular psoriasis and development of local or systemic toxicity due to impaired barrier function of the skin. If used in psoriasis careful patient supervision is important.
As with all potent topical glucocorticoids, avoid sudden discontinuation of treatment. When long term topical treatment with potent glucocorticoids is stopped, a rebound phenomenon can develop which takes the form of a dermatitis with intense redness, stinging and burning. This can be prevented by slow reduction of the treatment, for instance continue treatment on an intermittent basis before discontinuing treatment.
Glucocorticoids can change the appearance of some lesions and make it difficult to establish an adequate diagnosis and can also delay the healing.
Nazofix Furoate 1mg/g Cream contains propylene glycol which may cause skin irritation. Nazofix Furoate 1mg/g Cream contains stearyl alcohol which may cause local skin reactions (e.g. contact dermatitis).
Nazofix Furoate 1mg/g Cream topical preparations are not for ophthalmic use, including the eyelids, because of the very rare risk of glaucoma simplex or subcapsular cataract.
Visual disturbance
Visual disturbance may be reported with systemic and topical corticosteroid use. If a patient presents with symptoms such as blurred vision or other visual disturbances, the patient should be considered for referral to an ophthalmologist for evaluation of possible causes which may include cataract, glaucoma or rare diseases such as central serous chorioretinopathy (CSCR) which have been reported after use of systemic and topical corticosteroids.
Immunosuppression
Nazofix Nasal Spray should be used with caution, if at all, in patients with active or quiescent tuberculous infections of the respiratory tract, or in untreated fungal, bacterial, or systemic viral infections.
Patients receiving corticosteroids who are potentially immunosuppressed should be warned of the risk of exposure to certain infections (e.g., chickenpox, measles) and of the importance of obtaining medical advice if such exposure occurs.
Local Nasal Effects
Following 12 months of treatment with Nazofix Nasal Spray in a study of patients with perennial rhinitis, there was no evidence of atrophy of the nasal mucosa; also, mometasone furoate tended to reverse the nasal mucosa closer to a normal histologic phenotype. Nevertheless, patients using Nazofix Nasal Spray over several months or longer should be examined periodically for possible changes in the nasal mucosa. If localised fungal infection of the nose or pharynx develops, discontinuance of Nazofix Nasal Spray therapy or appropriate treatment may be required. Persistence of nasopharyngeal irritation may be an indication for discontinuing Nazofix Nasal Spray.
Nazofix is not recommended in case of nasal septum perforation.
In clinical studies, epistaxis occurred at a higher incidence compared to placebo. Epistaxis was generally self-limiting and mild in severity.
Nazofix Nasal Spray contains benzalkonium chloride which may cause nasal irritation.
Systemic Effects of Corticosteroids
Systemic effects of nasal corticosteroids may occur, particularly at high doses prescribed for prolonged periods. These effects are much less likely to occur than with oral corticosteroids and may vary in individual patients and between different corticosteroid preparations. Potential systemic effects may include Cushing’s syndrome, Cushingoid features, adrenal suppression, growth retardation in children and adolescents, cataract, glaucoma and more rarely, a range of psychological or behavioural effects including psychomotor hyperactivity, sleep disorders, anxiety, depression or aggression (particularly in children).
Following the use of intranasal corticosteroids, instances of increased intraocular pressure have been reported.
Visual disturbance may be reported with systemic and topical (including, intranasal, inhaled and intraocular) corticosteroid use. If a patient presents with symptoms such as blurred vision or other visual disturbances, the patient should be considered for referral to an ophthalmologist for evaluation of possible causes of visual disturbances which may include cataract, glaucoma or rare diseases such as central serous chorioretinopathy (CSCR) which have been reported after use of systemic and topical corticosteroids.
Patients who are transferred from long-term administration of systemically active corticosteroids to Nazofix Nasal Spray require careful attention. Systemic corticosteroid withdrawal in such patients may result in adrenal insufficiency for a number of months until recovery of HPA axis function. If these patients exhibit signs and symptoms of adrenal insufficiency or symptoms of withdrawal (e.g., joint and/or muscular pain, lassitude, and depression initially) despite relief from nasal symptoms, systemic corticosteroid administration should be resumed and other modes of therapy and appropriate measures instituted. Such transfer may also unmask pre-existing allergic conditions, such as allergic conjunctivitis and eczema, previously suppressed by systemic corticosteroid therapy.
Treatment with higher than recommended doses may result in clinically significant adrenal suppression. If there is evidence for higher than recommended doses being used, then additional systemic corticosteroid cover should be considered during periods of stress or elective surgery.
Nasal Polyps
The safety and efficacy of Nazofix Nasal Spray has not been studied for use in the treatment of unilateral polyps, polyps associated with cystic fibrosis, or polyps that completely obstruct the nasal cavities.
Unilateral polyps that are unusual or irregular in appearance, especially if ulcerating or bleeding, should be further evaluated.
Effect on Growth in Paediatric Population
It is recommended that the height of children receiving prolonged treatment with nasal corticosteroids is regularly monitored. If growth is slowed, therapy should be reviewed with the aim of reducing the dose of nasal corticosteroid if possible, to the lowest dose at which effective control of symptoms is maintained. In addition, consideration should be given to referring the patient to a paediatric specialist.
Non-nasal Symptoms
Although Nazofix Nasal Spray will control the nasal symptoms in most patients, the concomitant use of appropriate additional therapy may provide additional relief of other symptoms, particularly ocular symptoms.
If irritation or sensitisation develop with the use of Nazofix 1mg/g Cream, treatment should be withdrawn and appropriate therapy instituted.
Should an infection develop, use of an appropriate antifungal or antibacterial agent should be instituted. If a favourable response does not occur promptly, the corticosteroid should be discontinued until the infection is adequately controlled.
Systemic absorption of topical corticosteroids can produce reversible hypothalamic-pituitaryadrenal (HPA) axis suppression with the potential for glucocorticosteroid insufficiency after withdrawal of treatment. Manifestations of Cushing’s syndrome, hyperglycaemia, and glucosuria can also be produced in some patients by systemic absorption of topical corticosteroids while on treatment. Patients applying a topical steroid to a large surface area or areas under occlusion should be evaluated periodically for evidence of HPA axis suppression.
Any of the side effects that are reported following systemic use of corticosteroids, including adrenal suppression, may also occur with topical corticosteroids, especially in infants and children.
Paediatric patients may be more susceptible to systemic toxicity from equivalent doses due to their larger skin surface to body mass ratios. As the safety and efficacy of Nazofix in paediatric patients below 6 years of age have not been established, its use in this age group is not recommended.
Local and systemic toxicity is common especially following long continued use on large areas of damaged skin, in flexures and with polythene occlusion. If used in childhood, or on the face, occlusion should not be used. If used on the face, courses should be limited to 5 days and occlusion should not be used. Long term continuous therapy should be avoided in all patients irrespective of age.
Topical steroids may be hazardous in psoriasis for a number of reasons including rebound relapses following development of tolerance, risk of centralised pustular psoriasis and development of local or systemic toxicity due to impaired barrier function of the skin. If used in psoriasis careful patient supervision is important.
As with all potent topical glucocorticoids, avoid sudden discontinuation of treatment. When long term topical treatment with potent glucocorticoids is stopped, a rebound phenomenon can develop which takes the form of a dermatitis with intense redness, stinging and burning. This can be prevented by slow reduction of the treatment, for instance continue treatment on an intermittent basis before discontinuing treatment.
Glucocorticoids can change the appearance of some lesions and make it difficult to establish an adequate diagnosis and can also delay the healing.
Nazofix 1mg/g Cream contains propylene glycol which may cause skin irritation. Nazofix 1mg/g Cream contains stearyl alcohol which may cause local skin reactions (e.g. contact dermatitis).
Nazofix 1mg/g Cream topical preparations are not for ophthalmic use, including the eyelids, because of the very rare risk of glaucoma simplex or subcapsular cataract.
Visual disturbance
Visual disturbance may be reported with systemic and topical corticosteroid use. If a patient presents with symptoms such as blurred vision or other visual disturbances, the patient should be considered for referral to an ophthalmologist for evaluation of possible causes which may include cataract, glaucoma or rare diseases such as central serous chorioretinopathy (CSCR) which have been reported after use of systemic and topical corticosteroids.
Effects on ability to drive and use machines
The information provided in Effects on ability to drive and use machines of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Effects on ability to drive and use machines in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
None known.
Undesirable effects
The information provided in Undesirable effects of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Undesirable effects in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Inhalation powder; Powder for inhalation dosed
Cream for external use; Ointment for external use
Nasal dosing spray
Substance-powder
Summary of safety profile
In placebo-controlled clinical trials, oral candidiasis was very common (> 10%) in the 400 micrograms twice daily treatment group; other common (1-10%), treatment-related undesirable effects were pharyngitis, headache and dysphonia. Treatment related undesirable effects seen in clinical trials and post-marketing reporting with Nazofix Inhalation Powder use are listed below.
Tabulated list of adverse reactions
The adverse reactions reported during clinical trials and the post-marketing period are listed in the following table by treatment regimen, severity, System Organ Class and Preferred Term. Frequencies are defined as very common (> 1/10), common (> 1/100 to < 1/10), uncommon (> 1/1,000 to < 1/100), rare (> 1/10,000 to < 1/1,000), very rare (< 1/10,000) and not known (cannot be estimated from the available data).
|
System Organ Class |
QD (Once Daily Dosing) |
BID (Twice Daily Dosing) |
||
|
200 mcg |
400 mcg |
200 mcg |
400 mcg |
|
|
Infections and infestations Candidiasis |
common |
common |
common |
very common |
|
Immune system disorders Hypersensitivity reactions including rash, pruritis, angioedema and anaphylactic reaction |
not known |
not known |
not known |
not known |
|
Psychiatric disorders Psychomotor hyperactivity, sleep disorders, anxiety, depression or aggression |
not known |
not known |
not known |
not known |
|
Respiratory, thoracic and mediastinal disorders Pharyngitis Dysphonia |
common uncommon |
common common |
common common |
common common |
|
Asthma aggravation including cough, dyspnea, wheezing and bronchospasm |
not known |
not known |
not known |
not known |
|
General disorders and administration site conditions Headache |
common |
common |
common |
common |
|
Eye disorder ) |
not known |
not known |
not known |
not known |
In patients dependent on oral corticosteroids, who were treated with Nazofix 400 micrograms twice daily for 12 weeks, oral candidiasis occurred in 20 %, and dysphonia in 7 %. These effects were considered treatment-related.
Uncommonly reported adverse events were dry mouth and throat, dyspepsia, weight increase and palpitations.
As with other inhalation therapy, bronchospasm may occur (see 4.4 Special warnings and precautions for use). This should be treated immediately with a fast-acting inhaled bronchodilator. Asmanex should be discontinued immediately, the patient assessed, and if necessary alternative therapy instituted.
Systemic effects of inhaled corticosteroids may occur, particularly when prescribed at high doses for prolonged periods. These may include adrenal suppression, growth retardation in children and adolescents, and decrease in bone mineral density.
As with other inhaled corticosteroids, rare cases of glaucoma, increased intraocular pressure and/or cataracts have been reported.
As with other glucocorticoid products, the potential for hypersensitivity reactions including rashes, urticaria, pruritus and erythema and oedema of the eyes, face, lips and throat should be considered.
Reporting of suspected adverse reactions
Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Healthcare professionals are asked to report any suspected adverse reactions via the Yellow Card Scheme at: www.mhra.gov.uk/yellowcard or search for MHRA Yellow Card in the Google Play or Apple App Store.
|
Table 1: Treatment-related adverse reactions reported with Nazofix Furoate by body system and frequency Very common (>1/10); common (>1/100, <1/10); uncommon (>1/1,000, <1/100); rare (>1/10,000, <1/1,000); very rare (<1/10 000,); not known (cannot be estimated from available data) |
|
|
Infections and infestations Not known Very rare Nervous system disorders Not known Very rare Eye disorders Not known Skin and subcutaneous tissue disorders Not known Very rare General disorders and administration site conditions Not known |
Infection, furuncle Folliculitis Paraesthesia, Burning sensation <) Dermatitis contact, skin hypopigmentation, hypertrichosis, skin striae, dermatitis acneiform, skin atrophy Pruritus Application site pain, application site reactions |
Local adverse reactions reported infrequently with topical dermatalogic corticosteroids include: skin dryness, irritation, dermatitis, perioral dermatitis, maceration of the skin, miliaria and telangiectasiae.
Paediatric patients may demonstrate greater susceptibility to topical corticosteroid-induced hypothalamic-pituitary-adrenal axis suppression and Cushing’s syndrome than mature patients because of a larger skin surface area to body weight ratio.
Chronic corticosteroids therapy may interfere with the growth and development of children.
Reporting of suspected adverse reactions
Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Healthcare professionals are asked to report any suspected adverse reactions via the Yellow Card Scheme Website: www.mhra.gov.uk/yellowcard.
Summary of the safety profile
Epistaxis was generally self-limiting and mild in severity, and occurred at a higher incidence compared to placebo (5%), but at a comparable or lower incidence when compared to the active control nasal corticosteroids studied (up to 15%) as reported in clinical studies for allergic rhinitis. The incidence of all other adverse events was comparable with that of placebo. In patients treated for nasal polyposis, the overall incidence of adverse events was similar to that observed for patients with allergic rhinitis.
Systemic effects of nasal corticosteroids may occur, particularly when prescribed at high doses for prolonged periods.
Tabulated list of adverse reactions
Treatment related adverse reactions (>1%) reported in clinical trials in patients with allergic rhinitis or nasal polyposis and post-marketing regardless of indication are presented in Table 1. Adverse reactions are listed according to MedDRA primary system organ class. Within each system organ class, adverse reactions are ranked by frequency. Frequencies were defined as follows: Very common (>1/10); common (>1/100 to <1/10); uncommon (>1/1,000 to <1/100). The frequency of post-marketing adverse events are considered as “not known (cannot be estimated from the available data)â€.
|
Table 1: Treatment-related adverse reactions reported by system organ class and frequency |
|||
|
Very common |
Common |
Not known |
|
|
Infections and infestations |
Pharyngitis Upper respiratory tract infection†|
||
|
Immune system disorders |
Hypersensitivity including anaphylactic reactions, angioedema, bronchospasm, and dyspnoea |
||
|
Nervous system disorders |
Headache |
||
|
Eye disorders |
Glaucoma Increased intraocular pressure Cataracts ) |
||
|
Respiratory, thoracic and mediastinal disorders |
Epistaxis* |
Epistaxis Nasal burning Nasal irritation Nasal ulceration |
Nasal septum perforation |
|
Gastrointestinal disorders |
Throat irritation* |
Disturbances of taste and smell |
*recorded for twice daily dosing for nasal polyposis
†recorded at uncommon frequency for twice daily dosing for nasal polyposis
Paediatric population
In the paediatric population, the incidence of recorded adverse events in clinical studies, e.g., epistaxis (6%), headache (3%), nasal irritation (2%) and sneezing (2%) was comparable to placebo.
Reporting of suspected adverse reactions
Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Healthcare professionals are asked to report any suspected adverse reactions via the Yellow Card Scheme at: www.mhra.gov.uk/yellowcard or search for MHRA Yellow Card in the Google Play or Apple App Store.
|
Table 1: Treatment-related adverse reactions reported with Nazofix by body system and frequency Very common (>1/10); common (>1/100, <1/10); uncommon (>1/1,000, <1/100); rare (>1/10,000, <1/1,000); very rare (<1/10 000,); not known (cannot be estimated from available data) |
|
|
Infections and infestations Not known Very rare Nervous system disorders Not known Very rare Eye disorders Not known Skin and subcutaneous tissue disorders Not known Very rare General disorders and administration site conditions Not known |
Infection, furuncle Folliculitis Paraesthesia, Burning sensation <) Dermatitis contact, skin hypopigmentation, hypertrichosis, skin striae, dermatitis acneiform, skin atrophy Pruritus Application site pain, application site reactions |
Local adverse reactions reported infrequently with topical dermatalogic corticosteroids include: skin dryness, irritation, dermatitis, perioral dermatitis, maceration of the skin, miliaria and telangiectasiae.
Paediatric patients may demonstrate greater susceptibility to topical corticosteroid-induced hypothalamic-pituitary-adrenal axis suppression and Cushing’s syndrome than mature patients because of a larger skin surface area to body weight ratio.
Chronic corticosteroids therapy may interfere with the growth and development of children.
Reporting of suspected adverse reactions
Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Healthcare professionals are asked to report any suspected adverse reactions via the Yellow Card Scheme Website: www.mhra.gov.uk/yellowcard.
Overdose
The information provided in Overdose of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Overdose in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Symptoms
Inhalation or oral administration of excessive doses of corticosteroids may lead to suppression of HPA axis function.
Management
Because the systemic bioavailability of Nazofix Nasal Spray is <1%, overdose is unlikely to require any therapy other than observation, followed by initiation of the appropriate prescribed dosage.
Pharmacodynamic properties
The information provided in Pharmacodynamic properties of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Pharmacodynamic properties in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Inhalation powder; Powder for inhalation dosed
Cream for external use; Ointment for external use
Nasal dosing spray
Substance-powder
Pharmacotherapeutic group: Other Antiasthmatics, Inhalants, — Glucocorticoids, ATC code R03B A07
Mechanism of action
Mometasone furoate is a topical glucocorticoid with local anti-inflammatory properties.
It is likely that much of the mechanism for the effects of mometasone furoate lies in its ability to inhibit the release of mediators of the inflammatory cascade.In vitro, mometasone furoate inhibits the release of leukotrienes from leukocytes of allergic patients. In cell culture, mometasone furoate demonstrated high potency in inhibition of synthesis and release of IL-1, IL-5, IL-6, and TNF-alpha; it is also a potent inhibitor of LT production and in addition it is an extremely potent inhibitor of the production of the Th2 cytokines, IL-4 and IL-5, from human CD4+ T-cells.
Pharmacodynamic effects
Mometasone furoate has been shown in vitro to exhibit a binding affinity for the human glucocorticoid receptor which is approximately 12 times that of dexamethasone, 7 times that of triamcinolone acetonide, 5 times that of budesonide, and 1.5 times that of fluticasone.
In a clinical trial, inhaled mometasone furoate has been shown to reduce airway reactivity to adenosine monophosphate in hyperreactive patients. In another trial, pretreatment using the Nazofix for five days significantly attenuated the early and late phase reactions following inhaled allergen challenge and also reduced allergen-induced hyperresponsiveness to methacholine.
Inhaled mometasone furoate treatment was also shown to attenuate the increase in inflammatory cells (total and activated eosinophils) in induced sputum following allergen and methacholine challenge. The clinical significance of these findings is not known.
Clinical efficacy and safety
In asthmatic patients, repeated administration of inhaled mometasone furoate for 4 weeks at doses of 200 micrograms twice daily to 1200 micrograms once daily showed no evidence of clinically relevant HPA-axis suppression at any dose level and was associated with detectable systemic activity only at a dose of 1600 micrograms per day.
In long-term clinical trials using doses up to 800 micrograms per day, there was no evidence of HPA axis suppression, as assessed by reductions in morning plasma cortisol levels or abnormal responses to cosyntropin.
In a 28 day clinical trial involving 60 asthmatic patients, administration of Nazofix at doses of 400 micrograms, 800 micrograms or 1200 micrograms once daily, or 200 micrograms twice daily, did not result in a statistically significant decrease in 24-hour plasma cortisol AUC.
The potential systemic effect of twice daily dosing of mometasone furoate was evaluated in an active and placebo controlled trial that compared 24-hour plasma cortisol AUC in 64 adult asthmatic patients treated for 28 days with mometasone furoate 400 micrograms twice daily, 800 micrograms twice daily, or prednisone 10 mg once daily. Mometasone furoate 400 micrograms twice daily treatment reduced plasma cortisol AUC(0-24) values from placebo values by 10 — 25 %. Mometasone furoate 800 micrograms twice daily reduced plasma cortisol AUC(0-24) from placebo values by 21 — 40 %. Reduction in cortisol was significantly greater after prednisone 10 mg once daily than with placebo or either of the mometasone treatment groups.
Double-blind placebo-controlled trials of 12-weeks duration have shown that treatment with Nazofix at delivered doses within the range of 200 micrograms (once-daily in the evening) — 800 micrograms per day resulted in improved lung function as measured by FEV1 and peak expiratory flow, improved asthma symptom control, and decreased need for inhaled beta2--agonist. Improved lung function was observed within 24 hours of the start of treatment in some patients, although maximum benefit was not achieved before 1 to 2 weeks or longer. Improved lung function was maintained for the duration of treatment.
Nazofix furoate exhibits marked anti-inflammatory activity and marked anti-psoriatic activity in standard animal predictive models.
In the croton oil assay in mice, Nazofix was equipotent to betamethasone valerate after single application and about 8 times as potent after five applications.
In guinea pigs, Nazofix was approximately twice as potent as betamethasone valerate in reducing m.ovalis-induced epidermal acanthosis (i.e. anti-psoriatic activity) after 14 applications.
Pharmacotherapeutic group: Decongestants and Other Nasal Preparations for Topical Use-Corticosteroids, ATC code: R01A D09
Mechanism of action
Mometasone furoate is a topical glucocorticosteroid with local anti-inflammatory properties at doses that are not systemically active.
It is likely that much of the mechanism for the anti-allergic and anti-inflammatory effects of mometasone furoate lies in its ability to inhibit the release of mediators of allergic reactions. Mometasone furoate significantly inhibits the release of leukotrienes from leucocytes of allergic patients. In cell culture, mometasone furoate demonstrated high potency in inhibition of synthesis and release of IL-1, IL-5, IL-6 and TNFα; it is also a potent inhibitor of leukotriene production. In addition, it is an extremely potent inhibitor of the production of the Th2 cytokines, IL-4 and IL-5, from human CD4+ T-cells.
Pharmacodynamic effects
In studies utilising nasal antigen challenge, Nazofix Nasal Spray has shown anti-inflammatory activity in both the early- and late- phase allergic responses. This has been demonstrated by decreases (vs placebo) in histamine and eosinophil activity and reductions (vs baseline) in eosinophils, neutrophils, and epithelial cell adhesion proteins.
In 28% of the patients with seasonal allergic rhinitis, Nazofix Nasal Spray demonstrated a clinically significant onset of action within 12 hours after the first dose. The median (50%) onset time of relief was 35.9 hours.
Paediatric population
In a placebo-controlled clinical trial in which paediatric patients (n=49/group) were administered Nazofix Nasal Spray 100 micrograms daily for one year, no reduction in growth velocity was observed.
There are limited data available on the safety and efficacy of Nazofix Nasal Spray in the paediatric population aged 3 to 5 years, and an appropriate dosage range cannot be established. In a study involving 48 children aged 3 to 5 years treated with intranasal mometasone furoate 50, 100 or 200 μg/day for 14 days, there was no significant differences from placebo in the mean change in plasma cortisol level in response to the tetracosactrin stimulation test.
).
Nazofix exhibits marked anti-inflammatory activity and marked anti-psoriatic activity in standard animal predictive models.
In the croton oil assay in mice, mometasone was equipotent to betamethasone valerate after single application and about 8 times as potent after five applications.
In guinea pigs, mometasone was approximately twice as potent as betamethasone valerate in reducing m.ovalis-induced epidermal acanthosis (i.e. anti-psoriatic activity) after 14 applications.
Pharmacokinetic properties
The information provided in Pharmacokinetic properties of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Pharmacokinetic properties in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Inhalation powder; Powder for inhalation dosed
Cream for external use; Ointment for external use
Nasal dosing spray
Substance-powder
Absorption
The systemic bioavailability of mometasone furoate following oral inhalation in healthy volunteers is low, due to poor absorption from the lungs and the gut and extensive pre-systemic metabolism. Plasma concentrations of mometasone following inhalation at the recommended doses of 200 micrograms to 400 micrograms per day were generally near or below the limit of quantification (50 pg/ml) of the analytical assay and were highly variable.
Distribution
After intravenous bolus administration, the Vd is 332 l. The in vitro protein binding for mometasone furoate is high, 98 % to 99 % in concentration range of 5 to 500 ng/ml.
Biotransformation
The portion of an inhaled mometasone furoate dose that is swallowed and absorbed in the gastrointestinal tract undergoes extensive metabolism to multiple metabolites. There are no major metabolites detectable in plasma. In human liver microsomes, mometasone is metabolised by cytochrome P-450 3A4 (CYP3A4).
Elimination
After intravenous bolus administration, mometasone furoate has a terminal elimination T1/2 of approximately 4.5 hours. A radiolabelled, orally inhaled dose is excreted mainly in the feces (74 %) and to a lesser extent in the urine (8 %).
Pharmacokinetic studies have indicated that systemic absorption following topical application of Nazofix furoate cream 1mg/g is minimal, approximately 0.4% of the applied dose in man, the majority of which is excreted within 72 hours following application. Characterisation of metabolites was not feasible owing to the small amounts present in plasma and excreta.
Absorption
Mometasone furoate, administered as an aqueous nasal spray, has a systemic bioavailability of <1% in plasma, using a sensitive assay with a lower quantitation limit of 0.25 pg/ml.
Distribution
Not applicable as mometasone is poorly absorbed via the nasal route.
Biotransformation
The small amount that may be swallowed and absorbed undergoes extensive first-pass hepatic metabolism.
Elimination
Absorbed mometasone furoate is extensively metabolized and the metabolites are excreted in urine and bile.
Pharmacokinetic studies have indicated that systemic absorption following topical application of Nazofix cream 1mg/g is minimal, approximately 0.4% of the applied dose in man, the majority of which is excreted within 72 hours following application. Characterisation of metabolites was not feasible owing to the small amounts present in plasma and excreta.
Pharmacotherapeutic group
The information provided in Pharmacotherapeutic group of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Pharmacotherapeutic group in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Inhalation powder; Powder for inhalation dosed
Nasal dosing spray
Other Antiasthmatics, Inhalants, — Glucocorticoids, ATC code R03B A07
Decongestants and Other Nasal Preparations for Topical Use-Corticosteroids, ATC code: R01A D09
Preclinical safety data
The information provided in Preclinical safety data of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Preclinical safety data in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
No toxicological effects unique to mometasone furoate exposure were demonstrated. All observed effects are typical of this class of compounds and are related to exaggerated pharmacologic effects of glucocorticoids.
Preclinical studies demonstrate that mometasone furoate is devoid of androgenic, antiandrogenic, estrogenic or antiestrogenic activity but, like other glucocorticoids, it exhibits some antiuterotrophic activity and delays vaginal opening in animal models at high oral doses of 56 mg/kg/day and 280 mg/kg/day.
Like other glucocorticoids, mometasone furoate showed a clastogenic potential in-vitro at high concentrations. However, no mutagenic effects can be expected at therapeutically relevant doses.
In studies of reproductive function, subcutaneous mometasone furoate, at 15 micrograms/kg prolonged gestation and prolonged and difficult labour occurred with a reduction in offspring survival and body weight or body weight gain. There was no effect on fertility.
Like other glucocorticoids, mometasone furoate is a teratogen in rodents and rabbits. Effects noted were umbilical hernia in rats, cleft palate in mice and gallbladder agenesis, umbilical hernia, and flexed front paws in rabbits. There were also reductions in maternal body weight gains, effects on foetal growth (lower foetal body weight and/or delayed ossification) in rats, rabbits and mice, and reduced offspring survival in mice.
The carcinogenicity potential of inhaled mometasone furoate (aerosol with CFC propellant and surfactant) at concentrations of 0.25 to 2.0 micrograms/l was investigated in 24-month studies in mice and rats. Typical glucocorticoid-related effects, including several non-neoplastic lesions, were observed. No statistically significant dose-response relationship was detected for any of the tumour types.
Special precautions for disposal and other handling
The information provided in Special precautions for disposal and other handling of Nazofix
is based on data of another medicine with exactly the same composition as the Nazofix.
. Be careful and be sure to specify the information on the section Special precautions for disposal and other handling in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
more…
Any unused medicinal product or waste material should be disposed of in accordance with local requirements.
Available in countries
Find in a country:
Назонекс® (Nasonex®) инструкция по применению
📜 Инструкция по применению Назонекс®
💊 Состав препарата Назонекс®
✅ Применение препарата Назонекс®
📅 Условия хранения Назонекс®
⏳ Срок годности Назонекс®
Описание лекарственного препарата
Назонекс®
(Nasonex®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2021
года, дата обновления: 2021.01.13
Лекарственные формы
| Назонекс® |
Спрей назальный дозированный 50 мкг/1 доза: фл. 10 г (60 доз) 1 шт. или 15 г (120 доз) 1, 2, 3 шт. в компл. с дозир. устройством рег. №: П N014744/01 |
|
|
Спрей назальный дозированный 50 мкг/1 доза: фл. 10 г (60 доз) 1 шт. или 158 г (120 доз) 1, 2, 3 шт. в компл. с дозир. устройством рег. №: П N014744/01 |
Форма выпуска, упаковка и состав
препарата Назонекс®
Спрей назальный дозированный 50 мкг/1 доза в виде суспензии белого или почти белого цвета.
Вспомогательные вещества: целлюлоза дисперсная (целлюлоза микрокристаллическая, обработанная кармеллозой натрия) — 20 мг, глицерол — 21 мг, лимонной кислоты моногидрат — 2 мг, натрия цитрата дигидрат — 2.8 мг, полисорбат 80 — 0.1 мг, бензалкония хлорид (в виде 50% раствора) — 0.2 мг, вода очищенная — 0.95 г.
10 г (60 доз) — флаконы полиэтиленовые (1) в комплекте с дозирующим устройством — пачки картонные.
18 г (120 доз) — флаконы полиэтиленовые (1) в комплекте с дозирующим устройством — пачки картонные.
18 г (120 доз) — флаконы полиэтиленовые (2) в комплекте с дозирующим устройством — пачки картонные.
18 г (120 доз) — флаконы полиэтиленовые (3) в комплекте с дозирующим устройством — пачки картонные.
Фармакологическое действие
Синтетический ГКС для местного применения. Оказывает противовоспалительное и противоаллергическое действие при применении в дозах, при которых не возникает системных эффектов.
Тормозит высвобождение медиаторов воспаления. Повышает продукцию липомодулина, являющегося ингибитором фосфолипазы А, что обусловливает снижение высвобождения арахидоновой кислоты и, соответственно, угнетение синтеза продуктов метаболизма арахидоновой кислоты — циклических эндопероксидов, простагландинов. Предупреждает краевое скопление нейтрофилов, что уменьшает воспалительный экссудат и продукцию лимфокинов, тормозит миграцию макрофагов, приводит к уменьшению процессов инфильтрации и грануляции. Уменьшает воспаление за счет снижения образования субстанции хемотаксиса (влияние на поздние реакции аллергии), тормозит развитие аллергической реакции немедленного типа (обусловлено торможением продукции метаболитов арахидоновой кислоты и снижением высвобождения из тучных клеток медиаторов воспаления).
В исследованиях с провокационными тестами с нанесением антигенов на слизистую оболочку полости носа была продемонстрирована высокая противовоспалительная активность мометазона, как на ранней, так и на поздней стадиях аллергической реакции. Это было подтверждено снижением (по сравнению с плацебо) концентрации гистамина и активности эозинофилов, а также уменьшением (по сравнению с исходным уровнем) количества эозинофилов, нейтрофилов и белков адгезии эпителиальных клеток.
Фармакокинетика
Всасывание
При интраназальном применении системная биодоступность мометазона фуроата составляет <1% (при чувствительности метода определения 0.25 пг/мл).
Мометазон очень плохо всасывается из ЖКТ.
Метаболизм и выведение
Небольшое количество активного вещества, которое может попасть в ЖКТ после интраназального применения, подвергается активному метаболизму при «первом прохождении» через печень. Выводится с мочой и желчью.
Показания препарата
Назонекс®
- сезонный и круглогодичный аллергические риниты у взрослых, подростков и детей с 2 лет;
- острый синусит или обострение хронического синусита у взрослых (в т.ч. пожилого возраста) и подростков с 12 лет — в качестве вспомогательного терапевтического средства при лечении антибиотиками;
- острый риносинусит с легкими и умеренно выраженными симптомами без признаков тяжелой бактериальной инфекции у пациентов в возрасте 12 лет и старше;
- профилактика сезонного аллергического ринита среднетяжелого и тяжелого течения у взрослых и подростков с 12 лет (рекомендуется проводить за 2-4 недели до предполагаемого начала сезона пыления);
- полипоз носа, сопровождаемый нарушением носового дыхания и обоняния у взрослых (от 18 лет).
Режим дозирования
Препарат применяют интраназально.
Лечение сезонного или круглогодичного аллергического ринита
Взрослые (в т.ч. пациенты пожилого возраста) и подростки с 12 лет
Рекомендуемая профилактическая и терапевтическая доза препарата составляет 2 впрыскивания (по 50 мкг мометазона фуроата каждое) в каждый носовой ход 1 раз/сут (суммарная суточная доза — 200 мкг). По достижении лечебного эффекта для поддерживающей терапии возможно уменьшение дозы до 1 впрыскивания в каждый носовой ход 1 раз/сут (суммарная суточная доза — 100 мкг).
Если уменьшения симптомов заболевания не удается достичь применением препарата в рекомендуемой терапевтической дозе, суточная доза может быть увеличена до 4 впрыскиваний в каждый носовой ход 1 раз/сут (суммарная суточная доза — 400 мкг). После уменьшения симптомов заболевания рекомендуется снижение дозы.
Начало действия препарата обычно отмечается клинически уже через 12 ч после первого применения препарата.
Дети в возрасте от 2 до 11 лет
Рекомендуемая терапевтическая доза — 1 впрыскивание (50 мкг) в каждую ноздрю 1 раз/сут (суммарная суточная доза — 100 мкг).
Для применения препарата у детей младшего возраста требуется помощь взрослых.
Вспомогательное лечение острого синусита или обострения хронического синусита
Взрослые (в т.ч. пациенты пожилого возраста) и подростки с 12 лет
Рекомендуемая терапевтическая доза составляет 2 ингаляции (по 50 мкг мометазона фуроата каждое) в каждый носовой ход 2 раза/сут (суммарная суточная доза — 400 мкг).
Если уменьшения симптомов заболевания не удается достичь применением препарата в рекомендуемой терапевтической дозе, суточная доза может быть увеличена до 4 впрыскиваний в каждый носовой ход 2 раза/сут (суммарная суточная доза — 800 мкг). После уменьшения симптомов заболевания рекомендуется снижение дозы.
Лечение острого риносинусита без признаков тяжелой бактериальной инфекции
Рекомендуемая доза для взрослых и подростков составляет 2 впрыскивания (по 50 мкг мометазона фуроата каждое) в каждый носовой ход 2 раза/сут (суммарная суточная доза 400 мкг). При ухудшении симптомов в ходе лечения необходима консультация специалиста.
Лечение полипоза носа
Для взрослых (в т.ч. пациентов пожилого возраста) от 18 лет рекомендуемая терапевтическая доза составляет 2 впрыскивания (по 50 мкг мометазона фуроата каждое) в каждый носовой ход 2 раза/сут (суммарная суточная доза — 400 мкг).
После уменьшения симптомов заболевания рекомендуется снижение дозы до 2 впрыскиваний (по 50 мкг мометазона фуроата каждое) в каждый носовой ход 1 раз/сут (суммарная суточная доза — 200 мкг).
Правила использования препарата Назонекс®
Впрыскивание суспензии, содержащейся во флаконе, осуществляется при помощи специальной дозирующей насадки на флаконе.
Перед первым применением назального спрея Назонекс® необходимо провести калибровку путем нажатия на дозирующую насадку 10 раз или до появления однородного спрея, что свидетельствует о готовности препарата к применению. не следует прокалывать назальный аппликатор.
Следует наклонить голову и впрыснуть лекарственное средство в каждый носовой ход так, как рекомендовал лечащий врач.
Если лекарственный препарат не использовался в течение 14 дней или дольше, необходимо нажать на дозирующую насадку 2 раза или до появления однородного спрея.
Перед каждым применением необходимо интенсивно встряхивать флакон.
Чистка дозирующей насадки
Важно регулярно чистить дозирующую насадку, чтобы избежать ее неправильной работы. Следует снять колпачок, защищающий насадку от пыли, затем аккуратно снять наконечник для распыления. Необходимо тщательно промыть наконечник для распыления и колпачок для защиты от пыли в теплой воде и ополоснуть под краном.
Не следует пытаться открыть назальный аппликатор с помощью иглы или другого острого предмета, т.к. это приведет к повреждению аппликатора, в результате чего можно получить неправильную дозу препарата.
Следует высушить колпачок и наконечник в теплом месте. После этого необходимо прикрепить наконечник для распыления на флакон и снова прикрутить к флакону колпачок для защиты от пыли. При первом применении назального спрея после очистки необходимо провести повторную калибровку путем нажатия на дозирующую насадку 2 раза.
Побочное действие
Применение лекарственного препарата в клинических исследованиях
Нежелательные явления, связанные с применением препарата (≥1%), выявленные в ходе клинических исследований у пациентов с аллергическим ринитом или полипозом носа, и в период пострегистрационного применения препарата, независимо от показания к применению, представлены в таблице 1. Нежелательные реакции перечислены в соответствии с классификацией системно-органных классов MedDRA. В пределах каждого системно-органного класса нежелательные реакции классифицированы по частоте возникновения.
Носовые кровотечения, как правило, были умеренными и прекращались самостоятельно, частота их возникновения была несколько большей, чем при использовании плацебо (5%), но равной или меньшей, чем при назначении других интраназальных ГКС, которые использовались в качестве активного контроля (у некоторых из них частота возникновения носовых кровотечений составляла до 15%). Частота возникновения всех других нежелательных явлений была сопоставимой с частотой их возникновения при назначении плацебо.
Общая частота возникновения нежелательных явлений у пациентов, получавших лечение в отношении назального полипоза, была сопоставима с частотой возникновения у пациентов с аллергическим ринитом.
Общая частота возникновения нежелательных явлений у пациентов, получавших лечение в отношении острого риносинусита, была сопоставима с частотой возникновения у пациентов с аллергическим ринитом и при назначении плацебо.
При применении интраназальных ГКС возможно развитие системных побочных эффектов, особенно при длительном применении интраназальных ГКС в высоких дозах (см. раздел «Особые указания»).
Таблица 1
* Выявлено с частотой «редко» при применении препарата 2 раза/сут при полипозе носа.
** Выявлено при применении препарата 2 раза/сут при полипозе носа.
Дети
Со стороны дыхательной системы: носовые кровотечения (6%), раздражение слизистой оболочки носа (2%), чиханье (2%).
Со стороны нервной системы: головная боль (3%).
Частота возникновения указанных нежелательных явлений у детей была сопоставима с частотой их возникновения при применении плацебо.
Пострегистрационное применение лекарственного препарата
Во время пострегистрационного применения лекарственного препарата Назонекс® дополнительно были выявлены нежелательные реакции: нечеткое зрение.
Противопоказания к применению
- гиперчувствительность к какому-либо из веществ, входящих в состав препарата;
- недавнее оперативное вмешательство или травма носа с повреждением слизистой оболочки носовой полости — до заживления раны (в связи с ингибирующим действием ГКС на процессы заживления);
- детский возраст (при сезонном и круглогодичном аллергических ринитах — до 2 лет, при остром синусите или обострении хронического синусита — до 12 лет, при полипозе — до 18 лет) — в связи с отсутствием соответствующих данных.
С осторожностью следует применять препарат при туберкулезной инфекции (активной или латентной) респираторного тракта, нелеченной грибковой, бактериальной, системной вирусной инфекции или инфекции, вызванной Herpes simplex с поражением глаз (в виде исключения возможно назначение препарата при перечисленных инфекциях по указанию врача), наличии нелеченной местной инфекции с вовлечением в процесс слизистой оболочки носовой полости.
Применение при беременности и кормлении грудью
Соответствующим образом спланированных и хорошо контролируемых исследований препарата у беременных не проводилось.
Как и при применении других интраназальных ГКС препарат Назонекс® следует назначать беременным или кормящим грудью женщинам только в случае, если ожидаемая польза от назначения препарата оправдывает потенциальный риск для плода или младенца.
Младенцы, матери которых во время беременности получали ГКС, должны тщательно наблюдаться на предмет возможности развития гипофункции надпочечников.
Применение у детей
Противопоказан при сезонном и круглогодичном аллергических ринитах — в детском возрасте до 2 лет, при остром синусите или обострении хронического синусита — до 12 лет, при полипозе — до 18 лет (в связи с отсутствием соответствующих данных).
Особые указания
Как и при любом долгосрочном лечении, пациенты, применяющие назальный спрей Назонекс® в течение нескольких месяцев и дольше, должны периодически проходить осмотр у врача на предмет возможных изменений слизистой оболочки носа. Необходимо проводить мониторинг за пациентами, получающими интраназальные ГКС длительное время. Возможно развитие задержки роста у детей. В случае выявления задержки роста у детей необходимо снизить дозу интраназальных ГКС до наименьшей, позволяющей эффективно контролировать симптомы. Кроме того, следует направить пациента на консультацию к педиатру.
В случае развития местной грибковой инфекции носа или глотки может потребоваться прекращение терапии назальным спреем Назонекс® и проведение специального лечения. Сохраняющееся в течение длительного времени раздражение слизистой оболочки носа и глотки также может служить основанием для прекращения лечения назальным спреем Назонекс®.
При проведении плацебо-контролируемых клинических исследований у детей, когда назальный спрей Назонекс® применялся в суточной дозе 100 мкг в течение года, задержки роста у детей не отмечалось.
При продолжительном лечении назальным спреем Назонекс® признаков подавления функции гипоталамо-гипофизарно-надпочечниковой системы не наблюдалось. Пациенты, которые переходят к лечению назальным спреем Назонекс® после длительной терапии ГКС системного действия, требуют к себе особого внимания. Отмена ГКС системного действия у таких пациентов может привести к недостаточности функции надпочечников, последующее восстановление которой может занять до нескольких месяцев. В случае появления признаков надпочечниковой недостаточности следует возобновить прием системных ГКС и принять другие необходимые меры.
При применении интраназальных ГКС возможно развитие системных побочных эффектов, особенно при длительном применении в высоких дозах. Вероятность развития этих эффектов значительно меньше, чем при применении пероральных ГКС. Системные побочные эффекты могут различаться как у отдельных пациентов, так и в зависимости от применяемого ГКС. Потенциальные системные эффекты включают в себя синдром Кушинга, характерные признаки кушингоида, подавление функции надпочечников, задержку роста у детей и подростков, катаракту, глаукому и реже ряд психологических или поведенческих эффектов, включая психомоторную гиперактивность, нарушение сна, тревогу, депрессию или агрессию (особенно у детей).
Во время перехода от лечения ГКС системного действия к лечению назальным спреем Назонекс® у некоторых пациентов могут возникнуть начальные симптомы отмены системных ГКС (например, боли в суставах и/или мышцах, чувство усталости и депрессия), несмотря на уменьшение выраженности симптомов, связанных с поражением слизистой оболочки носа. Таких пациентов необходимо специально убеждать в целесообразности продолжения лечения назальным спреем Назонекс®. Переход от системных к местным ГКС может также выявить уже существовавшие, но маскировавшиеся терапией ГКС системного действия аллергические заболевания, такие как аллергический конъюнктивит и экзема.
Пациенты, которым проводится лечение ГКС, обладают потенциально сниженной иммунной реактивностью и должны быть предупреждены о повышенном для них риске заражения в случае контакта с больными некоторыми инфекционными заболеваниями (например, ветряной оспой, корью), а также о необходимости врачебной консультации, если такой контакт произошел. При появлении признаков выраженной бактериальной инфекции (например, лихорадки, упорной и резкой боли с одной стороны лица или зубной боли, припухлости в орбитальной или периорбитальной области) требуется немедленная врачебная консультация.
При применении назального спрея Назонекс® в течение 12 месяцев не возникало признаков атрофии слизистой оболочки носа. Кроме того, мометазона фуроат проявлял тенденцию способствовать нормализации гистологической картины при исследовании биоптатов слизистой оболочки носа.
При системном и местном (включая интраназальное, ингаляционное и внутриглазное) применении ГКС могут возникнуть нарушения зрения. Если у пациента присутствуют такие симптомы, как нечеткое зрение или другие нарушения зрения, необходимо рекомендовать пациенту обратиться к офтальмологу для выявления возможных причин нарушений зрения, включающих катаракту, глаукому или редкие заболевания, например, центральную серозную хориоретинопатию (ЦСХ), которые наблюдались в ряде случаев при системном и местном применении ГКС.
Эффективность и безопасность мометазона не изучена при лечении односторонних полипов, полипов, связанных с муковисцидозом и полипов, которые полностью закрывают носовую полость.
В случае выявления односторонних полипов необычной или неправильной формы, особенно изъязвленных или кровоточащих, необходимо провести дополнительное медицинское обследование.
Влияние на способность к управлению транспортными средствами и механизмами
Нет данных о влиянии препарата Назонекс® на способность управлять транспортными средствами или движущимися механизмами.
Передозировка
При длительном применении ГКС в высоких дозах, а также при одновременном использовании нескольких ГКС возможно угнетение гипоталамо-гипофизарно-надпочечниковой системы. Вследствие малой системной биодоступности препарата (<1%, при чувствительности метода определения 0.25 пг/мл) маловероятно, что при случайной или намеренной передозировке потребуется принятие каких-либо мер помимо наблюдения с возможным последующим возобновлением приема препарата в рекомендованной дозе.
Лекарственное взаимодействие
Комбинированная терапия с лоратадином хорошо переносилась пациентами. При этом не было отмечено какого-либо влияния препарата на концентрацию лоратадина или его основного метаболита в плазме крови. В этих исследованиях мометазона фуроат в плазме крови обнаружен не был (при чувствительности метода определения 50 пг/мл).
Мометазона фуроат метаболизируется CYP3A4. Совместное применение с сильными ингибиторами CYP3A4 (например, кетоконазолом, итраконазолом, кларитромицином, ритонавиром, лекарственными препаратами, содержащими кобицистат) может приводить к увеличению концентрации ГКС в плазме крови и, возможно, к увеличению риска возникновения системных побочных эффектов глюкокортикоидной терапии. Следует оценить преимущества совместного назначения мометазона фуроата с сильными ингибиторами CYP3A4 и потенциальный риск развития системных побочных эффектов ГКС. В случае совместного применения препаратов требуется мониторинг состояния пациентов на предмет развития системных побочных эффектов глюкокортикоидной терапии.
Условия хранения препарата Назонекс®
Препарат следует хранить в недоступном для детей месте при температуре от 2° до 25°C. Не замораживать.
Срок годности препарата Назонекс®
Срок годности — 2 года. Не использовать по истечении срока годности.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
МСД ФАРМАСЬЮТИКАЛС ООО
(Россия)

|
|
119021 Москва, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Аллергомекс
(ФОРТИВА МЕД, Республика Беларусь)
Дезринит
(Teva Pharmaceutical Industries, Израиль)
Дезринит Аллержи
(ACTAVIS GROUP PTC ehf., Исландия)
Дитамал®
(WORLD MEDICINE ILAC SAN. VE TIC. A.S., Турция)
Момат Рино
(Dr. Reddy`s Laboratories, Индия)
Момезал Аллерго
(Pharmaceutical Works «POLPHARMA», Польша)
Моменза
(ZENTIVA, Чешская Республика)
Мометазон
(ТУЛЬСКАЯ ФАРМАЦЕВТИЧЕСКАЯ ФАБРИКА, Россия)
Мометазон Сандоз®
(SANDOZ, Словения)
Назонекс алерджи
(ОРГАНОН, Россия)
Все аналоги
Описание препарата Назонекс® (спрей назальный дозированный, 50 мкг/доза) основано на официальной инструкции, утверждено компанией-производителем в 2021 году
Дата согласования: 04.05.2021
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Комментарий
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Назонекс®
- Заказ в аптеках Москвы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Спрей назальный дозированный | 1 г |
| действующее вещество: | |
| мометазона фуроат | 0,5 мг |
| (микронизированный, в виде моногидрата, в эквиваленте мометазона фуроату безводному) | |
| вспомогательные вещества: целлюлоза дисперсная (МКЦ, обработанная кармеллозой натрия) — 20,0 мг; глицерол — 21,0 мг; лимонной кислоты моногидрат — 2,0 мг; натрия цитрата дигидрат — 2,8 мг; полисорбат 80 — 0,1 мг; бензалкония хлорид (в виде 50% раствора) — 0,2 мг; вода очищенная — 0,95 г |
Описание лекарственной формы
Суспензия белого или почти белого цвета.
Фармакологическое действие
Фармакологическое действие
—
глюкокортикоидное (местное), противовоспалительное местное, противоаллергическое местное.
Фармакодинамика
Мометазон является синтетическим ГКС для местного применения. Оказывает противовоспалительное и противоаллергическое действие при применении в дозах, при которых не возникает системных эффектов. Тормозит высвобождение медиаторов воспаления, повышает продукцию липомодулина, являющегося ингибитором фосфолипазы А, что обусловливает снижение высвобождения арахидоновой кислоты и, соответственно, угнетение синтеза продуктов метаболизма арахидоновой кислоты — циклических эндоперекисей, ПГ. Предупреждает краевое скопление нейтрофилов, уменьшает воспалительный экссудат и продукцию лимфокинов, тормозит миграцию макрофагов, приводит к уменьшению процессов инфильтрации и грануляции. Уменьшает воспаление за счет снижения образования субстанции хемотаксиса (влияние на поздние реакции аллергии), тормозит развитие аллергической реакции немедленного типа (обусловлено торможением продукции метаболитов арахидоновой кислоты и снижением высвобождения из тучных клеток медиаторов воспаления).
В исследованиях с провокационными тестами при нанесении антигенов на слизистую оболочку носовой полости была продемонстрирована высокая противовоспалительная активность мометазона как в ранней, так и в поздней стадии аллергической реакции. Это было подтверждено снижением (по сравнению с плацебо) уровня гистамина и активности эозинофилов, а также уменьшением (по сравнению с исходным уровнем) числа эозинофилов, нейтрофилов и белков адгезии эпителиальных клеток.
Фармакокинетика
При интраназальном применении системная биодоступность мометазона фуроата составляет <1% (при чувствительности метода определения 0,25 пг/мл). Суспензия мометазона очень плохо всасывается в ЖКТ, и то небольшое количество суспензии мометазона, которое может попасть в ЖКТ после впрыскивания в носовой ход, еще до экскреции с мочой или желчью подвергается активному первичному метаболизму.
Показания
- сезонный и круглогодичный аллергические риниты у взрослых, подростков и детей с 2 лет;
- острый синусит или обострение хронического синусита у взрослых (в т.ч. пожилого возраста) и подростков с 12 лет — в качестве вспомогательного терапевтического средства при лечении антибиотиками;
- острый риносинусит с легкими и умеренно выраженными симптомами без признаков тяжелой бактериальной инфекции у пациентов с 12 лет;
- профилактическое лечение сезонного аллергического ринита среднетяжелого и тяжелого течения у взрослых и подростков с 12 лет (рекомендуется за 2–4 нед до предполагаемого начала сезона пыления);
- полипоз носа, сопровождаемый нарушением носового дыхания и обоняния, у взрослых (от 18 лет).
Противопоказания
- гиперчувствительность к какому-либо из веществ, входящих в состав препарата;
- недавнее оперативное вмешательство или травма носа с повреждением слизистой оболочки носовой полости — до заживления раны (в связи с ингибирующим действием ГКС на процессы заживления);
- детский возраст (при сезонном и круглогодичном аллергических ринитах — до 2 лет, при остром синусите или обострении хронического синусита — до 12 лет, при полипозе — до 18 лет) — в связи с отсутствием соответствующих данных.
С осторожностью: туберкулезная инфекция (активная или латентная) респираторного тракта; нелеченая грибковая, бактериальная, системная вирусная инфекция или инфекция, вызванная Herpes simplex с поражением глаз (в виде исключения возможно назначение препарата при перечисленных инфекциях по указанию врача); наличие нелеченой местной инфекции с вовлечением в процесс слизистой оболочки носовой полости.
Применение при беременности и кормлении грудью
Соответствующим образом спланированных и хорошо контролируемых исследований препарата у беременных не проводилось.
Как и при применении других интраназальных ГКС, препарат Назонекс® следует назначать беременным или кормящим грудью только в случае, если ожидаемая польза от назначения препарата оправдывает потенциальный риск для плода или младенца.
Младенцы, матери которых во время беременности получали ГКС, должны тщательно наблюдаться на предмет возможности развития гипофункции надпочечников.
Способ применения и дозы
Реклама: ООО «РЛС-Библиомед», ИНН 7714758963, erid=4CQwVszH9pUmKjt23pm
Интраназально. Впрыскивание суспензии, содержащейся во флаконе, осуществляется при помощи специальной дозирующей насадки на флаконе.
Перед первым применением назального спрея Назонекс® необходимо провести его калибровку. Не следует прокалывать назальный аппликатор.
Для проведения калибровки необходимо нажать на дозирующую насадку 10 раз или до появления однородного спрея. Аппликатор готов к применению. Наклонить голову и впрыснуть ЛС в каждый носовой ход так, как рекомендовал лечащий врач.
Если лекарственный препарат не использовался в течение 14 дней или большего промежутка времени, необходимо нажать на дозирующую насадку 2 раза или до появления однородного спрея. Наклонить голову и впрыснуть ЛС в каждый носовой ход так, как рекомендовал лечащий врач.
Чистка дозирующей насадки. Важно регулярно чистить дозирующую насадку, чтобы избежать ее неправильной работы. Снять колпачок, защищающий насадку от пыли, затем аккуратно снять наконечник для распыления. Тщательно промыть наконечник для распыления и колпачок для защиты от пыли в теплой воде и ополоснуть под краном.
Не пытаться открыть назальный аппликатор с помощью иголки или другого острого предмета, т.к. это приведет к повреждению аппликатора, в результате чего пациент может принять неправильную дозу препарата.
Высушить колпачок и наконечник в теплом месте. После этого прикрепить наконечник для распыления на флакон и снова прикрутить к флакону колпачок для защиты от пыли. При первом применении назального спрея после очистки необходимо провести повторную калибровку путем нажатия на дозирующую насадку 2 раза.
Перед каждым применением необходимо интенсивно встряхивать флакон.
Лечение сезонного или круглогодичного аллергического ринита
Взрослые (в т.ч. пожилого возраста) и подростки с 12 лет. Рекомендуемая профилактическая и терапевтическая доза препарата составляет 2 впрыскивания (по 50 мкг мометазона фуроата каждое) в каждый носовой ход 1 раз в день (суммарная суточная доза — 200 мкг). По достижении лечебного эффекта для поддерживающей терапии возможно уменьшение дозы до 1 впрыскивания в каждый носовой ход 1 раз в день (суммарная суточная доза — 100 мкг).
В случае если уменьшения симптомов заболевания не удается достичь применением препарата в рекомендуемой терапевтической дозе, суточная доза может быть увеличена до 4 впрыскиваний в каждый носовой ход 1 раз в день (суммарная суточная доза — 400 мкг). После уменьшения симптомов заболевания рекомендуется снижение дозы. Начало действия препарата обычно отмечается клинически уже через 12 ч после первого применения препарата.
Дети 2–11 лет. Рекомендуемая терапевтическая доза при лечении сезонного или круглогодичного аллергического ринита — 1 впрыскивание (50 мкг мометазона фуроата) в каждый носовой ход 1 раз в день (суммарная суточная доза — 100 мкг).
Для применения препарата у детей младшего возраста требуется помощь взрослых.
Вспомогательное лечение острого синусита или обострения хронического синусита
Взрослые (в т.ч. пожилого возраста) и подростки с 12 лет. Рекомендуемая терапевтическая доза составляет 2 впрыскивания (по 50 мкг мометазона фуроата каждое) в каждый носовой ход 2 раза в день (суммарная суточная доза — 400 мкг).
В случае если уменьшения симптомов заболевания не удается достичь применением препарата в рекомендуемой терапевтической дозе, суточная доза может быть увеличена до 4 впрыскиваний в каждый носовой ход 2 раза в день (суммарная суточная доза — 800 мкг). После уменьшения симптомов заболевания рекомендуется снижение дозы.
Лечение острого риносинусита без признаков тяжелой бактериальной инфекции
Рекомендуемая доза для взрослых и подростков составляет 2 впрыскивания (по 50 мкг мометазона фуроата каждое) в каждый носовой ход 2 раза в сутки (суммарная суточная доза — 400 мкг). При ухудшении симптомов в ходе лечения необходима консультация специалиста.
Лечение полипоза носа
Взрослые (в т.ч. пожилого возраста) от 18 лет. Рекомендуемая терапевтическая доза составляет 2 впрыскивания (по 50 мкг мометазона фуроата каждое) в каждый носовой ход 2 раза в день (суммарная суточная доза — 400 мкг). После уменьшения симптомов заболевания рекомендуется снижение дозы до 2 впрыскиваний (по 50 мкг мометазона фуроата каждое) в каждый носовой ход 1 раз в день (суммарная суточная доза — 200 мкг).
Побочные действия
Применение лекарственного препарата в клинических исследованиях
Нежелательные явления, связанные с применением препарата (≥1%), выявленные в ходе клинических иследований у пациентов с аллергическим ринитом или полипозом носа и в период пострегистрационного применения препарата независимо от показания к применению, представлены в таблице. Нежелательные реакции перечислены в соответствии с классификацией системно-органных классов MedDRA. В пределах каждого системно-органного класса нежелательные реакции классифицированы по частоте возникновения.
Носовые кровотечения, как правило, были умеренными и прекращались самостоятельно, частота их возникновения была несколько большей, чем при использовании плацебо (5%), но равной или меньшей, чем при назначении других интраназальных ГКС, которые использовались в качестве активного контроля (у некоторых из них частота возникновения носовых кровотечений составляла до 15%).
Частота возникновения всех других нежелательных явлений была сопоставимой с частотой их возникновения при назначении плацебо. Общая частота возникновения нежелательных явлений у пациентов, получавших лечение в отношении назального полипоза, была сопоставима с частотой возникновения у пациентов с аллергическим ринитом.
Общая частота возникновения нежелательных явлений у пациентов, получавших лечение в отношении острого риносинусита была сопоставима с частотой возникновения у пациентов с аллергическим ринитом и при назначении плацебо. При применении интраназальных ГКС возможно развитие системных побочных эффектов, особенно при длительном применении интраназальных ГКС в высоких дозах (см. «Особые указания»).
Частота нежелательных реакций установлена следующим образом: очень часто (≥1/10); часто (≥1/100, <1/10); редко (≥1/1000, <1/100). Для нежелательных реакций в период пострегистрационного наблюдения частота не установлена (не может быть определена на основании имеющихся данных).
| Системно-органный класс | Очень часто | Часто | Частота не установлена |
| Инфекционные и паразитарные заболевания | Фарингит, инфекции верхних дыхательных путей* | ||
| Со стороны иммунной системы | Реакции повышенной чувствительности, включая анафилактические реакции, ангионевротический отек, бронхоспазм, одышку | ||
| Со стороны нервной системы | Головная боль | ||
| Со стороны органа зрения | Повышение ВГД, глаукома, катаракта | ||
| Со стороны дыхательной системы, органов грудной клетки и средостения | Носовые кровотечения** | Носовые кровотечения (т.е. явное кровотечение, а также выделение окрашенной кровью слизи или сгустков крови), ощущение жжения в носу, раздражение слизистой оболочки носа, изъязвление слизистой оболочки носа | Перфорация носовой перегородки |
| Со стороны ЖКТ | Раздражение глотки (ощущение раздражения слизистой оболочки глотки)** | Нарушения вкуса и обоняния |
*Выявлено с частотой «редко» при применении препарата 2 раза в день при полипозе носа.
**Выявлено при применении препарата 2 раза в день при полипозе носа.
Дети
Со стороны дыхательной системы, органов грудной клетки и средостения: носовые кровотечения (6%), раздражение слизистой оболочки носа (2%), чихание (2%).
Со стороны нервной системы: головная боль (3%).
Частота возникновения указанных нежелательных явлений у детей была сопоставима с частотой их возникновения при применении плацебо.
Пострегистрационное применение лекарственного препарата
Во время пострегистрационного применения лекарственного препарата Назонекс® дополнительно были выявлены нежелательные реакции: нечеткое зрение.
Взаимодействие
Комбинированная терапия с лоратадином хорошо переносилась пациентами. При этом не было отмечено какого-либо влияния препарата на концентрацию лоратадина или его основного метаболита в плазме крови. В этих исследованиях мометазона фуроат в плазме крови обнаружен не был (при чувствительности метода определения 50 пг/мл).
Мометазона фуроат метаболизируется CYP3A4. Совместное применение с сильными ингибиторами CYP3A4 (например, кетоконазолом, итраконазолом, кларитромицином, ритонавиром, лекарственными препаратами, содержащими кобицистат) может приводить к увеличению концентрации ГКС в плазме крови и, возможно, к увеличению риска возникновения системных побочных эффектов ГКС-терапии. Следует оценить преимущества совместного назначения мометазона фуроата с сильными ингибиторами CYP3A4 и потенциальный риск развития системных побочных эффектов ГКС. В случае совместного применения препаратов требуется мониторинг состояния пациентов на предмет развития системных побочных эффектов ГКС-терапии.
Передозировка
Симптомы: при длительном применении ГКС в высоких дозах, а также при одновременном использовании нескольких ГКС возможно угнетение функции ГГНС.
Лечение: вследствие малой (<1%, при чувствительности метода определения 0,25 пг/мл) системной биодоступности маловероятно, что при случайной или намеренной передозировке потребуется принятие каких-либо мер, помимо наблюдения с возможным последующим возобновлением приема препарата в рекомендованной дозе.
Особые указания
Как и при любом долгосрочном лечении, пациенты, применяющие назальный спрей Назонекс® в течение нескольких месяцев и дольше, должны периодически проходить осмотр у врача на предмет возможных изменений слизистой оболочки носа. Необходимо проводить мониторинг за пациентами, получающими интраназальные ГКС длительное время.
Возможно развитие задержки роста у детей. В случае выявления задержки роста у детей необходимо снизить дозу интраназальных ГКС до наименьшей, позволяющей эффективно контролировать симптомы. Кроме того, следует направить пациента на консультацию к педиатру.
В случае развития местной грибковой инфекции носа или глотки может потребоваться прекращение терапии назальным спреем Назонекс® и проведение специального лечения. Сохраняющееся в течение длительного времени раздражение слизистой оболочки носа и глотки также может служить основанием для прекращения лечения назальным спреем Назонекс®.
При проведении плацебо-контролируемых клинических исследований у детей, когда назальный спрей Назонекс® применялся в суточной дозе 100 мкг в течение года, задержки роста у детей не отмечалось.
При продолжительном лечении назальным спреем Назонекс® признаков подавления функции ГГНС не наблюдалось. Пациенты, которые переходят к лечению назальным спреем Назонекс® после длительной терапии ГКС системного действия, требуют к себе особого внимания. Отмена ГКС системного действия у таких пациентов может привести к недостаточности функции надпочечников, последующее восстановление которой может занять до нескольких месяцев. В случае появления признаков надпочечниковой недостаточности следует возобновить прием системных ГКС и принять другие необходимые меры.
При применении интраназальных ГКС возможно развитие системных побочных эффектов, особенно при длительном применении в высоких дозах. Вероятность развития этих эффектов значительно меньше, чем при применении пероральных ГКС. Системные побочные эффекты могут различаться как у отдельных пациентов, так и в зависимости от применяемого ГКС-препарата. Потенциальные системные эффекты включают в себя синдром Кушинга, характерные признаки кушингоида, подавление функции надпочечников, задержку роста у детей и подростков, катаракту, глаукому и реже ряд психологических или поведенческих эффектов, включая психомоторную гиперактивность, нарушение сна, тревогу, депрессию или агрессию (особенно у детей).
Во время перехода от лечения ГКС системного действия к лечению назальным спреем Назонекс® у некоторых пациентов могут возникнуть начальные симптомы отмены системных ГКС (например, боли в суставах и/или мышцах, чувство усталости и депрессия), несмотря на уменьшение выраженности симптомов, связанных с поражением слизистой оболочки носа. Таких пациентов необходимо специально убеждать в целесообразности продолжения лечения назальным спреем Назонекс®. Переход от системных к местным ГКС может также выявить уже существовавшие, но маскировавшиеся терапией ГКС системного действия аллергические заболевания, такие как аллергический конъюнктивит и экзема.
Пациенты, которым проводится лечение ГКС, обладают потенциально сниженной иммунной реактивностью и должны быть предупреждены о повышенном для них риске заражения в случае контакта с больными некоторыми инфекционными заболеваниями (например, ветряной оспой, корью), а также о необходимости врачебной консультации, если такой контакт произошел. При появлении признаков выраженной бактериальной инфекции (например, лихорадки, упорной и резкой боли с одной стороны лица или зубной боли, припухлости в орбитальной или периорбитальной области) требуется немедленная врачебная консультация.
При применении назального спрея Назонекс® в течение 12 мес не возникало признаков атрофии слизистой оболочки носа. Кроме того, мометазона фуроат проявлял тенденцию способствовать нормализации гистологической картины при исследовании биоптатов слизистой носа.
При системном и местном (включая интраназальное, ингаляционное и внутриглазное) применении ГКС могут возникнуть нарушения зрения. Если у пациента присутствуют такие симптомы, как нечеткое зрение или другие нарушения зрения, необходимо рекомендовать пациенту обратиться к офтальмологу для выявления возможных причин нарушений зрения, включающих катаракту, глаукому или редкие заболевания, например, центральную серозную хориоретинопатию, которые наблюдались в ряде случаев при системном и местном применении ГКС.
Эффективность и безопасность мометазона не изучена при лечении односторонних полипов, полипов, связанных с муковисцидозом, и полипов, которые полностью закрывают носовую полость. В случае выявления односторонних полипов необычной или неправильной формы, особенно изъязвленных или кровоточащих, необходимо провести дополнительное медицинское обследование.
Влияние на способность управлять транспортными средствами и работать с механизмами. Нет данных о влиянии лекарственного препарата Назонекс® на способность управлять транспортными средствами или движущимися механизмами.
Форма выпуска
Спрей назальный дозированный, 50 мкг/доза. По 10 г (60 доз) или 18 г (120 доз) суспензии в ПЭ-флаконах белого цвета, снабженных дозирующим устройством и закрывающихся колпачком. По 1 фл. (10 г) или 1, 2, 3 фл. (18 г) в картонной пачке.
Производитель
1. Юридическое лицо, на имя которого выдано регистрационное удостоверение: Шеринг-Плау Лабо Н.В., Бельгия.
Произведено/выпускающий контроль качества: Шеринг-Плау Лабо Н.В., Бельгия/Schering-Plough Labo N.V., Industriepark 30, В-2220, Heist-op-den-Berg, Belgium.
2. Произведено: Шеринг-Плау Лабо Н.В., Бельгия Schering-Plough Labo N.V., Industriepark 30, В-2220, Heist-op-den-Berg, Belgium.
Упаковано/Выпускающий контроль качества: АО «Химико-фармацевтический комбинат «АКРИХИН»» (АО «АКРИХИН»). 142450, Московская обл., Ногинский р-н, г. Старая Купавна, ул. Кирова, 29.
Тел./факс: (495) 702-95-03.
Юридическое лицо, на имя которого выдано регистрационное удостоверение: Шеринг-Плау Лабо Н.В., Бельгия.
Претензии потребителей направлять по адресу: ООО «МСД Фармасьютикалс». 119021, Россия, Москва, ул. Тимура Фрунзе, 11, стр. 1.
Тел.: (495) 916-71-00; факс: (495) 916-70-94.
Комментарий
Перед назначением любого препарата, упомянутого в данном материале, пожалуйста, ознакомьтесь с полной инструкцией по применению, предоставляемой компанией-производителем.
Компания МSD не рекомендует применять препараты компании способами, отличными от описанных в инструкции по применению.
Условия отпуска из аптек
По рецепту.
RU-XFY-00219; 04-2021
Условия хранения
При температуре 2–25 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Белого или практически белого цвета непрозрачная суспензия.
1 доза спрея содержит мометазона фуроата моногидрат в количестве, эквивалентном 50 мкг мометазона фуроата (безводного);
вспомогательные вещества: целлюлоза дисперсная, глицерин, натрия цитрата дигидрат, кислота лимонная, полисорбат-80, бензалкония хлорид, вода очищенная.
Средства для устранения воспалительного отека (деконгестанты) и другие средства для местного применения в ринологии. Кортикостероиды.
Код АТС − R01A D09.
Фармакодинамика
Механизм действия
Мометазона фуроат − глюкокортикостероид для местного применения, обладающий локальным противовоспалительным действием, проявляющемся в дозах, при которых не возникает системных эффектов.
Вполне вероятно, что в основном механизм противоаллергического и противовоспалительного действия мометазона фуроата связан с его способностью угнетать выделение медиаторов аллергических реакций. Мометазона фуроат значительно уменьшает высвобождение лейкотриенов из лейкоцитов пациентов, страдающих аллергическими заболеваниями. Мометазона фуроат продемонстрировал на культуре клеток высокую активность в отношении угнетения синтеза/высвобождения IL-1, IL-5, IL-6 и TNFα. Он также является мощным ингибитором выработки лейкотриенов. К тому же, он также является мощным ингибитором продукции Тh2 цитокинов, IL-4 и IL-5 из человеческих CD4+ Т-клеток.
Фармакодинамика
В исследованиях с провокационными тестами с нанесением антигенов на слизистую оболочку носа была выявлена противовоспалительная активность назального спрея НАЗОНЕКС как в ранней, так и в поздней стадии аллергической реакции. Это было подтверждено снижением (по сравнению с плацебо) уровня гистамина и активности эозинофилов, а также уменьшением (по сравнению с исходным уровнем) количества эозинофилов, нейтрофилов и белков адгезии эпителиальных клеток.
У 28% пациентов с сезонным аллергическим ринитом назальный спрей НАЗОНЕКС продемонстрировал клинически значимое начало действия на протяжении 12 часов после применения первой дозы. В среднем (у 50%) облегчение наступало в течение 35,9 ч.
Дети
В плацебо-контролированном клиническом исследовании, в котором дети (n=49/группа) получали 100 мкг в сутки назального спрея НАЗОНЕКС на протяжении одного года, задержка скорости роста не наблюдалась.
Имеются ограниченные данные о безопасности и эффективности спрея назального НАЗОНЕКС у детей в возрасте от 3 до 5 лет, и соответствующий диапазон доз не может быть установлен. В исследовании с участием 48 детей в возрасте от 3 до 5 лет, получавших лечение мометазона фуроатом интраназально по 50, 100 или 200 мкг/сутки на протяжении 14 дней, не было значимых различий при сравнении с плацебо по среднему изменению уровня кортизола в плазме в ответ на стимуляционную пробу с тетракозактрином.
Фармакокинетика
Биодоступность мометазона фуроата при применении в форме водного назального спрея составляет < 1%, в плазме крови, при использовании метода количественного определения с порогом чувствительности 0,25 пг/мл.
Распределение
Не рассматривается, поскольку мометазон при интраназальном введении очень слабо всасывается.
Метаболизм
Небольшое количество препарата, которое может быть проглоченным и абсорбированным, подвергается активному первичному метаболизму в печени.
Выведение
Абсорбированное количество мометазона фуроата активно метаболизируется, и метаболиты выводятся с мочой и желчью.
• Лечение сезонного или круглогодичного аллергического ринита у взрослых и детей в возрасте от 2 лет.
• Профилактическое лечение аллергического ринита среднего и тяжелого течения у взрослых и детей с 12 лет (рекомендуется начинать за 2-4 недели до предполагаемого начала сезона пыления).
• Лечение симптомов острого риносинусита без признаков тяжелой бактериальной инфекции у взрослых и детей в возрасте от 12 лет.
• Лечение назальных полипов и связанных с ними симптомов, включая заложенность носа и потерю обоняния, у пациентов в возрасте от 18 лет.
Лечение сезонного или круглогодичного аллергического ринита: взрослым (в том числе пожилым) и подросткам в возрасте от 12 лет рекомендованная профилактическая и терапевтическая доза препарата составляет 2 впрыскивания (по 50 мкг каждое) в каждую ноздрю 1 раз в сутки (общая суточная доза − 200 мкг). После достижения лечебного эффекта для поддерживающей терапии целесообразно уменьшение дозы до 1 впрыскивания в каждую ноздрю 1 раз в сутки (общая суточная доза − 100 мкг).
Если ослабления симптомов заболевания не удается достичь применением препарата в рекомендованной терапевтической дозе, суточная доза может быть увеличена до максимальной: по 4 впрыскивания в каждую ноздрю 1 раз в сутки (общая суточная доза − 400 мкг). После ослабления симптомов заболевания рекомендуется снижение дозы.
У части пациентов с сезонным аллергическим ринитом данный препарат продемонстрировал клинически значимое начало действия на протяжении 12 часов после применения первой дозы. Однако, полную пользу от лечения нельзя получить в первые 48 часов, поэтому пациенту необходимо продолжать регулярное применение для достижения полного терапевтического эффекта.
Лечение назальным спреем НАЗОНЕКС может быть начато за несколько дней до начала сезона пыления у пациентов, имеющих в анамнезе умеренный или тяжелый сезонный аллергический ринит.
Для детей в возрасте 2-11 лет рекомендованная терапевтическая доза составляет 1 впрыскивание (по 50 мкг каждое) в каждую ноздрю 1 раз в сутки (общая суточная доза − 100 мкг).
Острый риносинусит. Взрослым (в том числе пожилым) и детям в возрасте от 12 лет и старше рекомендованная терапевтическая доза составляет 2 впрыскивания (по 50 мкг) в каждую ноздрю 2 раза в сутки (общая суточная доза − 400 мкг).
Назальные полипы. Для пациентов в возрасте от 18 лет (в том числе пожилых) рекомендованная доза составляет 2 впрыскивания (по 50 мкг каждое) в каждую ноздрю 1 раз в сутки (общая суточная доза − 200 мкг). Если после 5-6 недель лечения улучшение симптомов заболевания не наблюдается, доза
может быть повышена до двух впрыскиваний в каждый носовой ход 2 раза в сутки (общая суточная доза − 400 мкг). Дозу следует постепенно снижать до более низкой, при которой обеспечивается эффективный контроль над симптомами заболевания. Если после 5-6 недель лечения улучшение симптомов заболевания не наблюдается, следует пересмотреть состояние пациента и рассмотреть альтернативные методы лечения.
Подготовка назального спрея для использования
Назальный спрей НАЗОНЕКС имеет пылезащитный колпачок, который защищает распылитель и содержит его в чистоте. Не забудьте снять его, прежде чем использовать спрей, и одеть после использования.
Перед первым применением необходимо предварительно осуществить «калибровку» спрея путем 10 нажатий дозирующего устройства, пока не начнется распыление спрея:
1. Осторожно встряхните флакон.
2. Положите указательный и средний палец по обе стороны от распылителя и большой палец под флакон. Не прокалывайте назальный аппликатор.
3. Направьте распылитель от вас, а затем нажмите пальцами вниз 10 раз, пока не начнется распыление спрея.
Если назальный спрей не использовался в течение 14 дней или более, необходима повторная «калибровка», которая осуществляется путем 2 нажатий дозирующего устройства до появления распыления спрея.
Как использовать назальный спрей
1. Осторожно встряхните флакон и снимите пылезащитный колпачок (Рисунок 1).
2. Осторожно прочистите нос.
3. Закройте одну ноздрю и поместите распылитель в другую ноздрю, как показано на рисунке (Рисунок 2). Наклоните голову немного вперед, держа флакон в вертикальном положении.
4. Начните вдыхать осторожно или медленно через нос и в то же время впрысните спрей в ноздрю путем одного нажатия на дозирующее устройство.
5. Выдохните через рот. Повторите шаг 4, чтобы впрыснуть спрей второй раз в ту же ноздрю, если применимо.
6. Вытащите распылитель из этой ноздри и выдохните через рот.
7. Повторите шаги 3-6 для второй ноздри (Рисунок 3).
Тщательно протрите распылитель чистым носовым платком или салфеткой после использования спрея, оденьте пылезащитный колпачок.
Очистка назального спрея
• Важно регулярно очищать распылитель назального спрея, иначе он не будет правильно работать.
• Снимите пылезащитный колпачок и осторожно снимите распылитель.
• Помойте распылитель и пылезащитный колпачок теплой водой и потом ополосните под проточной водой.
• Не пытайтесь очистить дозирующее устройство с помощью иглы или другого острого предмета, так как это может повредить устройство и привести к неправильной дозировке лекарственного вещества.
• Просушите распылитель и пылезащитный колпачок в теплом месте.
• Поместите распылитель на флакон со спреем и оденьте пылезащитный колпачок.
• Проведите повторную «калибровку» путем 2 нажатий дозирующего устройства до начала использования после очистки.
Если Вы использовали НАЗОНЕКС больше, чем положено
Расскажите своему врачу, если вы случайно использовали больше, чем вам было сказано. Применение стероидов в течение длительного времени или в больших количествах иногда может влиять на некоторые из ваших гормонов. У детей это может влиять на рост и развитие.
Если вы забыли использовать НАЗОНЕКС
Если вы забыли использовать назальный спрей в нужное время, воспользуйтесь им, как только вспомните, а затем продолжайте, как и раньше. Не принимайте двойную дозу, чтобы компенсировать забытую дозу.
Носовые кровотечения, как правило, прекращались самостоятельно, были умеренными, возникали несколько чаще, чем при применении плацебо (5 %), но реже, чем при применении других интраназальных кортикостероидов, которые применялись как активный контроль в клинических исследованиях по аллергическому риниту (у некоторых из них частота возникновения носовых кровотечений составляла до 15 %). Частота возникновения всех других побочных реакций была сопоставима с таковой при применении плацебо. У пациентов, получавших лечение в связи с назальными полипами, общая частота побочных реакций была сходной с таковой, наблюдавшейся у пациентов с аллергическим ринитом.
Системные эффекты могут возникнуть при применении назальных кортикостероидов, особенно при назначении высоких доз и при длительном использовании.
Перечень побочных реакций
В Таблице 1 представлены связанные с проводимым лечением побочные реакции (≥ 1 %), о которых сообщалось в клинических исследованиях у пациентов с аллергическим ринитом или назальными полипами и в постмаркетинговых отчетах, независимо от показания. Побочные реакции представлены в соответствии основному классу системы органов MedDRA. В пределах каждого класса системы органов побочные реакции распределены по категориям в зависимости от частоты. Категории по частоте были следующими: очень часто (≥ 1/10); часто (≥ 1/100 и < 1/10); нечасто (≥ 1/1000 и < 1/100). Частота постмаркетинговых побочных реакций определена как “неизвестно (невозможно установить по имеющимся данным)”.
| Таблица 1: Известные побочные реакции, связанные с проводимым лечением, с распределением по классу системы органов и частоте | |||
| Очень часто | Часто | Неизвестно | |
| Инфекции и инвазии |
Фарингит Инфекции верхних дыхательных путей† |
||
| Нарушения со стороны иммунной системы | Повышенная чувствительность, включая анафилактические реакции, ангионевротический отек, бронхоспазм и диспноэ | ||
| Нарушения со стороны нервной системы | Головная боль | ||
| Нарушения со стороны органов зрения |
Глаукома Повышенное внутриглазное давление Катаракта Нечеткость зрения |
||
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Носовое кровотечение* |
Носовое кровотечение Ощущение жжения в носу Раздражение слизистой оболочки носа Язвенные изменения в носу |
Перфорация носовой перегородки |
| Нарушения со стороны пищеварительной системы | Першение в горле† | Нарушения вкуса и обоняния |
* Отмечено при дозировке два раза в сутки в связи с назальными полипами.
† Отмечено с неизвестной частотой при дозировке два раза в сутки в связи с назальными полипами.
Дети
У детей частота отмеченных побочных реакций в клинических исследованиях, т.е., носовое кровотечение (6%), головная боль (3%), раздражение слизистой оболочки носа (2%) и чихание (2%), была сопоставима с плацебо.
Повышенная чувствительность к активному веществу, мометазону фуроату, или какому-либо вспомогательному веществу.
Назальный спрей НАЗОНЕКС не следует применять при наличии нелеченной локализованной инфекции с вовлечением слизистой оболочки носовой полости, как, например, простой герпес.
В связи с тем, что кортикостероиды замедляют заживление ран, кортикостероиды для интраназального применения не следует назначать пациентам, которые недавно перенесли оперативное вмешательство или травму носа до полного заживления ран.
Ингаляция или пероральное введение избыточных доз кортикостероидов может привести к угнетению функции гипоталамо-гипофизарно-надпочечниковой системы.
Лечение
Вследствие того, что системная биодоступность назального спрея НАЗОНЕКС составляет < 1% , маловероятно, что при передозировке будут необходимы другие меры, помимо наблюдения за состоянием пациента, с последующим возобновлением применения препарата в соответствующей предписанной дозировке.
Назальный спрей НАЗОНЕКС следует применять с осторожностью или не применять совсем у больных с активной или латентной туберкулезной инфекцией респираторного тракта, а также при нелеченой грибковой, бактериальной или системной вирусной инфекции.
Пациенты, применяющие кортикостероиды, потенциально могут иметь сниженную иммунную реактивность и должны быть предупреждены о повышенном риске заражения в случае контакта с больными некоторыми инфекционными заболеваниями (например, ветряная оспа, корь), а также о необходимости консультации врача, если такой контакт произошел.
Локальные назальные эффекты
В исследовании с участием пациентов с круглогодичным ринитом после 12-месячного лечения назальным спреем НАЗОНЕКС не возникало признаков атрофии слизистой оболочки носа; кроме того, мометазона фуроат способствовал нормализации гистологической картины слизистой оболочки носа. Тем не менее, пациенты, применяющие назальный спрей НАЗОНЕКС в течение нескольких месяцев и дольше, должны периодически проходить осмотр на предмет обнаружения возможных изменений слизистой оболочки носа. В случае развития локальной грибковой инфекции носа или глотки может понадобиться прекращение терапии назальным спреем НАЗОНЕКС или проведение специального лечения. Раздражение слизистой оболочки носа и глотки, сохраняющееся в течение длительного времени, также может быть показанием к прекращению лечения назальным спреем НАЗОНЕКС.
Применение препарата НАЗОНЕКС не рекомендуется в случае перфорации носовой перегородки.
В клинических исследованиях носовые кровотечения наблюдались с большей частотой, чем при применении плацебо. Носовые кровотечения прекращались самостоятельно и были умеренными. Назальный спрей НАЗОНЕКС содержит бензалкония хлорид, который может вызывать раздражение слизистой оболочки носа.
Системные эффекты кортикостероидов
Системные эффекты могут возникнуть при применении назальных кортикостероидов, особенно при назначении в высоких дозах и при длительном применении. Эти эффекты менее вероятны, чем при применении оральных кортикостероидов, и могут отличаться у различных пациентов, а также при использовании различных кортикостероидных средств. Потенциальные системные эффекты могут включать в себя синдром Кушинга, симптомы кушингоида, подавление функции надпочечников, задержку роста у детей и подростков, катаракту, глаукому и, реже, психиатрические или поведенческие расстройства, включая психомоторное возбуждение, гиперактивность, нарушения сна, тревогу, депрессию или агрессию (особенно у детей).
После применения интраназальных кортикостероидов сообщалось о случаях повышенного внутриглазного давления.
При применении кортикостероидов системного и местного действия (включая интраназальное, ингаляционное и внутриглазное введение) могут возникать нарушения зрения. Если возникают такие симптомы, как нечеткость зрения или другие нарушения со стороны зрения, пациенту следует пройти обследование у офтальмолога для оценки возможных причин нарушения зрения, которые могут включать катаракту, глаукому или такие редкие заболевания, как центральная серозная хориоретинопатия, о чем сообщалось после применения кортикостероидов системного и местного действия.
За пациентами, переходящими на лечение назальным спреем НАЗОНЕКС после длительной терапии кортикостероидами системного действия, необходимо внимательно наблюдать. Прекращение приема кортикостероидов системного действия у таких больных может привести к недостаточности функции коры надпочечниковых желез, в течение нескольких месяцев до восстановления функции гипоталамо-гипофизарно-надпочечниковой системы. Если эти пациенты проявляют признаки и симптомы надпочечниковой недостаточности или симптомы отмены (например, боли в суставах и/или мышцах, чувство усталости и депрессии на начальном этапе), несмотря на облегчение назальных симптомов, системное введение кортикостероидов должно быть возобновлено, другие виды терапии и соответствующие меры приняты. Такая смена терапии может также выявить ранее существовавшие аллергические заболевания, такие как аллергический конъюнктивит и экзема, которые развились ранее и маскировались терапией кортикостероидами системного действия. Лечение с применением доз, превышающих рекомендованные, может привести к клинически значимому угнетению функции надпочечников.
Если есть данные о том, что используются дозы, превышающие рекомендованные, тогда необходимо учитывать применение дополнительного системного кортикостероида в периоды стресса или планового хирургического вмешательства.
Назальные полипы
Безопасность и эффективность применения назального спрея НАЗОНЕКС в лечении односторонних полипов, полипов, ассоциированных с кистозным фиброзом, или полипов, полностью перекрывающих носовой ход, не изучались.
При односторонних полипах с необычной или неправильной формой, в особенности с изъязвлением или кровоточащих, требуется более углубленное обследование.
Влияние на рост у детей
Рекомендуется, чтобы у детей, получающих продолжительное лечение назальными кортикостероидами, тщательно контролировался рост. При замедлении роста проводимое лечение следует пересмотреть с целью снижения дозы назального кортикостероида, при наличии такой возможности, до максимально низкой дозы, обеспечивающей эффективный контроль симптомов заболевания. Кроме того, следует рассмотреть вопрос о направлении пациента к педиатру.
Неназальные симптомы
Несмотря на то, что при применении назального спрея НАЗОНЕКС у большинства пациентов будет обеспечиваться контроль над назальными симптомами, параллельное применение соответствующего дополнительного лечения может обеспечить дополнительное облегчение других симптомов, в частности симптомов со стороны глаз.
Дети. При проведении плацебо-контролированных клинических исследований у детей, применяющих НАЗОНЕКС в суточной дозе 100 мкг в течение года, задержки роста детей не отмечалось. Тем не менее, долгосрочные эффекты интраназального/ингаляционного стероидов окончательно не исследованы. Врач должен тщательно контролировать рост и развитие детей, получающих длительное лечение глюкокортикостероидами.
Не исследовались безопасность и эффективность НАЗОНЕКСа при лечении назальных полипов у детей и подростков младше 18 лет, симптомов риносинусита у детей в возрасте до 12 лет, сезонного или круглогодичного аллергического ринита у детей в возрасте до 2 лет.
Применение высоких доз или длительное лечение глюкокортикостероидами может привести к появлению системных побочных эффектов, включая замедление роста у детей. Долгосрочный эффект интраназального/ингаляционных стероидов у детей полностью не исследован. Врач должен тщательно контролировать рост и развитие детей, получающих длительное лечение глюкокортикостероидами. В исследовании 49 детей, которые получали 100 мг НАЗОНЕКСа ежедневно в течение 1 года, не наблюдалось снижение темпа роста.
Информация относительно применения мометазона фуроата беременными женщинами отсутствует или ограничена. В исследованиях на животных показано наличие репродуктивной токсичности. Как и другие кортикостероиды для интраназального применения, назальный спрей НАЗОНЕКС применяется у беременных только, если ожидаемая польза от его применения оправдывает потенциальный риск для матери, плода или младенца. Младенцев, матери которых в период беременности применяли кортикостероиды, необходимо тщательно обследовать на предмет возможной гипофункции надпочечников.
Лактация
Неизвестно, выделяется ли мометазона фуроат в грудное молоко человека. Как и в случае с другими кортикостероидами для интраназального применения, следует принять решение относительно прекращения грудного вскармливания или отмены/воздержания от терапии назальным спреем НАЗОНЕКС, принимая во внимание преимущества грудного вскармливания для ребенка и преимущества лечения для женщины.
Проводились клинические исследования взаимодействия с лоратадином. Взаимодействие не наблюдалось.
Мометазона фуроат метаболизируется посредством CYP3A4. Одновременное применение с мощными ингибиторами CYP3A4 (например, кетоконазол, итраконазол, кларитромицин, ритонавир, препараты, в состав которых входит кобицистат) может привести к повышению концентрации кортикостероидов в плазме крови и потенциально повышать риск возникновения системных побочных реакций кортикостероидов. Следует учитывать преимущества одновременного применения кортикостероидов и потенциальный риск развития системных реакций кортикостероидов, а также наблюдать за состоянием пациента относительно возникновения вышеуказанных побочных реакций.
Хранить при температуре не выше 25 °С, в недоступном для детей месте. Не замораживать.
Срок годности − 3 года. Не следует применять препарат после окончания срока годности.
По 18 г суспензии помещают в овальный непрозрачный белого цвета полиэтиленовый флакон, на горловине которого закрепляется отмеривающий дозу спрея насос-распылитель, закрывающийся защитным колпачком. Количество препарата, содержащегося во флаконе, обеспечивает распыление 140 доз по 50 мкг каждая. Флакон вместе с инструкцией по применению в картонной коробке.
По рецепту.
Производитель
Шеринг-Плау Лабо Н.В., Индустриепарк 30, Хейст-оп-ден-Берг, 2220, Бельгия.
Schering-Plough Labo NV, Industriepark 30, Heist-op-den-Berg, 2220, Belgium.
Владелец регистрационного удостоверения
Органон Сентрал Ист ГмбХ, Вейштрассе 20, 6006 Люцерн, Швейцария.
Organon Central East GmbH, Weystrasse 20, 6006 Luzern, Switzerland.
Description
Usage
Nazofix is a versatile nasal spray that can be used to treat a wide range of conditions. Here are some of the conditions that it can be used to treat:
Asthma: This spray can be used to treat asthma, a respiratory condition that affects the lungs and causes difficulty in breathing.
Atopic Dermatitis: This spray can also be used to treat atopic dermatitis, a skin condition that causes red, itchy, and inflamed skin.
Plaque Psoriasis: Nazofix can also be used to treat plaque psoriasis, a skin condition that causes thick, red, scaly patches on the skin.
Dermatitis: Nazofix can be used to treat dermatitis, a skin condition that causes red, itchy, and inflamed skin.
Nasal Polyps: This spray can also be used to treat nasal polyps, which are noncancerous growths that develop in the lining of the nose.
Rhinitis: Nazofix can be used to treat rhinitis, a condition that causes inflammation of the nasal cavity, leading to symptoms such as a runny nose, sneezing, and congestion.
Rhinosinusitis: This spray can also be used to treat rhinosinusitis, a condition that causes inflammation of the nasal cavity and sinuses.
Precautions
Before using this spray, it is important to take some precautions to ensure that the medication is safe for you to use. Here are some precautions to take:
Double-check the Information: It is important to be careful and double-check all the information on this page and to specify the information on the section Name of the medicinal product in the instructions to the drug Nazofix directly from the package or from the pharmacist at the pharmacy.
Consult with a Healthcare Professional: If you experience any side effects while using Mometasone Furoate, it is important to consult with a healthcare professional.
Side Effects
Like all medications, Nazofix can cause some side effects, although not everyone experiences them. Here are some of the common side effects of Nazofix:
Inflamed Hair Follicles: Nazofix can cause inflamed hair follicles, which can be uncomfortable.
Acne: This spray can also cause acne, a skin condition that causes pimples and other blemishes on the skin.
Thinning of the Skin: Nazofix can cause thinning of the skin, which can make the skin more prone to bruising and tearing.
Itching: This spray can cause itching, which can be uncomfortable.
Stinging, Tingling, or Burning Sensation: Nazofix can cause a stinging, tingling, or burning sensation in the nose.
Conclusion
Nazofix is a highly effective nasal spray that can provide relief from a wide range of conditions. It is important to take precautions and consult with a healthcare professional if you experience any side effects while using it. If you have any questions or concerns about using This spray, speak to your healthcare provider.
Use the form below to report an error
Please answer the questions as thoroughly and accurately as possible. Your answers will help us better understand what kind of mistakes happen, why and where they happen, and in the end the purpose is to build a better archive to guide researchers and professionals around the world.
The information on this page is not intended to be a substitute for professional medical advice, diagnosis, or treatment. always seek the advice for your physician or another qualified health provider with any questions you may have regarding a medical condition. Always remember to
- Ask your own doctor for medical advice.
- Names, brands, and dosage may differ between countries.
- When not feeling well, or experiencing side effects always contact your own doctor.
Cyberchondria
The truth is that when we’re sick, or worried about getting sick, the internet won’t help.
According to Wikipedia, cyberchondria is a mental disorder consisting in the desire to independently make a diagnosis based on the symptoms of diseases described on Internet sites.
Why you can’t look for symptoms on the Internet
If diagnoses could be made simply from a textbook or an article on a website, we would all be doctors and treat ourselves. Nothing can replace the experience and knowledge of specially trained people. As in any field, in medicine there are unscrupulous specialists, differences of opinion, inaccurate diagnoses and incorrect test results.