Introduction
Immune thrombocytopenia (ITP) is a common cause of severe thrombocytopenia in dogs (1), and glucocorticoids are the mainstay treatment for primary ITP (2). Vincristine and human intravenous immunoglobulin have been documented to shorten the duration of severe thrombocytopenia in dogs with primary ITP compared to glucocorticoids alone (3, 4). In dogs with ITP, reported short-term survival rates ranged from 74 to 84% 0.5 (5, 6). Until therapy is effective, spontaneous hemorrhage may develop, particularly in dogs with platelet concentrations of <30 × 109/L (5). The presence of melena and increased blood urea nitrogen concentration, both reflecting gastrointestinal blood loss, are associated with an increased risk of mortality for dogs with ITP (6).
There is robust evidence in human literature that antifibrinolytic agents, which prevent plasminogen-mediated degradation of fibrin, are effective at reducing blood loss and the need for blood transfusions during surgical procedures, nose bleeds, or menstruation (7). Antifibrinolytic agents have been used in people with ITP, although the available information is limited to case reports or small non-controlled studies (8).
A recent clinical trial in people undergoing treatment for hematologic malignancy (A-TREAT Trial) (9) indicated that the prophylactic use of tranexamic acid has no protective effect against bleeding. In clinical veterinary medicine, antifibrinolytic agents have shown to be effective in reducing post-operative bleeding in greyhounds (10), while the safety and efficacy of TXA have been assessed in additional recent studies (11, 12). However, to the authors’ knowledge, there are no studies in dogs with thrombocytopenia receiving anti-fibrinolytics. As occurs in people, a common occurrence in humans, any treatment that could reduce reliance on blood transfusion would have major implications such as reducing the duration and cost of hospitalization. This is especially important in dogs since platelet products have limited availability and can be cost-prohibitive.
The main aim of this feasibility study was to generate pilot data for future studies as well as for the safety of the administration of tranexamic acid in a group of dogs with ITP. We hypothesized that, for dogs with ITP, antifibrinolytics given in addition to conventional therapy would reduce the risk of spontaneous bleeding, thereby reducing the need for blood transfusions. A secondary hypothesis was that this would result in more rapid improvement in platelet numbers due to a reduction in ongoing platelet consumption, thus reducing hospitalization times.
Methods
Study population
Client-owned dogs diagnosed with primary ITP who presented to three participating referral hospitals between 2017 and 2019 were enrolled in the study. The study protocol was approved by the clinical research and ethics committee at the primary organizing clinic (26–2017). An Animal Test Certificate was obtained from the UK Veterinary Medicines Directorate for the use of tranexamic acid (Cyklokapron® Injectable).
Inclusion criteria
Dogs with a presumptive diagnosis of primary ITP were included in the study if their owners gave informed consent and if the platelet count was <40 × 109/L upon enrollment. A diagnosis of primary ITP was made after the exclusion of secondary ITP and other causes of thrombocytopenia. Diagnostic investigations included physical examination, CBC, serum biochemistry, thoracic and abdominal imaging, and serologic testing for Angiostrongylus vasorum, Anaplasma spp, and Ehrlichia spp plus any other infectious agents based on the discretion of the clinician and individual travel history of the patient. Dogs were excluded from the study if they had received corticosteroids or any other immunosuppressive agent for more than 48 h before study enrollment.
Study design
This is a cohort feasibility study. The assignment into treatment groups was randomized. The primary measures of the study were the time required to achieve a platelet count of >40 × 109/L, differences in clinical bleeding scores, the duration of hospitalization, and the amount of blood transfused and long-term survival (3 months).
Concomitant treatments
All dogs were treated with prednisolone (5 mg tablets, Dechra Ltd. 2–3 mg/kg) PO q 24 h or dexamethasone (Dexadreson® injectable 2 mg/ml, MSD Animal Health UK Ltd. 0.15–0.3 mg/kg) IV q 24 h. A single dose of vincristine (Oncovin ® injectable 1 mg/ml, Vincasar PFS. 0.02 mg/kg) IV was also administered. All dogs received omeprazole (Omeprazole sodium injectable 40 mg/ml. 1 mg/kg) IV q 12 h. These treatments were initiated as soon as the clinical diagnosis of ITP was made and within 24 h of the initial presentation. Independent of the treatment group, additional therapies including intravenous fluid therapy, blood products, analgesics, or prophylactic antibiotics were administered at the discretion of the attending clinician. Treatment with other immunosuppressive agents was not permitted during the first 7 days of the study.
Treatment group
Patients in the treatment group received tranexamic acid (20 mg/kg) IV q 8 h administered as slow infusion (over 15–20 min). Treatment with tranexamic acid was initiated as the clinical diagnosis of ITP was made and within 24 h of the initial presentation. If emesis occurred within 15 min of drug administration, the dose of tranexamic acid was reduced (15 mg/kg) IV q 8 h for subsequent administrations. If emesis occurred at this dose, the dose of tranexamic acid was further reduced (10 mg/kg) IV q 8 h for the subsequent administrations. If emesis occurred at this dose, treatment with tranexamic acid was discontinued.
Response monitoring
All dogs were monitored daily using a validated daily canine bleeding assessment tool in dogs with ITP (DOGiBAT) (13). Briefly, the bleeding severity of nine different anatomic sites (skin, catheter/venipuncture site, oral mucosa, ocular, nasal, gastrointestinal, urinary, pulmonary, and intracranial) was assessed. The evaluation was conducted by the attending clinician (small animal internal medicine specialists or residents). A numeric score was assigned based on the bleeding severity grade, and a total score out of 18 was given.
Daily measurement of PCV/total solids and platelet count was conducted. Platelet counts were performed either by automated or manual count by the attending clinician. Remission was defined as having a platelet count of ≥ 40 × 109/L. An automated platelet count was required for confirmation. Any other investigations were conducted at the discretion of the attending clinician. All dogs were monitored for potential adverse effects of the drugs administered, and any adverse events were recorded.
Statistical analyses
The cross-sectional data were compared by means of the Mann–Whitney U-test and Fisher’s exact test. The repeated measures of data (daily bleeding scores and platelet count) were analyzed by using the summary method approach (14). The time-to-event data (time to reach target platelet count, time to hospital discharge, and patient survival over 3 months) were analyzed by using the log-rank and the Kaplan–Meier curves. A p-value of < 0.05 was considered statistically significant.
Results
A total of 10 dogs were included, of which six were assigned to the control group and four to the tranexamic acid group (TXA). Six dogs were female neutered, two were male neutered, one was a female entire, and one was a male entire. There were two mixed-breed dogs and eight purebreds (three English springer spaniel, two English cocker spaniel, one rottweiler, one toy poodle, and one labrador). There were no significant differences in age, weight, or relevant initial clinical and laboratory findings (Table 1). A clinical assessment at the baseline showed petechiae and/or ecchymosis (n = 9), oral bleeding (n = 8), ocular bleeding (retinal or hyphema) (n = 6), hematuria (macroscopic and microscopic) (n = 6), bleeding from venipuncture site (n = 4), suspected pulmonary bleeding (n = 1), and suspected intracranial bleeding (n = 1).
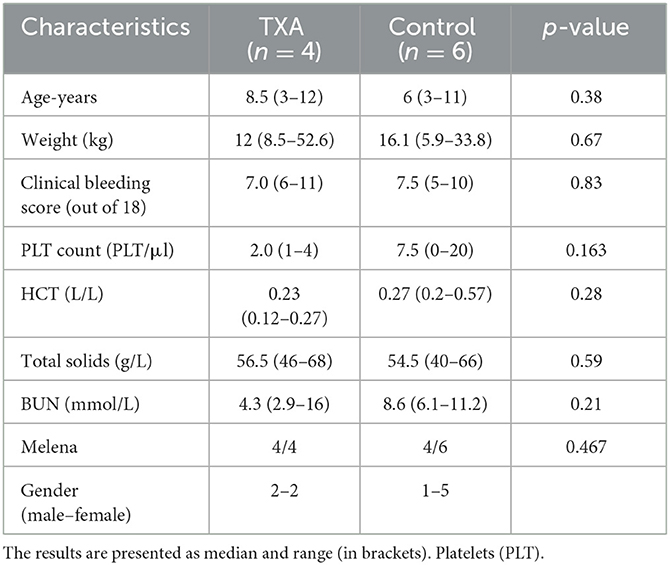
Table 1. Baseline characteristics in the 10 included dogs with immune thrombocytopenia in the tranexamic acid group (TXA) and the control groups.
Response to treatment
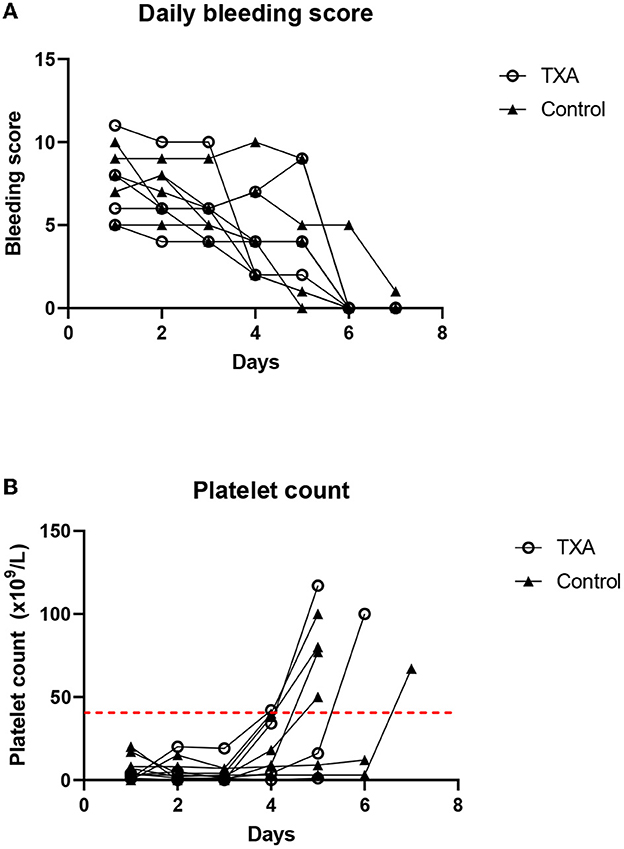
Subcutaneous bleeding and gastrointestinal tract hemorrhage were the major sources of blood loss in dogs that required blood products. The daily clinical bleeding score was not significantly different between groups (P = 0.43). The bleeding score of all survivors was found to decrease compared to that of the baseline and was ≤4 at the time of remission (Figure 1A). For the two cases that died during the study period, the clinical bleeding score was equal to or higher than that of the baseline. The daily platelet score was not significantly different between groups (P = 0.33) (Figure 1B).
Figure 1. (A) The daily bleeding score for individual dogs in the tranexamic acid (TXA) and the control group. (B) Daily platelet count for individual dogs in the TXA and the control groups. The dashed red line indicates the cutoff for remission (>40 × 109/L).
A total of six dogs received a transfusion of packed red blood cells (PRBCs), and one dog received both fresh whole blood and PRBCs. The median volume of blood products administered was 37.5 ml/kg for the TXA group and 9.72 ml/kg for the control group. The transfusion requirements were not significantly different between both groups (P = 0.084).
Outcome
In total, two dogs, one in each group, did not achieve remission and were euthanized due to an ongoing requirement for blood transfusions. The overall mean lag time from the start of treatment until platelet count increased to ≥ 40 × 109/L was 5.0 days in the TXA group and 6.0 days in the control group (P = 0.69) (Table 2). The mean time to hospital discharge was 7.0 days in the TXA group and 5.0 days in the control group (P = 0.81) (Figure 2A). One dog in the tranexamic acid group was euthanized 14 days after she was discharged from the hospital by the referring veterinarian with a suspected ITP relapse. The rest of the dogs (7/10) were alive at 3 months after diagnosis, and this was not different between the groups (P = 0.35) (Figure 2B).
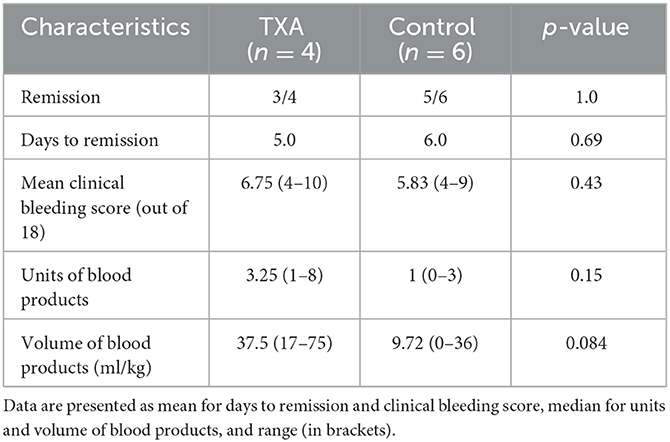
Table 2. Outcomes for dogs with immune thrombocytopenia in the tranexamic acid (TXA) and the control groups.
Figure 2. (A) Kaplan–Meier curve illustrating survival to hospital discharge in the tranexamic acid group (TXA) and control groups. (B) Kaplan– Meier curve illustrating survival 3 months after discharge in the TXA and control groups.
Adverse effects
A total of three out of four dogs in our study experienced vomiting during the IV infusion of tranexamic acid at a dose of 20 mg/kg. Following dose reductions, two out of these three dogs still vomited at a dose of 15 mg/kg IV, with one of the dogs vomiting even at the dose of 10 mg/kg necessitating discontinuation altogether. There were no identifiable immediate or delayed adverse drug reactions to the other administered drugs.
Discussion
In our study, the mean platelet recovery time was 5 and 6 days for the TXA group and the control group (p = 0.69), respectively. This is similar to the recovery time reported in studies evaluating the use of standard therapy with prednisolone and vincristine (3). Other variables such as the clinical bleeding score, the volume of blood products, and the status at 3 months were not found to be significantly different between both groups.
The volume of blood products received by the TXA group was larger than that of the control group (37.5 ml/kg for the TXA group and 9.72 ml/kg for the control group), but was not significantly different. The cause for this remains uncertain but, given the low number of cases included and the lack of statistical power, this may represent a type II error, and further studies are required to elucidate this.
Of all the outcomes studied here, we believe that the most relevant ones are the daily changes in clinical bleeding score and the volume of blood products used. While the utility of tranexamic acid in dogs with ITP cannot be concluded on this analysis, a large clinically relevant benefit seems unlikely. A consideration for future studies would be to select a population of dogs with ITP with more severe disease. This could include dogs with a high clinical bleeding score or with active bleeding. Certainly, the latter was the definition used in a study of 12 people with ITP (8), in which the administration of tranexamic acid was associated with a cessation of bleeding.
Overall, the survival rate of our study is in line with a previous cohort study in which 84% of dogs with ITP survived to discharge (6). In total, two dogs, one in each group, did not complete the study and were euthanized due to the ongoing requirement of blood transfusions. In these two euthanized dogs, the bleeding score severity remained increased in comparision to those who survived during hospitalization, compatible with higher disease severity.
Although vomiting was self-limiting, the incidence of vomiting especially in a compromised patient may lead to complications. The use of a 20 mg/kg IV dose in this study was based on previous studies where this dose was well tolerated and found to be both safe and effective (11). A recent pharmacokinetic study of TXA in dogs showed that 10 mg/kg IV and 20 mg/kg IV both improved maximum clot strength and reduction of clot lysis relative to the baseline (12). However, only treatment with 20 mg/kg IV resulted in plasma TXA levels above a threshold that allowed a complete inhibition of fibrinolysis in dogs, and the antifibrinolytic effects also persisted for a longer duration than at the lower dose (12). Given the relatively high incidence of vomiting in our study at 20 mg/kg, future studies might focus on exploring effective and safer administration options for the TXA group, such as more frequent administration of tranexamic acid of 10 mg/kg IV or administration of an IV loading dose, followed by oral drug administration. Another consideration is whether lower doses of antifibrinolytic agents would be sufficient to inhibit fibrinolysis to a clinically relevant degree in a patient with thrombocytopenia rather than the hyperfibrinolytic models which have been used for dosing studies to date.
Viscoelastic testing was not performed in this study in part due to limited availability at study sites. While it would be interesting to assess the global coagulation properties and response to antifibrinolytic therapy in dogs with ITP, protocols to do this have not been standardized and the purpose of this small study was to focus on the overall clinical effect.
This study is one of the first to utilize a recently published clinical bleeding score (13). The system was deemed to be easily applicable by staff across several busy clinical sites supporting its ongoing use in future studies.
In conclusion, this cohort feasibility study provides useful information for the design of future trials about tranexamic acid given to dogs with ITP including outcome measures and safety. Tranexamic acid did not confer a significant clinical benefit in this small cohort and was associated with a high incidence of vomiting. Future studies with larger, more targeted, patient populations and refined dosing protocols are needed to draw more robust conclusions about the use of antifibrinolytics in dogs with ITP.
Data availability statement
The raw data supporting the conclusions of this article will be made available by the authors, without undue reservation.
Ethics statement
The animal study was reviewed and approved by Animal Health Trust Ethics Committee. Written informed consent was obtained from the owners for the participation of their animals in this study.
Author contributions
All authors contributed to the conception and design of the study. All authors contributed to data collection, manuscript revision, read, and approved the submitted version.
Funding
The cost of tranexamic acid was funded by each participating institution. Linnaeus Veterinary Limited supported the costs of the Open Access Publication Charges.
Acknowledgments
The authors thank clinicians and residents involved in the data collection. Special thanks to all the participant dogs and their families for their contribution to this investigation.
Conflict of interest
The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
Publisher’s note
All claims expressed in this article are solely those of the authors and do not necessarily represent those of their affiliated organizations, or those of the publisher, the editors and the reviewers. Any product that may be evaluated in this article, or claim that may be made by its manufacturer, is not guaranteed or endorsed by the publisher.
References
2. Ettinger SJ. Textbook of Veterinary Internal Medicine. 8th ed. St Louis, MO, USA. Saunders. 2017. p. 847–855.
Google Scholar
3. Rozanski EA, Callan MB. Hughes D, Sanders N, Giger U. Comparison of platelet count recovery with use of vincristine and prednisone or prednisone alone for treatment for severe immune-mediated thrombocytopenia in dogs. J Am Vet Med Assoc. (2002) 220:477–81. doi: 10.2460/javma.2002.220.477
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Bianco D, Armstrong PJ, Washabau RJ, A. prospective, randomized, double-blinded, placebo-controlled study of human intravenous immunoglobulin for the acute management of presumptive primary immune-mediated thrombocytopenia in dogs. J Vet Internal Med. (2009) 23:1071–8. doi: 10.1111/j.1939-1676.2009.0358.x
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Williams DA, Maggio-Price L. Canine idiopathic thrombocytopenia: clinical observations and long-term follow-up in 54 cases. J Am Vet Med Assoc. (1984) 185:660–3.
PubMed Abstract | Google Scholar
6. O’Marra SK, Delaforcade AM, Shaw SP. Treatment and predictors of outcome in dogs with immune-mediated thrombocytopenia. J Am Vet Med Assoc. (2011) 238:346–352. doi: 10.2460/javma.238.3.346
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Henry DA, Carless PA, Moxey AJ, O’Connell D, Stokes BJ, Fergusson DA, et al. Anti-Fibrinolytic Use for Minimising Perioperative Allogeneic Blood Transfusion. Cochrane Library. (2011). p. 3. doi: 10.1002/14651858.CD001886.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Mayer B, Salama A. Successful treatment of bleeding with tranexamic acid in a series of 12 patients with immune thrombocytopenia. Vox Sang. (2017) 112:767–72. doi: 10.1111/vox.12549
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Gernsheimer TB, Brown SP, Triulzi DJ, Key NS, El Kassar N, Herren H, et al. Effects of tranexamic acid prophylaxis on bleeding outcomes in hematologic malignancy: the a-TREAT trial. Blood. (2020) 136:1–2. doi: 10.1182/blood-2020-138920
CrossRef Full Text | Google Scholar
10. Marín LM, Iazbik MC, Zaldivar-Lopez S, Lord LK, Stingle N, Vilar P, et al. Retrospective evaluation of the effectiveness of epsilon aminocaproic acid for the prevention of postamputation bleeding in retired racing Greyhounds with appendicular bone tumors: 46 cases (2003–2008). J Vet Emergency Critical Care. (2012) 22:332–40. doi: 10.1111/j.1476-4431.2012.00735.x
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Sigrist NE, Hofer-Inteeworn N, Schefer RJ, Kuemmerle-Fraune C, Schnyder M, Kutter APN. Hyperfibrinolysis and hypofibrinogenemia diagnosed with Rotational Thromboelastometry in dogs naturally infected with Angiostrongylus vasorum. J Vet Internal Med. (2017) 31:1091–9. doi: 10.1111/jvim.14723
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Osekavage KE, Brainard BM, Lane SL, Almoslem M, Arnold D, Koenig A. Pharmacokinetics of tranexamic acid in healthy dogs and assessment of its antifibrinolytic properties in canine blood. Am J Vet Res. (2018) 79:1057–63. doi: 10.2460/ajvr.79.10.1057
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Makielski KM, Brooks MB, Wang C, Cullen JN, O’Connor AM, LeVine DN. Development and implementation of a novel immune thrombocytopenia bleeding score for dogs. J Vet Internal Med. (2018) 32:1–10. doi: 10.1111/jvim.15089
PubMed Abstract | CrossRef Full Text | Google Scholar
Транексам® (Tranexam) инструкция по применению
📜 Инструкция по применению Транексам®
💊 Состав препарата Транексам®
✅ Применение препарата Транексам®
📅 Условия хранения Транексам®
⏳ Срок годности Транексам®
Описание лекарственного препарата
Транексам®
(Tranexam)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2020
года, дата обновления: 2021.04.15
Владелец регистрационного удостоверения:
Контакты для обращений:
НИЖФАРМ
(Россия)
Код ATX:
B02AA02
(Транексамовая кислота)
Лекарственные формы
| Транексам® |
Р-р д/в/в введения 50 мг/мл: амп. 5 мл 5, 10, 100, 250 или 500 шт. рег. №: ЛСР-001709/07 |
|
|
Р-р д/в/в введения 100 мг/мл: амп. 5 мл 5, 10, 100, 250 или 500 шт., фл. 5 мл 1, 10 или 20 шт. рег. №: ЛП-004676 |
Форма выпуска, упаковка и состав
препарата Транексам®
Раствор для в/в введения прозрачный, бесцветный.
Вспомогательные вещества: вода д/и — до 1 мл.
5 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (1) — пачки картонные.
5 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (2) — пачки картонные.
Упаковки для стационаров:
5 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (20) — коробки картонные.
5 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (50) — коробки картонные.
5 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (100) — коробки картонные.
Раствор для в/в введения прозрачный, бесцветный.
Вспомогательные вещества: вода д/и — до 1 мл.
5 мл — ампулы нейтрального стекла (5) — упаковки контурные ячейковые (1) — пачки картонные.
5 мл — ампулы нейтрального стекла (5) — упаковки контурные ячейковые (2) — пачки картонные.
10 мл — флаконы бесцветного стекла (1) — пачки картонные.
Упаковки для стационаров:
5 мл — ампулы нейтрального стекла (5) — упаковки контурные ячейковые (20) — коробки картонные.
5 мл — ампулы нейтрального стекла (5) — упаковки контурные ячейковые (50) — коробки картонные.
5 мл — ампулы нейтрального стекла (5) — упаковки контурные ячейковые (100) — коробки картонные.
10 мл — флаконы бесцветного стекла (10) — коробки картонные.
10 мл — флаконы бесцветного стекла (20) — коробки картонные.
Фармакологическое действие
Транексамовая кислота — антифибринолитическое средство, специфически ингибирующее активацию профибринолизина (плазминогена) и ето превращение в фибринолизин (плазмин). Обладает местным и системным гемостатическим действием при кровотечениях, связанных с повышением фибринолиза, а также противовоспалительным, противоаллергическим, противоинфекционным и противоопухолевым действиями за счет подавления образования кининов и других активных пептидов, участвующих в аллергических и воспалительных реакциях. В эксперименте подтверждена собственная анальгетическая активность транексамовой кислоты, а также сверхсуммарный потенцирующий эффект в отношении анальгетической активности опиатов.
Транексамовая кислота в концентрации 1 мг/мл не влияет на агрегацию тромбоцитов in vitro, в концентрации до 10 мг/мл крови не влияет на количество тромбоцитов, время свертывания крови и различные факторы свертывания крови в цельной крови или цитратной крови здорового человека. В то же время, транексамовая кислота как в концентрации 1 мг/мл, так и 10 мг/мл крови удлиняет тромбиновое время.
В эксперименте подтверждена собственная анальгетическая активность транексамовой кислоты, а также сверхсуммарный потенцирующий эффект в отношении анальгетической активности опиатов. Данные доклинических исследований свидетельствуют о наличии у транексамовой кислоты антиканцерогенных и антиангиогенных свойств.
Фармакокинетика
Распределяется в тканях относительно равномерно (исключение — спинномозговая жидкость, где концентрация составляет 1/10 от плазменной); проникает через плацентарный и гематоэнцефалический барьер, в грудное молоко (около 1% от концентрации в плазме матери). Обнаруживается в семенной жидкости, где снижает фибринолитическую активность, но не влияет на миграцию сперматозоидов.
Начальный Vd — 9-12 л. Связывание с белками плазмы (профибринолизином) — менее 3%. В крови около 3% связано с белком (плазминогеном).
Концентрация в цереброспинальной жидкости составляет 1/10 от плазменной. Общий почечный клиренс равен плазменному.
Антифибринолитическая концентрация в различных тканях сохраняется 17 ч, в плазме — до 7-8 ч.
Метаболизируется незначительная часть. Кривая «концентрация-время» имеет трехфазную форму с Т1/2 в терминальной фазе — 2 ч. Общий почечный клиренс равен плазменному (7 л/ч).
Выводится почками (основной путь — гломерулярная фильтрация) — более 95% в неизмененном виде в течение первых 12 ч. Идентифицировано два метаболита транексамовой кислоты: N-ацетилированное и дезаминированное производные.
Фармакокинетика у особых групп пациентов
При нарушенной функции почек существует риск кумуляции транексамовой кислоты.
Показания препарата
Транексам®
Профилактика и лечение кровотечений, обусловленных генерализованным или локальным фибринолизом у взрослых и детей в возрасте 1 год и старше, включая:
- меноррагии и метроррагии;
- желудочно-кишечные кровотечения;
- кровотечения после хирургических вмешательств на предстательной железе и мочевыводящих путях;
- кровотечения при оперативных вмешательствах в полости носа, рта и глотки (аденоидэктомия, тонзиллэктомия, экстракция зуба);
- кровотечения при торакальных, абдоминальных и иных обширных оперативных вмешательствах (в т.ч. при кардиохирургических операциях);
- акушерско-гинекологические кровотечения (включая кровотечения при гинекологических оперативных вмешательствах);
- кровотечения, вызванные применением фибринолитических лекарственных средств.
Режим дозирования
Препарат вводят в/в (капельно или струйно медленно). Скорость введения 1 мл/мин (50 мг/мин). Следует избегать быстрого внутривенного введения.
Для введения препарата со скоростью 50 мг/мин:
- неразведенный раствор транексамовой кислоты (100 мг/мл) вводится со скоростью 0.5 мл/мин;
- 1% раствор (10 мг/мл) можно вводить со скоростью 5 мл/мин (1 г транексамовой кислоты в 100 мл инфузионного раствора).
Раствор транексамовой кислоты совместим с большинством инфузионных растворов (см. раздел «Лекарственное взаимодействие»).
Меноррагии и метроррагии, желудочно-кишечные кровотечения: 500 мг (2 ампулы по 5 мл) 2-3 раза/сут с момента развития кровотечения до его остановки.
Лечение кровотечений после хирургических вмешательств на предстательной железе и мочевыводящих путях: 1000 мг (4 ампулы по 5 мл) 3 раза/сут с момента развития кровотечения до его остановки.
Профилактика и лечение кровотечений при оперативных вмешательствах в полости носа, рта и глотки: 10-15 мг/кг массы тела каждые 6-8 ч до остановки кровотечения.
Профилактика и лечение кровотечений при торакальных, абдоминальных и иных больших оперативных вмешательствах: 15 мг/кг массы тела каждые 6-8 ч до остановки кровотечения.
Профилактика и лечение кровотечений при кардиохирургических операциях: нагрузочная доза 15 мг/кг после индукции анестезии до начала оперативного вмешательства, затем в/в инфузия со скоростью 4.5 мг/кг/ч в течение всей операции; рекомендуется ввести транексамовую кислоту в дозе 0.6 мг/кг в аппарат искусственного кровообращения.
Лечение акушерско-гинекологических кровотечений (включая кровотечения при гинекологических оперативных вмешательствах): 15 мг/кг массы тела каждые 6-8 ч с момента развития кровотечения до его остановки.
Лечение кровотечений, вызванных применением фибринолитических лекарственных средств: 10 мг/кг массы тела каждые 6-8 ч с момента развития кровотечения до его остановки.
В случае необходимости длительной (более 48 ч) гемостатической терапии рекомендуется применение препаратов транексамовой кислоты в таблетированной лекарственной форме.
Дети старше 1 года
Опыт применения препаратов транексамовой кислоты у детей ограничен. Рекомендуемая доза препарата при лечении кровотечений, обусловленных локальным и генерализованным фибринолизом, составляет 20 мг/кг/сут.
У пациентов с легким и умеренным нарушением выделительной функции почек необходима коррекция дозы и кратности приема транексамовой кислоты:
У пациентов с нарушением функции печени коррекция дозы не требуется.
У пациентов пожилого возраста при отсутствии почечной недостаточности коррекция дозы не требуется.
Побочное действие
Частота возникновения нежелательных лекарственных реакций определена в соответствии с классификацией ВОЗ: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000), частота неизвестна (не может быть установлена по имеющимся данным).
Со стороны пищеварительной системы: часто — тошнота, рвота, диарея (симптомы проходят при снижении дозы).
Со стороны кожи и подкожных тканей: редко — кожные аллергические реакции, в т.ч. аллергический дерматит.
Со стороны органа зрения: редко — нарушения зрения, в т.ч. нарушение цветового восприятия, тромбоз сосудов сетчатки.
Со стороны сердечно-сосудистой системы: редко — тромбоэмболические осложнения, выраженное снижение АД (обычно вследствие чрезмерно быстрого в/в введения); очень редко — артериальные и венозные тромбозы различной локализации; частота неизвестна — острый инфаркт миокарда, тромбоз церебральных артерий, тромбоз сонных артерий, инсульт, тромбоз глубоких вен нижних конечностей, тромбоэмболия легочной артерии, тромбоз почечной артерии с развитием кортикального некроза и острой почечной недостаточности, окклюзия аортокоронарного шунта, тромбоз центральной артерии и вены сетчатки.
Со стороны иммунной системы: очень редко — реакции гиперчувствительности, в т.ч. анафилактический шок.
Со стороны нервной системы: редко — головокружение, судороги.
Противопоказания к применению
- повышенная чувствительность к транексамовой кислоте или другим компонентам препарата;
- хроническая почечная недостаточность тяжелой степени (СКФ менее 30 мг/мл/1.73 м2) в связи с риском кумуляции;
- венозный или артериальный тромбоз в настоящее время или в анамнезе (в т.ч. тромбоз глубоких вен ног, тромбоэмболия легочной артерии, тромбоз внутричерепных сосудов) при невозможности одновременной терапии антикоагулянтами;
- фибринолиз вследствие коагулопатии потребления (гипокоагуляционная стадия ДВС-синдрома);
- судороги в анамнезе;
- приобретенное нарушение цветового зрения;
- субарахноидальное кровоизлияние (в связи с риском развития отека мозга, ишемии и инфаркта головного мозга);
- лечение меноррагий у пациенток в возрасте младше 16 лет (опыт применения отсутствует);
- возраст младше 1 года (опыт применения отсутствует).
С осторожностью следует применять транексамовую кислоту в следующих ситуациях:
- гематурия, вызванная заболеваниями паренхимы почек, и кровотечения из верхних отделов мочевыводящих путей (риск вторичной механической обструкции мочевыводящих путей сгустком крови с развитием анурии);
- пациенты с высоким риском развития тромбоза (тромбоэмболические события в анамнезе или семейный анамнез тромбоэмболических заболеваний, верифицированный диагноз тромбофилии);
- пациентки, принимающие комбинированные пероральные контрацептивы (в связи с повышенным риском венозных тромбоэмболических осложнений и артериальных тромбозов);
- одновременное применение препаратов факторов свертывания крови II, VII, IX и X в комбинации [протромбинового комплекса] или антиингибиторного коагулянтного комплекса;
- пациенты, получающие терапию антикоагулянтами (опыт применения ограничен);
- ДВС-синдром;
- наличие крови в полостях, например, в плевральной полости, полостях суставов и мочевыводящих путях.
Применение при беременности и кормлении грудью
В доклинических исследованиях транексамовая кислота не оказывала тератогенного воздействия. Адекватные и строго контролируемые исследования эффективности и безопасности применения препаратов транексамовой кислоты у беременных не проводились. Транексамовая кислота проникает через плацентарный барьер и может содержаться в пуповинной крови в концентрации, близкой к материнской.
Поскольку исследования репродуктивной функции у животных не всегда позволяют предсказать реакции у человека, транексамовую кислоту следует применять во время беременности только в случае крайней необходимости.
Транексамовая кислота проникает в грудное молоко (концентрация препарата в молоке составляет около 1% концентрации в плазме крови матери). Развитие антифибринолитического эффекта у младенца маловероятно. Тем не менее, следует соблюдать осторожность при применении транексамовой кислоты у кормящих матерей.
Применение при нарушениях функции печени
У пациентов с нарушением функции печени коррекция дозы не требуется.
Применение при нарушениях функции почек
Противопоказано применение препарата при хронической почечной недостаточности тяжелой степени (СКФ менее 30 мг/мл/1.73 м2) в связи с риском кумуляции.
У пациентов с легким и умеренным нарушением выделительной функции почек необходима коррекция дозы.
Применение у детей
Противопоказано применение препарата у пациентов в возрасте до 1 года и для лечения меноррагий у пациенток в возрасте младше 16 лет (опыт применения отсутствует).
Применение у пожилых пациентов
У пациентов пожилого возраста при отсутствии почечной недостаточности коррекция дозы не требуется.
Особые указания
Транексамовую кислоту нельзя вводить в/м.
Описаны случаи судорог, которые ассоциировались с применением транексамовой кислоты. У пациентов, которым проводилась операция аортокоронарного шунтирования, судороги, в большинстве случаев, развивались при применении транексамовой кислоты в высоких дозах. При применении препарата в рекомендуемых дозах частота судорог после операции была такой же, как у пациентов, не получавших транексамовую кислоту.
При применении транексамовой кислоты возможно развитие нарушений зрения, в т.ч. нарушение цветового восприятия. Перед началом и в процессе лечения препаратами транексамовой кислоты необходимо проведение консультаций офтальмолога (определение остроты зрения, цветного зрения, состояние глазного дна). При возникновении нарушений зрения на фоне лечения транексамовой кислотой, препарат необходимо отменить.
Препараты транексамовой кислоты следует применять с осторожностью при гематурии, вызванной заболеваниями паренхимы почек, поскольку в этих условиях часто наблюдается внутрисосудистое осаждение фибрина, что может усугубить поражение почек. Кроме того, в случаях массивного кровотечения любой этиологии из верхних мочевыводящих путей, антифибринолитическая терапия повышает риск образования сгустков крови в почечной лоханке и/или мочеточнике и, соответственно, вторичной механической обструкции мочевыводящих путей и развитии анурии.
До начала применения транексамовой кислоты следует принять во внимание возможные факторы риска развития тромбоэмболических событий. Хотя проведенные клинические исследования не выявили значительного повышения частоты развития тромбозов, однако риск тромботических осложнений не может быть полностью исключен. Описаны случаи развития венозных и артериальных тромбозов и тромбоэмболии у пациентов, получавших транексамовую кислоту. Кроме того, сообщалось о случаях окклюзии центральной артерии сетчатки и центральной вены сетчатки. У нескольких пациентов развился внутричерепной тромбоз на фоне лечения транексамовой кислотой. Соответственно, у пациентов с высоким риском развития тромбоза (тромбоэмболические осложнения в анамнезе, случаи тромбоэмболии у родственников, верифицированный диагноз тромбофилии) следует применять транексамовую кислоту только в случае крайней необходимости и под строгим врачебным контролем. Перед применением транексамовой кислоты следует провести обследование, направленное на выявление факторов риска тромбоэмболических осложнений.
Наличие крови в полостях, например, в плевральной полости, полостях суставов и мочевыводящих путях (в т.ч. в почечных лоханках и в мочевом пузыре) может приводить к образованию в них «нерастворимого сгустка» вследствие внесосудистого свертывания крови, который может быть устойчив к физиологическому фибринолизу.
Пациенткам с нерегулярным менструальным кровотечением не следует назначать транексамовую кислоту до установления причины дисменореи. Если объем менструального кровотечения неадекватно снижается на фоне лечения транексамовой кислотой, необходимо рассмотреть возможность альтернативного лечения.
Эффективность и безопасность препаратов транексамовой кислоты при лечении меноррагии у пациенток младше 16 лет не установлены.
Следует с осторожностью применять транексамовую кислоту у женщин, одновременно принимающих комбинированные пероральные контрацептивы, в связи с повышенным риском развития тромбозов.
Применение транексамовой кислоты у пациентов с ДВС-синдром в большинстве случаев противопоказано. Транексамовая кислота может быть назначена таким пациентам только в случае, если у пациента имеются симптомы преобладания активации фибринолитической системы с острым сильным кровотечением. В таких острых случаях однократного введения транексамовой кислоты в дозе 1 г часто бывает достаточно для прекращения кровотечения. Назначение транексамовой кислоты при ДВС-синдроме должно производиться только при наличии соответствующих данных лабораторного обследования и после оценки этих данных специалистом.
В связи с отсутствием адекватных клинических исследований, одновременное применение транексамовой кислоты с антикоагулянтами должно осуществляться под тщательным наблюдением специалиста, имеющего опыт лечения нарушений свертывания крови.
Влияние на способность к управлению транспортными средствами и механизмами
Способность транексамовой кислоты влиять на скорость психомоторных реакций и на способность управлять транспортными или другими механическими средствами не изучалась. Транексамовая кислота может вызывать головокружение и нарушения зрения, и, соответственно, может влиять на способность заниматься потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
Имеются ограниченные данные о случаях передозировки. Сообщается об одном случае передозировки (прием внутрь 37 г транексамовой кислоты).
Симптомы: головокружение, головная боль, тошнота, рвота, диарея, ортостатические симптомы (в т.ч. головокружение при переходе из горизонтального в вертикальное положение), ортостатическая артериальная гипотензия. У предрасположенных пациентов повышается риск тромбозов.
Лечение: антидот неизвестен. При подозрении на передозировку транексамовой кислоты необходима госпитализация. При оказании помощи следует вызвать рвоту, затем провести промывание желудка. Активированный уголь снижает абсорбцию транексамовой кислоты при приеме внутрь в течение первых 1-2 ч после передозировки. Если пациент находится в бессознательном состоянии или при нарушении глотания активированный уголь может быть введен через назогастральный зонд. Рекомендуется прием внутрь или парентеральное введение большого количества жидкости для усиления почечной экскреции, форсированный диурез, контроль количества выделяемой мочи. В некоторых случаях может быть оправданным применение антикоагулянтов.
Лекарственное взаимодействие
Специальные клинические исследования, посвященные изучению взаимодействия транексамовой кислоты с другими лекарственными средствами, не проводились.
Транексамовая кислота препятствует развитию фармакологического эффекта фибринолитических (тромболитических) препаратов.
Комбинированные пероральные контрацептивы увеличивают риск венозных тромбоэмболических осложнений и артериальных тромбозов (в частности, ишемического инсульта и инфаркта миокарда). Опыт применения транексамовой кислоты у женщин, принимающих комбинированные пероральные контрацептивны, отсутствует. Поскольку транексамовая кислота обладает антифибринолитическим эффектом, одновременное применение с комбинированными пероральными контрацептивами может привести к дополнительному повышению риска тромботических осложнений.
Одновременное применение транексамовой кислоты с препаратами факторов свертывания крови II, VII, IX и X в комбинации [протромбиновым комплексом] или антиингибиторным коагулянтным комплексом повышает риск развития тромбоза.
Возможно повышение риска тромботических осложнений (в частности, инфаркта миокарда) при одновременном применении транексамовой кислоты с гидрохлоротиазидом, десмопрессином, ампициллином-сульбактамом, ранитидином и нитроглицерином.
При сочетанном применении с гемостатическими препаратами возможна активация тромбообразования.
Одновременный прием транексамовой кислоты с антикоагулянтами должен проводиться под строгим контролем врача (опыт применения ограничен).
Фармацевтическое лекарственное взаимодействие
Раствор транексамовой кислоты совместим с большинством инфузионных растворов (0.9% раствор натрия хлорида, раствор Рингера, 5% раствор декстрозы, растворы аминокислот, декстраны).
Раствор транексамовой кислоты совместим с нефракционированным гепарином.
Раствор транексамовой кислоты фармацевтически несовместим с урокиназой, норэпинефрином, дипиридамолом, диазепамом.
Раствор транексамовой кислоты нельзя смешивать с растворами антибиотиков (пенициллины, тетрациклины) и препаратами крови.
Условия хранения препарата Транексам®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Транексам®
Срок годности раствора для в/в введения 50 мг — 5 лет; раствора для в/в введения 100 мг- 3 года. Не применять по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
НИЖФАРМ
(Россия)
|
Московский офис |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Битранекс
(БИНЕРГИЯ, Россия)
Гемтраникс
(ФармФирма Сотекс, Россия)
Санксамик
(С.П.ИНКОМЕД, Россия)
Стагемин
(НОВОСИБХИМФАРМ, Россия)
Теовексал
(ГРОТЕКС, Россия)
Траксара
(ВЕРОФАРМ, Россия)
Транексамовая кислот…
(ПРОМОМЕД РУС, Россия)
Транексамовая кислот…
(НОВАЯ ФАРМА, Россия)
Транексамовая кислот…
(СИНТЕЗ, Россия)
Транексамовая кислот…
(Б-ФАРМ, Россия)
Все аналоги
258 просмотров
Здравствуйте, нашей собаке 14 лет, вес 37 кг. Сейчас в тяжелом состоянии, вет клинику сегодня посещали, но до следующего приёма впереди вся ночь. Подскажите пожалуйста можно ли при псебдомебранозном колите принять транексан? Стул цвета дёгтя, слизь с кровью. И можно ли принять смекту при желудочно-кишечных кровотечениях?
На сервисе СпросиВрача доступна консультация ветеринара по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!
Ветеринар
Здравствуйте. Нельзя, такие вопросы нужно обсуждать с ветеринарным врачом, который ведет контроль общего состояния и проводит антибиотикотерапию.
Любой врач должен назначить сорбенты. Странно, что вам ничего не сказал ваш врач. Если вы длительно лечитесь, и нет улучшений, значит пора ставить под сомнение компетенцию врача, либо он вводит вас в заблуждение. Диагноз который вы огласили очень легко оспорить. Дешевые тесты которые делают некоторые клиники неинформативны, т.е. они могут дать положительную реакцию, и намекнуть врачу на первопричину.
Так же необходимо дополнить вопрос результатами анализов.
Ветеринар
Я бы искал на УЗИ новообразование/язву и тбд
Кровить при колите может, но в 14 лет колит редко доводит до такого состояния.
Транексам конечно необходимо если идёт кровь и кровавый стул.
Но искать первопричину необходимо.
Ветеринар
Добрый день. Коллеги выше правильно написали, что необходимо уточнить диагноз и провести полное обследование. Если здесь вы хотите получить какой то адекватный совет, то опишите полностью анамнез животного, когда начались проблемы, чем вы кормили и кормите сейчас, есть ли аппетит. Если проводилось какое то обследование, то приложите к вопросу результаты анализов и обследований. Из быстрого назначения можно применять Омепразол
Ветеринар
Здравствуйте, желательно выяснить причину кровотечения из ЖКТ.
Транексам принимать можно, Смекту тоже, но при условии отсутствия угрозы наличия или возможности развития непроходимости ЖКТ.
Оцените, насколько были полезны ответы врачей
Проголосовало 0 человек,
средняя оценка 0
Что делать, если я не нашел ответ на свой вопрос?
Если у Вас похожий или аналогичный вопрос, но Вы не нашли на него ответ — получите свою онлайн консультацию врача.
Если Вы хотите получить более подробную консультацию врача и решить проблему быстро и индивидуально — задайте платный вопрос в приватном личном сообщении. Будьте здоровы!
В сегодняшней ВЕТдевушка онлайн-ветеринарное непрерывное образование Подкаст, мы интервью Доктор Морган Келли, DACVECC на ее бумаге «Ретроспективный анализ использования транексамовой кислоты у собак и кошек в критическом состоянии (2018–2019 гг.): 266 собак и 28 кошек». Если вы не знаете, что такое транексамовая кислота (TXA) и как она действует, чтобы остановить кровотечение, вы хотите настроиться! Узнайте, как ТХА используется в ветеринарии по сравнению с человеческой медициной, каковы показания или противопоказания для его применения в ветеринарии, как вы можете применять его и как вы можете использовать ТХА в своей повседневной практике!
Рекомендации:
Келли М, Синнотт-Штуцман В., Уилан М. и соавт. Ретроспективный анализ применения транексамовой кислоты у собак и кошек в критическом состоянии. (2018–2019): 266 собак и 28 кошек. J Vet Emerg Crit Care 2022 (32): 6: 791-799.
Сегодняшний подкаст VETgirl спонсируется Здоровье животных Мерк, производители Nobivac® Intra-Trac® Oral BbPi, первого перорального Bordetella bronchiseptica вакцина против вируса парагриппа собак с запатентованной технологией Immuno-Mist-R™.
Ответы
|
||||||||
|
||||||||
Посмотреть всех экспертов из раздела Медицина
Здравствуйте, выводил папиломы Веррукацидом,нечаянно намазал родинку на пояснице,кожа с неё слезла,такое ощущение,что гноится,прошло 1,5 недели,улучшений нет,фото прилагаю,посоветуйте пожалуйста,что
0
- Главная
- Продукты
- Транексам 50 мг/мл (раствор для в/в введения)
Инструкция по применению Транексам 50 мг/мл (раствор для в/в введения)
Идентификация и классификация
Лекарственная форма
раствор для внутривенного введения
Состав
Состав на 1 мл:
Действующее вещество: транексамовая кислота 50 мг;
Вспомогательное вещество: вода для инъекций до 1 мл.
Описание
Прозрачный, бесцветный раствор.
Фармакотерапевтическая группа
Гемостатическое средство — ингибитор фибринолиза
Фармакологические свойства. Фармакодинамика
Транексамовая кислота — антифибринолитическое средство, специфически ингибирующее активацию профибринолизина (плазминогена) и его превращение в фибринолизин (плазмин). Обладает местным и системным гемостатическим действием при кровотечениях, связанных с повышением фибринолиза, а также противовоспалительным, противоаллергическим, противоинфекционным и противоопухолевым действиями за счет подавления образования кининов и других активных пептидов, участвующих в аллергических и воспалительных реакциях. В эксперименте подтверждена собственная анальгетическая активность транексамовой кислоты, а также сверхсуммарный потенциирующий эффект в отношении анальгетической активности опиатов.
Транексамовая кислота в концентрации 1 мг/мл не влияет на агрегацию тромбоцитов in vitro, в концентрации до 10 мг/мл крови не влияет на количество тромбоцитов, время свертывания крови и различные факторы свертывания крови в цельной крови или цитратной крови здорового человека. В то же время, транексамовая кислота как в концентрации 1 мг/мл, так и 10 мг/мл крови удлиняет тромбиновое время.
Фармакологические свойства. Фармакокинетика
Распределяется в тканях относительно равномерно (исключение — спинномозговая жидкость, где концентрация составляет 1/10 от плазменной); проникает через плацентарный и гематоэнцефалический барьер, в грудное молоко (около 1% от концентрации в плазме матери). Обнаруживается в семенной жидкости, где снижает фибринолитическую активность, но не влияет на миграцию сперматозоидов. Начальный объем распределения — 9-12 л. Связь с белками плазмы (профибринолизином) — менее 3%.
Антифибринолитическая концентрация в различных тканях сохраняется 17 ч, в плазме — до 7-8 ч.
Метаболизируется незначительная часть. Кривая «концентрация-время» имеет трехфазную форму с периодом полувыведения в терминальной фазе — 2 ч. Общий почечный клиренс равен плазменному (7 л/ч).
Выводится почками (основной путь — гломерулярная фильтрация) — более 95% в неизмененном виде в течение первых 12 ч. Идентифицировано два метаболита транексамовой кислоты: N-ацетилированное и дезаминированное производные. При нарушенной функции почек существует риск кумуляции транексамовой кислоты.
Показания к применению
Профилактика и лечение кровотечений, обусловленных генерализованным или локальным фибринолизом у взрослых и детей в возрасте 1 год и старше, включая:
- аномальные маточные кровотечения (АМК) (меноррагии и метроррагии);
- желудочно-кишечные кровотечения;
- кровотечения после хирургических вмешательств на предстательной железе и мочевыводящих путях;
- кровотечения при оперативных вмешательствах в полости носа, рта и глотки (аденоидэктомия, тонзиллэктомия, экстракция зуба);
- кровотечения при торакальных, абдоминальных и иных обширных оперативных вмешательствах (в т. ч. при кардиохирургических операциях);
- акушерско-гинекологические кровотечения (в т. ч. кровотечения при гинекологических оперативных вмешательствах);
- кровотечения, вызванные применением фибринолитических лекарственных средств.
Противопоказания
- Гиперчувствительность к транексамовой кислоте или другим компонентам препарата;
- Хроническая почечная недостаточность тяжелой степени (скорость клубочковой фильтрации [СКФ] менее 30 мг/мл/1,73м2) в связи с риском кумуляции;
- Венозный или артериальный тромбоз в настоящее время или в анамнезе (тромбоз глубоких вен ног, тромбоэмболия легочной артерии, тромбоз внутричерепных сосудов и др.) при невозможности одновременной терапии антикоагулянтами;
- Фибринолиз вследствие коагулопатии потребления (гипокоагуляционная стадия синдрома диссеминированного внутрисосудистого свертывания [ДВС-синдром]);
- Судороги в анамнезе;
- Приобретенное нарушение цветового зрения;
- Субарахноидальное кровоизлияние (в связи с риском развития отека мозга, ишемии и инфаркта головного мозга);
- Лечение аномальных маточных кровотечений (меноррагий) у пациенток в возрасте младше 16 лет (опыт применения отсутствует);
- Детский возраст до 1 года (опыт применения отсутствует).
С осторожностью
Транексамовую кислоту следует применять с осторожностью в следующих ситуациях:
- Гематурия, вызванная заболеваниями паренхимы почек, и кровотечения из верхних отделов мочевыводящих путей (риск вторичной механической обструкции мочевыводящих путей сгустком крови с развитием анурии) (см. раздел «Особые указания»);
- Пациенты с высоким риском развития тромбоза (тромбоэмболические события в анамнезе или семейный анамнез тромбоэмболических заболевании, верифицированный диагноз тромбофилии);
- Синдром диссеминированного внутрисосудистого свертывания [ДВС- синдром]);
- Наличие крови в полостях, например, в плевральной полости, полостях суставов и мочевыводящих путях;
- Пациенты, получающие терапию антикоагулянтами (опыт применения ограничен);
- Одновременное применение препаратов факторов свертывания крови II, VII, IX и X в комбинации [протромбинового комплекса] или антиингибиторного коагулянтного комплекса (см. раздел «Взаимодействие с другими лекарственными средствами»);
- Пациентки, принимающие комбинированные пероральные контрацептивы (в связи с повышенным риском венозных тромбоэмболических осложнений и артериальных тромбозов) (см. раздел «Взаимодействие с другими лекарственными средствами»).
Применение при беременности и в период грудного вскармливания
В доклинических исследованиях транексамовая кислота не оказывала тератогенного воздействия. Адекватные и строго контролируемые исследования эффективности и безопасности применения препаратов транексамовой кислоты у беременных не проводились. Транексамовая кислота проникает через плаценту и может содержаться в пуповинной крови в концентрации, близкой к материнской.
Поскольку исследования репродуктивной функции у животных не всегда позволяют предсказать реакции у человека, транексамовую кислоту следует применять во время беременности только в случае крайней необходимости.
Транексамовая кислота проникает в грудное молоко (концентрация препарата в молоке составляет около 1% от концентрации в плазме крови матери). Развитие антифибринолитического эффекта у младенца маловероятно. Тем не менее, следует соблюдать осторожность при применении транексамовой кислоты у кормящих матерей.
Способ применения и дозы
Внутривенно капельно или струйно медленно; скорость введения 1 мл/мин (50 мг/мин). Следует избегать быстрого внутривенного введения!
Взрослые пациенты:
- Аномальные маточные кровотечения (меноррагии и метроррагии), желудочно-кишечные кровотечения: 500 мг (2 ампулы по 5 мл) 2-3 раза в сутки с момента развития кровотечения до его остановки.
- Лечение кровотечений после хирургических вмешательств на предстательной железе и мочевыводящих путях: 1000 мг (4 ампулы по 5 мл) 3 раза в сутки с момента развития кровотечения до его остановки.
- Профилактика и лечение кровотечений при оперативных вмешательствах в полости носа, рта и глотки: 10-15 мг/кг массы тела каждые 6-8 часов до остановки кровотечения.
- Профилактика и лечение кровотечений при торакальных, абдоминальных и иных больших оперативных вмешательствах: 15 мг/кг массы тела каждые 6-8 часов до остановки кровотечения.
- Профилактика и лечение кровотечений при кардиохирургических операциях: нагрузочная доза 15 мг/кг после индукции анестезии до начала оперативного вмешательства, затем внутривенная инфузия со скоростью 4,5 мг/кг/час в течение всей операции; рекомендуется ввести транексамовую кислоту в дозе 0,6 мг/кг в аппарат искусственного кровообращения.
- Лечение акушерско-гинекологических кровотечений (включая кровотечения при гинекологических оперативных вмешательствах): 15 мг/кг массы тела каждые 6-8 часов с момента развития кровотечения до его остановки.
- Лечение кровотечений, вызванных применением фибринолитических лекарственных средств: 10 мг/кг массы тела каждые 6-8 часов с момента развития кровотечения до его остановки.
В случае необходимости длительной (более 48 часов) гемостатической терапии рекомендуется применение препаратов транексамовой кислоты в таблетированной лекарственной форме.
Дети старше 1 года
Опыт применения препаратов транексамовой кислоты у детей ограничен. Рекомендуемая доза препарата при лечении кровотечений, обусловленных локальным и генерализованным фибринолизом, составляет 20 мг/кг/сутки.
Применение препарата у особых групп пациентов
Нарушение функции почек
У пациентов с легким и умеренным нарушением выделительной функции почек необходима коррекция дозы и кратности приема транексамовой кислоты:
| Концентрация креатинина в сыворотке крови | Скорость клубочковой фильтрации (СКФ) | Доза транексамовой кислоты | Кратность приема |
| 120-249 мкмоль/л (1,36-2,82 мг/дл) | 60-89 мл/мин/1,73м 2 | 15 мг/кг массы тела | 2 раза в сутки |
| 250-500 мкмоль/л (2,83-5,66 мг/дл) | 30-59 мл/мин/1,73м 2 | 15 мг/кг массы тела | 1 раз в сутки |
Нарушение функции печени
У пациентов с нарушением функции печени коррекция дозы не требуется.
Пожилой возраст
У пожилых пациентов при отсутствии почечной недостаточности коррекция дозы не требуется.
Побочное действие
Частота возникновения нежелательных лекарственных реакций определена в соответствии с классификацией ВОЗ: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000), частота неизвестна (не может быть установлена по имеющимся данным).
Нарушения со стороны желудочно-кишечного тракта:
часто — тошнота, рвота, диарея (симптомы проходят при снижении дозы).
Нарушения со стороны кожи и подкожных тканей:
редко — кожные аллергические реакции, в т. ч. аллергический дерматит.
Нарушения со стороны органа зрения:
редко — нарушения зрения, в т. ч. нарушение цветового восприятия, тромбоз сосудов сетчатки.
Нарушения со стороны сосудов:
редко — тромбоэмболические осложнения, выраженное снижение АД (обычно вследствие чрезмерно быстрого внутривенного введения);
очень редко — артериальные и венозные тромбозы различной локализации;
частота неизвестна — острый инфаркт миокарда, тромбоз церебральных артерий, тромбоз сонных артерий, инсульт, тромбоз глубоких вен ног, тромбоэмболия легочной артерии, тромбоз почечной артерии с развитием кортикального некроза и острой почечной недостаточности, окклюзия аорто-коронарного шунта, тромбоз центральной артерии и вены сетчатки.
Нарушения со стороны иммунной системы:
очень редко — реакции гиперчувствительности, в т. ч. анафилактический шок.
Нарушения со стороны нервной системы:
редко — головокружение, судороги.
Передозировка
Имеются ограниченные данные о случаях передозировки. Сообщается об одном случае передозировки (прием внутрь 37 г транексамовой кислоты).
Симптомы: головокружение, головная боль, тошнота, рвота, диарея, ортостатические симптомы (в т. ч., головокружение при переходе из горизонтального в вертикальное положение), ортостатическая артериальная гипотензия. У предрасположенных пациентов повышается риск тромбозов.
Лечение: антидот неизвестен. При подозрении на передозировку транексамовой кислоты необходима госпитализация. При оказании помощи следует вызвать рвоту, затем провести промывание желудка. Активированный уголь снижает абсорбцию транексамовой кислоты при приеме внутрь в течение первых 1-2 ч после передозировки. Если пациент находится в бессознательном состоянии или при нарушении глотания активированный уголь может быть введен через назогастральный зонд. Рекомендуется прием внутрь или парентеральное введение большого количества жидкости для усиления почечной экскреции, форсированный диурез, контроль количества выделяемой мочи. В некоторых случаях может быть оправданным применение антикоагулянтов.
Взаимодействие с другими лекарственными препаратами
Специальные клинические исследования, посвященные изучению взаимодействий транексамовой кислоты с другими лекарственными средствами, не проводились.
Транексамовая кислота препятствует развитию фармакологического эффекта фибринолитических (тромболитических) препаратов.
Комбинированные пероральные контрацептивы увеличивают риск венозных тромбоэмболических осложнений и артериальных тромбозов (в частности, ишемического инсульта и инфаркта миокарда). Опыт применения транексамовой кислоты у женщин, принимающих комбинированные пероральные контрацептивны, отсутствует. Поскольку транексамовая кислота обладает антифибринолитическим эффектом, одновременное применение с комбинированными пероральными контрацептивами может привести к дополнительному повышению риска тромботических осложнений.
Одновременное применение транексамовой кислоты с препаратами факторов свертывания крови II, VII, IX и X в комбинации [протромбиновым комплексом] или антиингибиторным коагулянтным комплексом повышает риск развития тромбоза.
Возможно повышение риска тромботических осложнений (в частности, инфаркта миокарда) при одновременном применении транексамовой кислоты с гидрохлоротиазидом, десмопрессином, ампициллином-сульбактамом, ранитидином и нитроглицерином.
При сочетанном применении с гемостатическими препаратами возможна активация тромбообразования.
Одновременный прием транексамовой кислоты с антикоагулянтами должен проводиться под строгим контролем врача (опыт применения ограничен).
Фармацевтические лекарственные взаимодействия
Раствор транексамовой кислоты совместим с большинством инфузионных растворов (0,9% раствор натрия хлорида, раствор Рингера, 5% раствор декстрозы, растворы аминокислот, декстраны). Раствор транексамовой кислоты совместим с нефракционированным гепарином.
Раствор транексамовой кислоты фармацевтически несовместим с урокиназой, норэпинефрином, дипиридамолом, диазепамом.
Раствор транексамовой кислоты нельзя смешивать с растворами антибиотиков (пенициллины, тетрациклины) и препаратами крови.
Особые указания
Перед началом и в процессе лечения препаратами транексамовой кислоты необходимо проведение консультаций офтальмолога (определение остроты зрения, цветного зрения, состояние глазного дна). При возникновении нарушений зрения на фоне лечения транексамовой кислотой, препарат необходимо отменить.
Препараты транексамовой кислоты следует применять с осторожностью при гематурии, вызванной заболеваниями паренхимы почек, поскольку в этих условиях часто наблюдается внутрисосудистое осаждение фибрина, что может усугубить поражение почек. Кроме того, в случаях массивного кровотечения любой этиологии из верхних мочевыводящих путей, антифибринолитическая терапия повышает риск образования сгустков крови в почечной лоханке и/или мочеточнике и, соответственно, вторичной механической обструкции мочевыводящих путей и развитии анурии.
Хотя проведенные клинические исследования не выявили значительного повышения частоты развития тромбозов, однако риск тромботических осложнений не может быть полностью исключен. Описаны случаи развития венозных и артериальных тромбозов и тромбоэмболии у пациентов, получавших транексамовую кислоту. Кроме того, сообщалось о случаях окклюзии центральной артерии сетчатки и центральной вены сетчатки. У нескольких пациентов развился внутричерепной тромбоз на фоне лечения транексамовой кислотой. Соответственно, у пациентов с высоким риском развития тромбоза (тромбоэмболические осложнения в анамнезе, случаи тромбоэмболии у родственников, верифицированный диагноз тромбофилии) следует применять транексамовую кислоту только в случае крайней необходимости и под строгим врачебным контролем. Перед применением транексамовой кислоты следует провести обследование, направленное на выявление факторов риска тромбоэмболических осложнений.
Наличие крови в полостях, например, в плевральной полости, полостях суставов и мочевыводящих путях (в т. ч. в почечных лоханках и в мочевом пузыре) может приводить к образованию в них «нерастворимого сгустка» вследствие внесосудистого свертывания крови, который может быть устойчив к физиологическому фибринолизу.
Пациенткам с нерегулярным менструальным кровотечением не следует назначать транексамовую кислоту до установления причины дисменореи. Если объем менструального кровотечения неадекватно снижается на фоне лечения транексамовой кислотой, необходимо рассмотреть возможность альтернативного лечения.
Эффективность и безопасность препаратов транексамовой кислоты при лечении меноррагии у пациенток младше 16 лет не установлены.
Следует с осторожностью применять транексамовую кислоту у женщин, одновременно принимающих комбинированные пероральные контрацептивы, в связи с повышенным риском развития тромбозов (См. раздел «Взаимодействие с другими лекарственными средствами»).
У пациентов с ДВС-синдромом, которые нуждаются в лечении транексамовой кислотой, терапия должна осуществляться под тщательным контролем врача, имеющего опыт лечения данного заболевания.
В связи с отсутствием адекватных клинических исследований, одновременное применение транексамовой кислоты с антикоагулянтами должно осуществляться под тщательным наблюдением специалиста, имеющего опыт лечения нарушений свертывания крови.
Если на фоне приема транексамовой кислоты отмечается нарушение зрения, необходимо прекратить прием препарата и обратиться к врачу.
Влияние на способность к управлению транспортными средствами и работе с механизмами
Способность транексамовой кислоты влиять на скорость психомоторных реакций и на способность управлять транспортными или другими механическими средствами не изучалась. Транексамовая кислота может вызывать головокружение и нарушения зрения, и, соответственно, может влиять на способность заниматься потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска
Раствор для внутривенного введения 50 мг/мл. По 5 мл в ампулы из бесцветного стекла первого гидролитического класса.
По 5 ампул в контурную ячейковую упаковку из пленки поливинилхлоридной или в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной или гибкой упаковки на основе алюминиевой фольги.
По 1 или 2 контурные ячейковые упаковки вместе с инструкцией по медицинскому применению лекарственного препарата, скарификатором или ножом ампульным помещают в пачку из картона.
При упаковке ампул с надрезами (насечками) и точками или кольцами излома скарификаторы или ножи ампульные не вкладывают.
Упаковка «для стационаров»
По 20, 50 или 100 контурных ячейковых упаковок с покрытием фольгой вместе с 20, 50 и 100 инструкциями по медицинскому применению лекарственного препарата, скарификаторами или ножами ампульными в коробки из картона или в ящики из картона гофрированного.
При упаковке ампул с надрезами (насечками) и точками или кольцами излома скарификаторы или ножи ампульные не вкладывают.
Условия хранения
При температуре не выше 25° С. Хранить в недоступном для детей месте.
Срок годности
5 лет. Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска
Производитель
Производитель/Фасовщик/Упаковщик
ФГУП «Московский эндокринный завод», Россия
109052, г. Москва, ул. Новохохловская, 25
тел. (495) 234-61-92, факс (495) 911-42-10
Владелец регистрационного удостоверения
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение/ Организация, принимающая претензии
АО «Нижфарм», Россия
603950, г. Нижний Новгород, ул. Салганская, д. 7
Тел.: (831) 278-80-88; факс: (831) 430-72-28
E-mail: med@stada.ru
Адрес аптеки или её название
Другие продукты
Заполните форму «Сообщить о проблеме», чтобы мы связались с вами в самое ближайшее время и помогли!»