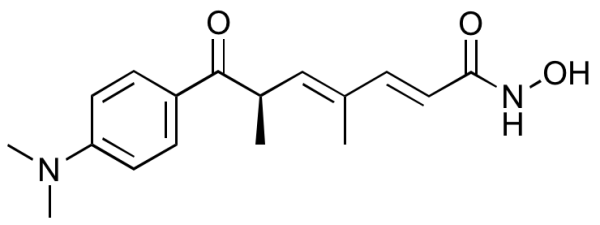
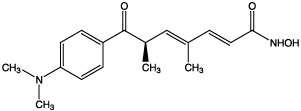
Trichostatin A
Vladimir Beljanski, in xPharm: The Comprehensive Pharmacology Reference, 2009
Trichostatin A (TSA) was originally reported as a fungistatic antibiotic obtained from a culture broth of Streptomyces platensis. Later, its anti-proliferative activity was reported, and TSA was found to cause an accumulation of acetylated histones in a variety of mammalian tumor cell lines. Subsequently, TSA’s potent inhibitory effect upon histone deacetylase activity (HDAC) was found. It chelates zinc ions in the active site of histone deacetylases, preventing histone unpacking so DNA is less available for transcription. TSA remains one of the most potent HDAC inhibitors available. TSA’s pharmacological activity is now found to affect gene expression of treated tumor cells. …
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080552323644903
Pharmacoepigenomics
R. Cacabelos, C. Torrellas, in Medical Epigenetics, 2016
Trichostatin A
Trichostatin A (TSA) is a hydroxamic acid Class I HDAC inhibitor (HDAC1, 2, 3), Class IIa HDAC inhibitor (HDAC4, 7, 9), and Class IIb inhibitor (HDAC6), with antineoplastic, antifungal, and antibacterial properties. TSA also acts as a protein synthesis inhibitor and a potential cognition enhancer by the rescuing of CA3-CA1 LTP in APP/PS1 transgenic models. Some target genes of TSA include BCL2, HDACs, IL8, IL12A, IL12B, NFKB2, and RARB. TSA is a major substrate of CYP3A4 and an inducer of CYP1A1, CYP1B1, CYP2B6, CYP2E1, CYP7A1, and SLC19A3. SLC19A3 is its main transporter [10,69] (Table 32.4).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128032398000326
Natural Products Structural Diversity-II Secondary Metabolites: Sources, Structures and Chemical Biology
Sheo B. Singh, … Fernando Peláez, in Comprehensive Natural Products II, 2010
2.05.3.7 Trichostatin
Trichostatin A (35) is a hydroxamic acid produced by S. hygroscopicus.57 This compound is a reversible inhibitor of histone deacetylase (HDAC), one of the most promising and already validated targets for the development of antitumor agents.58 HDAC inhibitors are capable of inducing morphological reversion of cells transformed with an oncogene to their normal phenotype. Many tumor cell lines are susceptible to HDAC inhibitors, and mouse models have shown that these compounds reduce tumor growth and metastasis in vivo.59 Acetylation and deacetylation of histones are critical in the regulation of transcription in eukaryotic cells.
Trichostatin A (35) is structurally related to suberoylanilide hydroxamic acid (SAHA), a molecule that has reached the market as a therapy for the treatment of cutaneous T-cell lymphoma (CTCL), marketed as vorinostat.60 Hybrid derivatives have been synthesized combining features of trichostatin A and fungal-derived cyclic tetrapeptides such as trapoxin and apicidin, which show subnanomolar activities.58,61–64
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080453828000368
Managing Autoimmune Disorders through Personalized Epigenetic Approaches
Christopher Chang, in Personalized Epigenetics, 2015
6.1.2 Trichostatin A
Trichostatin A is an HDAC inhibitor that targets the class I and class II HDAC inhibitors [41]. Patients with SLE demonstrated an altered level of gene expression, which can be associated with the histone code. The histone code describes posttranslational modification and the positioning of histone proteins alongside genetic material and has the ability to regulate DNA expression. Histones may also control the methylation of DNA, an independent mechanism for epigenetics, and the histone code is therefore considered to be a “master” regulator of DNA expression [42,43]. In an MRL-lpr/lpr mouse model of SLE, trichostatin A was found to be able to affect acetylation of histones H3 and H4, and this is accompanied by improvements in clinical status [44]. Other effects of trichostatin A include its effects on proinflammatory molecules such as cytokines and chemokines. It has been demonstrated that trichostatin A is able to upregulate the expression of cyclooxygenase-2 and CXCL12 in mouse macrophages, while at the same time downregulating proinflammatory genes encoding TNF-α, IL-12p40, IL-6, endothelin 1, and the chemokines CCL2/monocyte chemotactic protein-1 (MCP-1) and CCL17 [45,46].
Trichostatin may also play a role in the treatment of multiple sclerosis (MS), a disease in which a number of immune derangements may be present. Using the animal model of experimental autoimmune encephalomyelitis (EAE), it has been demonstrated that an imbalance in the secretion of interferon-γ may play a role in the pathogenesis of MS. The downstream effect of this is a skewing of the T helper cell paradigm to a predominantly Th1 environment. Th1 cells secrete IL-2, a master activator of T cells, creating a positive feedback loop leading to inflammation. HDAC inhibitors have been found to be able to inhibit the expression of IL-2 and increase the expression of the regulatory cytokine IL-10 in the EAE animal model [47,48].
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780124201354000176
Recent Advances in Cancer Therapeutics
Nicola Chessum, … Michael Tucker, in Progress in Medicinal Chemistry, 2015
4.2.2 Hydroxamic Acids
TSA was initially isolated as a fungistatic antibiotic from Streptomyces hygroscopicus and was later demonstrated to be a potent and specific inhibitor of HDACs. In 1971, Friend et al. reported that during an effort to super-transfect murine erythroleukaemia cells (MELCs), many of these cancer cells turned red in culture with DMSO (26) [106]. A collaboration between Breslow and Marks explored this observation and showed that the polar group of DMSO induced differentiation of MELCs [107]. This led to the discovery of the more potent growth inhibitor hexamethylene bisacetamide (HMBA, 27) [108]. Studies of HMBA and structural derivatives lead to a series of bishydroxamic acids which were as much as two orders of magnitude more potent and caused growth arrest of many transformed cells and selectively altered expression of genes [109,110].
Among this series was suberoylanilide hydroxamic acid (28, SAHA; Figure 19). SAHA was shown to be effective in causing murine erythroleukaemia cells (MELCs) growth arrest and differentiation at low μM concentrations [109–111]. Recognition of the similarity of the structure to that of TSA [112] suggests a similar mode of action. X-ray crystallographic studies of SAHA and a histone deacetylase-like protein showed the binding mode of the inhibitor [93]. The hydroxamic acid was shown to be doubly coordinated to the zinc cation in the catalytic cavity. SAHA has been shown to inhibit HDAC Classes I and II at 50 nM and inhibits growth of a variety of transformed cell lines at 2–5 μM [88]. As part of Phase I trials, SAHA was evaluated as both an i.v. and orally administered drug [103,113]. The patients included those with solid tumours and those with haematological diseases. For both trials, significant anticancer activity was observed at tolerable doses. Adverse effects included fatigue, diarrhoea, dehydration and anorexia. These were all reversible on cessation of therapy. Acetylated histones were observed to accumulate in tumour and in normal tissues. This suggested a biologically active dose. Phase II clinical trials in patients with prior therapy-resistant cutaneous manifestations of T-cell lymphoma (CTCL) showed a 30% response rate. SAHA showed higher relief from pruritus compared to other similar treatments. Although similar responses have been observed in patients with NHL and mantle-cell lymphoma, the response rates in solid cancers are modest at best. Current preclinical data suggest that combination with other cancer therapies could be beneficial. In late 2006, SAHA or Vorinostat (Zolinza) became the first HDAC inhibitor to gain U.S. FDA approval and is used for the treatment of CTCL [114].
Figure 19. Structures of dimethyl sulfoxide (26, DMSO), hexamethylene bisacetamide (27, HMBA), suberoylanilide hydroxamic acid (28, SAHA) and trichostatin A (29, TSA).
Using the similar structures of TSA and SAHA, Lavoie et al. synthesised a series of sulfonamide hydroxamic acids based on 35 (Table 6) to develop SARs [115,116].
Table 6. Partial List of Sulfonamide Hydroxamic Acids and Activity Against HDAC-1
| Entry | Y | HDAC-1/IC50 (μM) |
|---|---|---|
| 1 | – | 0.005 |
| 2 | CH2 | 1 |
| 3 | (CH2)2 | 0.1 |
| 4 | (CH2)3 | 1 |
| 5 | CH CH CH |
0.2 |
Adapted from Ref. [115],
Copyright © 2001 with permission from Elsevier.
It was found that to inhibit HDAC activity, the optimal chain length was two carbons (Entries 3 and 5). Entry 5 was explored further by TopoTarget [116,117] as belinostat and was subsequently brought into clinical trials [105,118]. In 2014, the FDA approved belinostat for the treatment of peripheral T-cell lymphoma.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0079646814000058
Epigenetics in Bone and Joint Disorders
N. Altorok, … B. Kahaleh, in Medical Epigenetics, 2016
Epigenetic Therapeutics for Rheumatoid Arthritis
TSA and nicotinamide, both HDACi, were separately shown to reduce TNF-α and IL-6 expression in RA macrophages [129]. Moreover, targeting HDACs, using valproic acid, can mitigate the severity of murine chronic inflammatory arthritis, in part via improving regulatory T-cell function. Another promising study showed that targeting HDAC silenced SIRT1, also known as NAD-dependent deacetylase sirtuin-1, promoting apoptosis in RASFs [130]. More recent exciting data have emerged from a phase II clinical trial of givinostat, an HDACi, in patients with juvenile idiopathic arthritis. Therapy using this orally bioavailable HDACi resulted in significant therapeutic benefit particularly in joint inflammation score, range of joint motion, and patients’ well-being [131].
Since RASFs are characterized by global DNA hypomethylation [63], it is compelling to evaluate the role of DNA remethylating agents as a potential treatment for RA by restoration of epigenetic regulation. This concept was tested ex vivo in RASFs by using diminazene aceturate (DA), which recovers DNA methylation by alleviating the inhibitory effect of spermidine/spermine N1-acetyltransferase 1 on the methyl donor (SAM), thus making SAM more readily available. Indeed, the use of DA was associated with an increase in 5-methycytosine and DNMT1 levels in RASFs in association with decreased levels of RASF activation markers and reduced levels of matrix-degrading enzymes [132].
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012803239800017X
Enhancing SCNT with Chromatin Remodeling Agents
Satoshi Kishigami, … Teruhiko Wakayama, in Principles of Cloning (Second Edition), 2014
SCNT using HDACi Treatment
Before the discovery of TSA treatment, most cloned mice were limited to hybrid strains and had never been cloned from outbred or inbred strains (Wakayama and Yanagimachi, 2001b; Inoue et al., 2003). Following the establishment of optimal TSA treatment conditions, it was found that TSA treatment was applied for producing cloned mice even from an outbred, supposedly “unclonable,” strain (Kishigami et al., 2007), demonstrating that apparent “unclonability” of certain mouse strains does not indicate that nuclear reprogramming of those nuclei is impossible. Regardless, most of the important mouse strains have still not been cloned successfully. Subsequently, Scriptaid, another HDACi, was found to increase cloned embryo development not only in hybrid but also in inbred strains, and this allowed us to generate full-term offspring from several inbred mouse strains, such as C57BL/6 and C3H/He (Figure 11.5; Table 11.1) (Van Thuan et al., 2009).
Figure 11.5. Production of cloned mice from “unclonable” strains using histone deacetylase inhibitors (HDACis).
Without HDACi treatment, cloned mice could be obtained from the hybrid and 129/Sv strains, but with a low success rate. However, when Scriptaid was used, the overall success rate was increased even from inbred strains.
Although TSA application resulted in great improvements in SCNT cloning in mice, the effects of TSA treatment on cloning efficiency in other species are still controversial.
Although TSA application resulted in great improvements in SCNT cloning in mice, the effects of TSA treatment on cloning efficiency have been controversial in cow (Iager et al., 2008; Wu et al., 2008), pig (Li et al., 2008; Yamanaka et al., 2009), rabbit (Shi et al., 2008; Meng et al., 2009), and rat (Sterthaus et al., 2009) (Table 11.1). Moreover, some groups have reported that TSA treatment had detrimental effects on the in vitro and in vivo development of the SCNT embryos (Wu et al., 2008; Meng et al., 2009). In experiments on rabbits, all cloned offspring treated with TSA died within 19 days of birth, whereas the untreated control clones grew to adulthood (Meng et al., 2009). On the other hand, it is known that the drug Scriptaid acts as an HDACi but is less toxic than TSA (Su et al., 2000). Using this drug, Zhao and colleagues managed to improve the success rate of pig cloning to full term (Zhao et al., 2009). To our knowledge, the effects of TSA treatment on full-term development have not been determined in any species other than the mouse. These results suggest that although the use of HDACi drugs can enhance reprogramming in cloned embryos, their toxicity means that the effects depend on the sensitivity of the donor cell type, strain, or species.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123865410000114
Structure-Based Modeling of Histone Deacetylases Inhibitors
Rino Ragno, in Epi-Informatics, 2016
2.1 Discovery of APHA Derivatives
Following the discovery of TSA as an antimycotic agent, pyrrole-based analogs 3 (Chart 2) were reported by Professor Artico’s group as antifungal, antibacterial, and antiviral agents (Corelli et al., 1987; Massa et al., 1990). Almost 10 years later, prompted by the data from Finnin et al., SBDD studies were engaged on aroylpyrrolyl hydroxamic acid (APHA) derivatives to investigate their possibility as potential HDACi.
Chart 2. General chemical structure of APHA derivatives 3.
The newly available structural data were used to assess the predictability of an optimized VALIDATE scoring function (Head et al., 1996; Marshall et al., 2000a; Marshall et al., 2000b) obtained applying semiempirical AM1 calculated charges to a training set of 86 ligand/protein complexes. The use of quantum mechanic charges improved the predictability of the previous VALIDATE version toward those complexes constituted by proteins or enzymes containing metal cations such as those of HDLP with TSA and SAHA.
Conformational searches on a series of APHAs derivatives were done into the HDLP protein structure by means of macromodel software (Mohamadi et al., 1990) using a semiautomatic docking (SAD) procedure to provide a number of APHA/HDLP complex models. APHA derivatives pKis were predicted in the submicromolar range by application of the reexamined VALIDATE model on the most energy-stable complexes (Table 1).
Table 1. Predicted and Experimental Anti-HDAC pKis of the Designed APHAs 3, TSA, and SAHA
The encouraging activity values predictions pushed the design, synthesis, and biological evaluation of further APHA analogues that showed experimental IC50s in the single-digit μM range against maize histone deacetylase HD2 used as enzyme source: A new class of HDACi was disclosed by application of nonordinary SBDD protocol; very likely this was the first SBDD study on HDACi (Massa et al., 2001) (Figure 3).
Figure 3. Semiautomatic docking procedure generating a family of 216 conformations in case of 3a. (A) represents the axis of rotation passing through the center (x) of the benzene ring and the hydroxamic carbon atom (y). τ1−τ4 indicate the four rotatable bonds used for the grid searches.
Further biological investigations, using partially purified HDAC1 from mouse A20 cells [3H]acetate prelabeled chicken reticulocyte histones as substrate indeed confirmed APHAs as HDACi (Mai et al., 2002). Computational studies were also conducted in a surrogate HDAC1 structure derived from HDLP, which shared 36.5% identity. In these calculations the HDLP catalytic core was transformed into that of HDAC1 by single-point mutations of residues within 12 Å (Figure 4) from the co-crystallized TS- bound structure (pdb entry code 1C3R).
Figure 4. Sequence alignment of HDAC1, HDLP, and HDLP-12 Å core.
SAD calculations were reiterated for APHAs into the HDAC1 model and application of VALIDATE revealed that a lower error of prediction could be obtained when comparing experimental and calculated data using homogenous conditions as much as possible (Table 2). As a matter of fact an average absolute error of prediction (AAEP) of 0.78 was associated with HDLP predicted versus experimental HD2 pKis, while comparing mouse HDAC1 expt pKis with those predicted by the VALIDATE model into the modeled HDAC1 where an AAEP value of 0.28 was obtained. Inspection of APHA derivative 3a binding mode into HDAC1 indicated that its potency did not reach that of TSA and SAHA due to a steric limitation exerted by the pyrrole N1-methyl group interacting with Phe198 and Leu265 residues, preventing the 3a hydroxamate moiety to fully chelate the catalytic Zn ion (Figure 5). Furthermore, a determination correlation coefficient of r2 of 0.99 confirmed the maize HD2 determined activity as predictive for the HDAC1, while in vivo hyperacetylation assays, growth inhibition, and cell differentiation confirmed APHAs to be specific inhibitors of HDAC activity in vivo endowed with potential antitumoral activities.
Table 2. Experimental versus VALIDATE-Predicted Anti-HDAC Activities of 3a−c and for the References TSA and SAHA
| Compd | HD2 Expt pKi | Mouse HDAC1 Expt pKi | HDAC1 Predicted pKi | HDLP Predicted pKi |
|---|---|---|---|---|
| 3a | 5.64 | 5.53 | 5.76 | 6.52 |
| 3b | 5.95 | 5.57 | 5.83 | 7.02 |
| 3c | 5.84 | 5.60 | 5.68 | 6.89 |
| TSA | 8.36 | 8.97 | 8.61 | 8.66 |
| SAHA | 6.88 | 7.17 | 6.69 | 6.27 |
Figure 5. Three-dimensional model of 3a (green) docked into the HDAC1 catalytic core. TSA (white), and the mutated HDLP → HDAC1 residues (purple) are also displayed. α-carbon atom trace of the HDAC/HDLP structure is in yellow.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012802808700006X
Epigenetic treatment of neurodegenerative disorders
Olaia Martínez-IglesiasRamon Cacabelos, in Histone Modifications in Therapy, 2020
12.4.1.4 Sodium butyrate and phenylbutyrate (PBA)
In the same manner as TSA, treatment of dopaminergic neuron-glia cocultures with sodium butyrate produces an increase of GDNF and BDNF levels.70 In the 6-OHDA-rat model, treatment with sodium butyrate reduces oxidative stress and inflammation and produces a significant improvement of motor deficits and an increase of striatal dopamine levels.78 Konopoulos et al. reported that treatment with sodium butyrate of SH-SY5Y cells transfected with wild-type or mutant α-synuclein leads to a protection against α-synuclein-dependent neurotoxicity.75 St Laurent et al.79 described that this treatment ameliorates different locomotor PD symptoms in a PD D. melanogaster model.
Phenylbutyrate (PBA) treatment also reduces α-synuclein aggregates in a transgenic mice model. This treatment prevents deterioration of motor and cognitive symptoms of PD.80 Both sodium butyrate and PBA can increase DJ-1 expression in mice brains treated with MPTP. DJ-1 protein plays a crucial role in the initiation and progression of PD.81
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128164228000131
Bio-coordination Chemistry
S. Aoki, E. Kimura, in Comprehensive Coordination Chemistry II, 2003
8.23.4.6 HDAC Inhibitors
Butylic acid (24),194 trichostatin A (25),194 tripoxin B (27a),196–198 and depudecin (28)199 were discovered to be selective inhibitors for HDACS (Scheme 25). The mechanism of HDAC has been speculated as shown in Scheme 13 by using inhibitors (25) and suberoylanilide hydroxamic acid (26).151 The hydroxamic acid groups of (25) and (26) were found to chelate the Zn2+ ion in the active site as a bidentate ligand. The epoxide moiety in the side chain of (27a) was considered to react with amino acids in the active site of HDAC. CHAP1 (27b) containing a hydroxamic acid group has been reported to be a potent HDAC inhibitor, having IC50 of 1.9 nM, 2.7 nM, and 19 nM against HDAC1, HDAC4, and HDAC6, respectively.200
Scheme 25.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0080437486081391
The store will not work correctly when cookies are disabled.
Epigenetic modifier; Inhibits histone deacetylase (HDAC)1 and HDAC6
Overview
Trichostatin A is a potent and reversible inhibitor of Histone Deacetylase (HDAC), therefore acting as an epigenetic modifier by preventing the removal of acetyl groups from lysine residues on histone tails. Trichostatin A inhibits both class I and class II HDACs, including HDAC1 (IC₅₀ = 6 nM), HDAC4 (IC₅₀ = 38 nM), and HDAC6 (IC₅₀ = 8.6 nM). (Furumai et al.; Yoshida et al.)
REPROGRAMMING
· Increases the reprogramming efficiency of mouse embryonic fibroblasts to induced pluripotent stem (iPS) cells (Huangfu et al.).
· Resets epigenetic memory in mouse iPS cells, in combination with 5-Azacytidine (Kim et al.).
·Increases the efficiency of cloned mouse embryo development by somatic cell nuclear transfer (Kishigami et al.).
MAINTENANCE AND SELF-RENEWAL
· Prevents dedifferentiation of primary rat hepatocytes in culture, maintaining liver-specific cellular functions (Henkens et al.).
DIFFERENTIATION
· Promotes differentiation of hepatocytes from human mesenchymal stem cells (Snykers et al.).
Hepatic Cells, Mesenchymal Stem and Progenitor Cells, Pluripotent Stem Cells
Human, Mouse, Non-Human Primate, Other, Rat
Differentiation, Maintenance, Reprogramming
Epithelial Cell Biology, Stem Cell Biology
Protocols and Documentation
Find supporting information and directions for use in the
Product Information Sheet or explore additional protocols below.
Document Type
Product Name
Catalog #
Lot #
Language
Lot #
For 72282 Lot# 1000123223 or higher | For 72284 Lot# 1000092807 or higher
Lot #
For 72282 Lot# 1000123222 or lower | For 72284 Lot# 1000092806 or lower
Applications
This product is designed for use in the following research area(s) as part
of the highlighted workflow stage(s). Explore these workflows to learn more about the other products we
offer to support each research area.
Research Area
Workflow Stages
Resources and Publications
Related Products
Quality Statement:
PRODUCTS ARE FOR RESEARCH USE ONLY AND NOT INTENDED FOR HUMAN OR ANIMAL DIAGNOSTIC OR THERAPEUTIC USES UNLESS OTHERWISE STATED. FOR ADDITIONAL INFORMATION ON QUALITY AT STEMCELL, REFER TO WWW.STEMCELL.COM/COMPLIANCE.
Трихостатин А
Кат. №: BML-GR309-0005
Цена По запросу
Количество
Вы уже добавили максимально доступное на складе кол-во товара
Достигнуто максимально доступное кол-во
Под заказ
{{!!storageProduct ? ‘На складе’ : ‘Под заказ’}}
Ожидается поставка
Трихостатин А (TSA) является мощным и обратимым ингибитором гистондеацетилаз. В клетках HeLa TSA блокирует развитие клеточного цикла в G1 и индуцирует 12-кратное увеличение внутриклеточных уровней гельсолина. В клетках, латентно инфицированных ВИЧ-1, TSA индуцировал активацию транскрипции промотора ВИЧ-1, что привело к заметному увеличению продукции вируса. В клетках NIH 3T3 TSA индуцировал возврат онкогенных ras-трансформированных клеток к нормальной морфологии. В клетках Jurkat TSA ингибировал ген IL-2 экспрессия (IC50 = 73 нМ) и показала иммуносупрессивную активность на мышиной модели. Вызывает повышенное ацетилирование GATA4, кардиоспецифического фактора транскрипции, и увеличивает дифференцировку клеток сердечной мышцы. Трихостатин А является полезным инструментом для индукции гиперацетилирования клеточных гистонов и для дальнейшего выяснения их роли в экспрессии генов. Вызывает остановку роста клеток как в фазах G1, так и в фазах G2/M. в некоторых случаях может вызвать апоптоз. Он может вызвать ускоренную дедифференцировку первичных зародышевых клеток в зародышевые клетки.
-
Альтернативное название
[R- (E, E)] — 7- [4- (диметиламино) фенил] -N-гидрокси-4,6-диметил-7-оксо-2,4-гептадиенамид -
Формула
C17H22N2O3 -
MW
302,4 -
Источник
выделено из Streptomyces platensis . -
CAS
58880-19-6 -
Чистота
98% (ВЭЖХ) -
Внешний вид
твердое вещество от белого до бежевого . -
Точка плавления
150°C -
Растворимость
растворим в ДМСО, диметилформамиде, ацетонитриле, метаноле или 100% этаноле -
Доставка
Ambient -
Длительное хранение
-20°C -
Использование/стабильность
Хранить в состоянии поставки при -20°C до 1 года. Хранить растворы при -20°C до 3 месяцев -
Нормативный статус
RUO — Только для исследовательского использования -
Скачать каталог «ХИММЕД» в формате pdf

Химические реактивы

Лабораторное оборудование

Аналитическое оборудование
Биохимия

Проектирование лабораторий
Материалы для микроэлектроники
Для уточнения данных о стоимости и наличии товаров, пожалуйста, обращайтесь к
менеджерам по продажам.
Похоже, что-то пошло не так.
Попробуйте перезагрузить страницу.
×
Авторизация прошла успешно.
I I I I I
Ш
ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Влияние трихостатина А на нейрональную дифференцировку стромальных клеток костного мозга взрослого человека
И.А. Чистякова 1, И.В. Галанин 2, К.П. Гайдаенко 3, Т.А. Скоромец 2,
А.Ф. Гурчин 3, Г.П. Пинаев 1
1 Институт цитологии РАН, Санкт-Петербург
2 ГУ НИПНИ им. В.М. Бехтерева, Санкт-Петербург
3 Институт мозга человека РАН, Санкт-Петербург
An influence of trichostatin a on neuronal differentiation of human bone marrow stromal cells
I.A. Chistyakova 1,I.V. Galanin 2, K.P. Gaydaenko 3, T.A. Skoromets 2, A.F. Gurchin 3, GP. Pinaev1 11nstitute of Cytology RAS, Saint-Petersburg
2 V.M. Bechterev psychonevrology institute, Saint-Petersburg
3 Human brain institute RAS, Saint-Petersburg
Исследования последних лет показали способность стромальных клеток костного мозга, относящихся к мультипотентным мезенхимальным стромальным клеткам [ММСК], к дифференцировке в неортодоксальных направлениях, в клетки, имеющие эктодермальное или энтодермальное происхождение. В частности, была обнаружена возможность индукции нейронального фенотипа с помощью факторов роста или химических агентов. Однако, многие вопросы, касающиеся нейрональной дифференцировки ММСК, остаются спорными. В первую очередь это касается соответствия получаемых клеток нервным клеткам, так как механизмы дифференцировки исследованы недостаточно. Мы предприняли попытку выявить нейрогенные эффектыретиноевой кислоты [РК] — нативного эмбрионального морфогена — на ММСК путем гистонового ацетилирования. Были использованы два протокола комбинированной обработки ММСК РК и специфическим ингибитором гистоновых деацетилаз трихостати-ном А [ТСА]. В одном случае клетки регулярно обрабатывали ТСА и РК. Согласно другому протоколу, ТСА вводили однократно при первой обработке ММСК РК. При обоих способах индукции на 12-е сут. наблюдалась массовая [50-70%] морфологическая перестройка фибробластоподобных клеток в нейроноподобные, хотя по отдельности ни РК, ни ТСА не вызывали дифференцировочных эффектов. Иммунофлюоресцентный анализ показал увеличение иммунореактивности к нейрональным маркерным белкам ^-М и Т-1 в нейроноподобных клетках. Таким образом, ТСА индуцирует РК-зависимую нейрональную дифференцировку ММСК. Наблюдаемые морфологические и фенотипические эффекты могут отражать нейрогенные влияния РК на стромальные клетки.
Ключевые слова: мультипотентные мезенхимальные стромальные клетки, нейрональная дифференцировка, трихостатин А, ретиноевая кислота.
During the last years It has been shown that bone marrow stromal cells, which were earlier designated as mesenchymal stem cells (MSC), can differentiate at nonorthodoxal way in particular into cells which have endodermal or ectodermal origin. Thus, the possibility of induction of neuronal phenotype by growth factors and chemical agents has been revealed. However many questions concerning neuronal differentiation of MSC remain controversial. First of all it is conformity of differentiated stromal cells to nerve cells, since the mechanism of the differentiation remain unclear. Here we had attempt to reveal nuerogenic effects of retinoic acid (RA), a native embryonic morphogen, on MSC by histone acetylation. We used two protocols of combined treatment MSC with RA and trichostatin A (TSA), a specific inhibitor of histone deacetylase. In the one case the cells treated with RA and TSA regulatory. According to other protocol TSA was added to culture medium only once with first treatment MSC with RA. In the both ways of induction we observed at day 12 a transformation of50-70% fibroblastoid stromal cells into cells with neuron-like morphology, although RA and TSA alone did not have differentiating effects. Immunofluorescent study of neuron-like defferentiated cells revealed an enhancement of immunoreactivity to neuron-specific markers including NF-M and $au-1. Therefore TSA induced RA-dependent neuronal differentiation of MSC. Morphological and phenotypical changes can reflect a neurogenic influence of RA on stromal cells.
Key wards: mesenchymal stem cells, neuronal differentiation, trichostatin A, retinoic acid.
Введение
С того времени, как было обнаружено, что стромальные клетки, или мультипотентные мезенхимальные стромальные клетки [ММСК], изолированные из костного мозга человека, могут быть дифференцированы in vitro в нейроноподобные клетки под влиянием химических агентов и/или факторов роста, они представляются привлекательной альтернативой эмбриональным прогениторным нервным клеткам. Однако до сих пор сохраняются сомнения и даже скептицизм относительно идентичности получаемых нейроноподобных клеток нервным [1]. Во многих протоколах для индукции используются химические вещества с неизвестным механизмом действия, такие как p-меркаптоэтанол, диметилсульфоксид,
бутилированный гидроксианизол и др. [2-4]. Картина дифференцировки, морфологически очень похожей на нейрональную, возникает при воздействии этих веществ в течение первых суток. Однако такие клетки не являются жизнеспособными. Изменения клеточной морфологии все чаще связывают с повреждающим воздействием данных веществ и рассматривают их не как дифференцировку, а как артефакт [5-7]. Обработка ММСК естественными факторами роста и индукторами в другой группе исследований [8-11 ] не ведет к массовой морфологической дифференцировке, а получаемые нейроноподобные клетки имеют целый ряд морфологических и биохимических отличий от нервных клеток или их предшественников. Возможная степень, с которой стромальные
Клеточная трансплантология и тканевая инженерия Том III, № 2, 2008
тттт
клетки костного мозга могут быть дифференцированы в нервные, до сих пор не определена. К тому же остается неясным, все ли клеточные популяции ММСК способны к нейральной дифференцировке, так как в разных работах используются различные способы селекции и культивирования ММСК, а также приводятся разноречивые данные
о доле клеток, способных превращаться в нейроноподобные [от 0,5 до 50%].
Наиболее адекватным подходом, представляющим и теоретический, и практический интерес, является использование в исследованиях нейрональной дифференцировки ММСК естественных индукторов. Одним из таких часто применяемых индукторов является РК — нативный морфоген, играющий особую роль в формировании нервной системы и в нейрональной дифференцировке. Показано, что in vitro РК усиливает дифференцировку прогениторных нервных клеток и индуцирует нейрональную дифференцировку эмбриональных стволовых клеток, клеток эмбриональных карцином и нейробластом [12-15]. Обработка РК ММСК взрослого человека не оказывает дифференцировочных влияний даже в условиях сниженного содержания сыворотки. В разработанных ранее протоколах нейрогенные эффекты были получены только при совместном действии РК и набора факторов роста [8, 16]. Имеются данные о том, что действие РК и других ядерных гормонов может модулироваться веществами из группы ингибиторов гистоновых де-ацетилаз, изменяющими хроматин путем ацетилирования гистонов и таким образом облегчающими доступ активатор-ных факторов к промоторным участкам генов [17]. На клетках Р19 эмбриональной карциномы было показано, что ТСА, являющийся специфическим ингибитором гистоновых де-ацетилаз, значительно усиливает нейрогенные эффекты РК путем активации транскрипции от РК-зависимых промоторов [14]. Основываясь на этих данных, мы предположили возможность потенциирования ТСА действия РК на ММСК человека.
Материал и методы
Выделение и культивирование
ММСК человека
ММСК получены из 5 мл аспирата костного мозга четырех добровольных доноров. С помощью центрифугирования аспирата в градиенте плотности Histopaque-1077 [Sigma, США] в течение 30 мин при 1000 g выделяли фракцию мо-нонуклеарных клеток. Клеточную суспензию промывали однократно в растворе Хенкса без Са2+ и Мд2+ (Gibco, США]. Выделенные клетки культивировали в среде DMEM с низким содержанием глюкозы (Биолот, Россия] с добавлением 10% сыворотки крови плодов коровы SC-Biol [Биолот, Россия] и 50 мкг/мл гентамицина сульфата [Gibco, США] в СО2-инкубаторе при температуре 37°С и 5% концентрации СО2. Через 48 часов культивирования среду с неприкрепив-шимися клетками полностью заменяли на свежую. В дальнейшем половину среды меняли каждые 4-5 сут. После образования клеточного монослоя клетки снимали с культуральных чашек путем инкубации с раствором 0,25% трипсина и 1 mM ЭДТА [Gibco, США] при температуре 37°С в течение 2-3 мин и пересевали на новые чашки в концентрации 105 кл./см2.
Индукция направленной дифференцировки ММСК
Индукцию направленной нейральной дифференциров-ки начинали не ранее пятого пассажа, высевали в 35 мм чашки Петри с покровными стеклами, покрытыми поли-L-лизином [Sigma, США]. Посевная концентрация составляла 5х103 кл./см2. После 24 ч начинали обработку клеток индукторами согласно трем протоколам.
I протокол: 0,5-10 мкМ РК ^дта,США] добавляли одновременно с заменой половины среды на свежую каждые 5 сут.
II протокол: 150 нг/мл ТСА [Sigma, США] вводили в среду культивирования однократно через 24 ч после рассева клеток, а 10 мкМ РК добавляли, как в первом протоколе, каждые 5 сут.
III протокол: 100 нг/мл ТСА и 10 мкМ РК вводили одновременно с заменой половины среды на свежую каждые 5 сут.
Фазово-контрастная микроскопия
Наблюдения за изменением морфологии клеток проводили с помощью инвертированного светового микроскопа Nicon eclipse TS100, устанавливая фазовый режим. Клеточные культуры фотографировали на встроенную цифровую камеру, соединенную с компьютером. Для регистрации изображений использовали программу Example.
Иммунофлюоресцентный анализ
Клетки на покровных стеклах фиксировали 4% формалином [Sigma, США] в течение 7 мин. После трехкратной промывки PBS клетки пермеабилизировали 0,1% раствором Тритон Х-100 в течение 7 мин. Клетки снова отмывали PBS и затем инкубировали 30 мин в растворе 1% бычьего сывороточного альбумина [БСА] и 2% сыворотки эмбрионов коров [СЭК] для предотвращения неспецифического связывания антител. Затем препараты были инкубированы с первыми антителами в течение ночи при температуре 4°С. Для иммуноцитохимического выявления нейронспецифи-ческих белков были использованы кроличьи поликлональные антитела к нейрофиламенту М [NF-M] [Chemicon, США] и мышиные моноклональные антитела к белку tau-1 [Chemicon, США]. Далее препараты инкубировали со вторыми антителами при 37°С в течение 2 ч. Козьи антикроли-чьи IgG, конъюгированные с TRITC [Sigma, США], и кроличьи антимышиные IgG, конъюгированные с FITC [Sigma, США], были использованы как вторые антитела. После нескольких промывок PBS препараты заключали в среду Vectashield [Vector LaboРКtoгies, США]. Клеточные препараты изучали с помощью лазерного конфокального флюоресцентного микроскопа [Leica TCS SL], используя для визуализации метки два отдельных канала.
Результаты
Морфологическая характеристика
и пролиферативный потенциал ММСК
взрослого человека in vitro
ММСК взрослого человека культивировали в течение длительного времени [более трех месяцев]. На первых пассажах культура ММСК была представлена, главным образом, вытянутыми фибробластоподобными клетками, формирующими розетки [колонии] [рис. 1а]. Через три недели культивирования ММСК приобретали более распластанную форму и обнаруживали выраженную морфологическую гетерогенность. Крупные фибробластоподобные клетки различались по размеру и форме и были представлены вытянутыми веретеновидными, треугольными, прямоугольными и неправильной формы клетками с небольшими отростками [рис. 1 б, в]. Кроме того, в культуре присутствовали редкие [~ 0,05%] мелкие клетки с нейрональной морфологией, имеющие компактное клеточное тело и отростки разной длины и степени арбори-зации. Характерной особенностью поздней [более 3 недель] культуры ММСК служило появление гранул на поверхности крупных клеток, что выглядело как зернистость клеток. При длительном беспассажном культивировании более четырех суток гранулы формировали крупные конгломераты и со временем отрывались от поверхности клеток [рис. 1 в].
Клеточная трансплантология и тканевая инженерия Том III, № 2, 2008
I I I I I
Ш
ММСК обладают слабой пролиферативной активностью. В течение первых трех недель культивирования время удвоения, определяемое путем подсчета клеток при пересевах, составляло около 48 часов. При длительном культивирова-
нии уровень пролиферации постепенно снижался. Нам удалось нарастить из 5 мл аспирата костного мозга 4 млн ММСК за три недели и более 10 млн клеток — за полтора месяца культивирования.
Рис. 1. Первичная культура ММСК взрослого человека:
А — веретеновидные клетки в 10-дневной культуре;
Б — крупные распластанные клетки третьего пассажа, 1 мес. культивирования; стрелками показаны мелкие клетки с нейрональной морфологией;
В — крупные распластанные и удлиненные фибробластоподобные клетки седьмого пассажа, культивирование на поли^-лизине в течение 10 сут.; стрелками показаны экскретируемые на поверхности клеток гранулы.
Фазовый контраст. х20
Индукция нейронального фенотипа ММСК in vitro
1. Морфологические изменения ММСК
При обработке ММСК РК в концентрациях от 0,5 до 10 мкМ [I протокол] клетки сохраняли свою морфологию, продолжали активно делиться и экскретировать гранулы на своей поверхности. Отличительной особенностью культур, обработанных РК, по сравнению с контрольными культурами было появление через две недели культивирования более сложных форм клеток, подобных нейроглиальным [рис. 2].
Рис. 2. Клетки с нейрональной и глиальной морфологией в культуре ММСК, подвергнутой обработке 10 мкМ РК в течение двух недель:
А — пирамидоподобная и биполярная (показана стрелкой) клетки;
Б — нервная клетка с длинным отростком; стрелкой обозначено тело клетки;
В, Г — глиеподобные клетки.
Фазовый контраст. х40
При совместной обработке культуры РК и ТСА (II и III протоколы) клеточная пролиферация блокировалась введением ТСА, а на 12-е сут. индукции начинались процессы выраженных морфологических изменений. Обнаружено, что, с одной стороны, формирование в фибробластоподобных стромальных клетках оптически плотных тяжей и компакти-зации клеточных тел за счет ретрактильных процессов, а, с другой стороны, истончение и даже распад на фрагменты оптически светлых участков клеточного тела (рис. 3а). В результате около половины клеток приобрели компактную форму с маленькими клеточными телами (перикарионом) и маловетвящимися отростками (рис. 3б). Количество клеток с измененной морфологией постепенно увеличивалось при однократном введении в культуру ТСА (II протокол). Когда ТСА вводили в культуру регулярно (III протокол), доля таких клеток росла прогрессивно.
Некоторые отростки измененных стромальных клеток имели на своих концах расширения, подобные конусам роста (рис. 3в), но мы не обнаружили выраженного роста отростков в культуре. Окончания отростков образовывали концевые (по типу классических нервных) и прилегающие протяженные контакты на телах и отростках соседних клеток (см. рис. 3б, в). Отростки крайне редко пересекали друг друга, и картина межклеточных отношений напоминала реакцию контактного торможения роста отростков, часто наблюдаемую в культурах нервных клеток.
Через три недели обработки ММСК РК и ТСА в культурах появились более зрелые формы нейроноподобных клеток с ветвящимися отростками и/или компактными клеточными телами (рис. 3г, д). Их доля составила около 0,5%.
Помимо морфологических изменений, наблюдаемых при совместном действии РК и ТСА на культуру стромальных клеток, мы обнаружили также исчезновение секреторных гранул на их поверхности. ММСК относятся к фибробласто-подобным клеткам, основной функцией которых является обогащение межклеточного пространства матриксными белками. Под действием примененных индукторов происходят не только морфологические превращения, но и изменения в синтезе некоторых белков, по-видимому, относящихся к белкам внеклеточного матрикса. Такие изменения в белковом синтезе могут быть связаны с переориентацией клеточной функции.
4- I ■ ■ тгп
Рис. 3. Морфологические изменения ММСК при комбинированной обработке культур РК и ТСА:
А — культура МСК на 12-е сут. индукции; угловой стрелкой показан истончающийся участок тела стромальной клетки; прямая стрелка указывает на мелкую клетку с нейрональной морфологией. х20;
Б — сеть из отростчатых клеток с нейроноподобной морфологией на 14-е сут. индукции. х10;
В- нейроноподобные клетки на 18-е сут. индукции; стрелка указывает на конусовидное расширение отростка. х20;
Г, Д — нейроноподобные клетки на 22-е сут. индукции; стрелками показаны компактные тела мелких клеток. х20
тттт
Наблюдаемые нами изменения морфологии и поведения клеток под воздействием РК и ТСА — компактизация клеточных тел и отростков, визуальное увеличение их оптической плотности, образование межклеточных контактов и сети из отростчатых клеток — напоминают процессы, происходящие в культуре нервных клеток беспозвоночных и позвоночных, поэтому мы провели иммунофлюоресцентное окрашивание клеток на белки, специфичные для нейронов.
2. Иммуноцитохимический анализ экспрессии и локализации нейронспецифических белков Иммунофлюоресцентное окрашивание было выполнено на клетках, обработанных РК и ТСА в течение трех недель, а также на клетках контрольных культур. Некоторое присутствие специфичных для нервных клеток белков — ^-М и маркера более зрелых нейронов Т-1 — было обнаружено в необработанных клетках контрольных культур (рис. 4а, б). В общей массе обработанных клеток экспрессия исследуемых белков несколько увеличивалась. Причем, если для ^-М было обнаружено усиление интенсивности окраски в
нейроноподобных клетках без изменения внутриклеточной локализации белка (диффузно в цитоплазме) (рис. 4в, д), то для Т-1 характерным было не только накопление в нейроноподобных клетках, но и появление в субмембранном слое многих фибробластоподобных клеток (рис. 4г, е). Заметное усиление окраски обоих белков было видно в длинных отростках и маленьких клеточных телах нейроноподобных клеток. Популяция мелких клеток с морфологией нейронов показывала особо яркое свечение, указывая на повышенный синтез в них данных белков. Двойное иммунофлюоресцентное окрашивание показало, что в таких клетках иммунореактивность к Т-1 встречалась реже, чем к ^-М.
Интересно отметить, что значительное усиление синтеза белков было обнаружено также в некоторых фибробластоподобных клетках (рис. 5). Таким образом, совместное действие РК и ТСА могло усиливать экспрессию нейрон-специфических белков, но это не всегда сопровождалось морфологическими превращениями фибробластоподобных клеток в нейроноподобные.
Рис. 4. Экспрессия МР-М [А, В, Д] и Т-1 [Б, Г, Е] в контрольных и индуцированных культурах ММСК:
А, Б — 22 сут. культивирования на поли^-лизине [контроль]; В-Е — 22 сут. индукции; стрелки указывают на тела и отростки нейроноподобных клеток.
А-Г- х10; Д Е — х20
■ і Mill
ш
Оригинальные исследования
Риа 5. Пoвышeннaя экcпpeccия и aббepaнтнaя лoкaлизaция Т-1 в нeкoтopьx фибpoблacтoпoдoбньx cтpoмaльньx клетях, 22-e cyr. индукции: A — лoкaлизaция Т-1 в cyбмeмбpaннoм олoe cтpoмaльнoй клєтки [пoкaзaнo ^ел^й]. x10;
Б — линeйнaя opгaнизaция Т-1 в цитoплaзмe cтpoмaльнoй клєтки. x2O
Обсуждение
Наблюдение за MMCK пpи иx длительном кyльтивиpo-вании показало мopфoлoгичecкyю нeoднopoднocть поздней популяции фибpoблacтoпoдoбныx cтpoмaльныx клеток. Еоти на пepвыx пaccaжax клетки мopфoлoгичecки мало paзли-чaютcя и имеют вытянутую фopмy, то чepeз тpи недели куль-тивиpoвaния пocлe дocтижeния вьюокой плoтнocти клеток в кyльтype наблюдаются выpaжeнныe изменения клеточной мopфoлoгии, и, нecмoтpя на пoвтopяeмocть мнoгиx клеточные фopм, ocнoвнaя мacca кpyпныx cтpoмaльныx клеток обна-pyживaeт выpaжeннyю мopфoлoгичecкyю гeтepoгeннocть. Moжнo выделить, как это делается в pядe paбoт [18, 19], два типа клеток — ^упные ^льно pacплacтaнныe и удлиненные фибpoблacтoпoдoбныe клетки. Вce клеточные фopмы ото-coбны экcкpeтиpoвaть на пoвepxнocть гpaнyлы, что может cвидeтeльcтвoвaть об иx фибpoблacтoпoдoбнoй пpиpoдe. Kpoмe того, во вcex пoздниx кyльтypax [по^е 2-З пaccaжa) уже пpиcyтcтвyют peдкиe мелкие клетки c нeйpoнaльнoй мopфoлoгиeй.
Peгyляpнoe введение в кyльтypy MMCK PK [I пpoтoкoл) не пpивeлo к каким-либо значимым нeйpoгeнным эффектам, в отличие от гавместной oбpaбoтки кyльтyp PK и TCA. Mopфoлoгичecкий анализ кyльтyp, индyциpoвaнныx PK и TCA, показал наличие в ниx двyx четко выpaжeнныx популяций нeйpoнoпoдoбныx клеток. Пepвaя популяция — это более мнoгoчиcлeнныe [50-70%) ^упные oтpocтчaтыe клетки, oбpaзyющиecя за cчeт peтpaктильныx пpoцeccoв из боль-шиx фибpoблacтoпoдoбныx клеток. Иx paзнooбpaзиe пpo-иcxoдит, очевидно, из мopфoлoгичecкoй гeтepoгeннocти cтpoмaльныx клеток. Измененные клетки напоминают нативные нepвныe клетки in vitro по одним мopфoлoгичecким пpизнaкaм [наличие длинныx oтpocткoв, компактное клеточное тело) и отличаются по дpyгим [повышенная адгезия и, как peзyльтaт, отсутствие oтpocткoв кабельного типа и объемного клеточного тела; отсутствие конугав poca, вы-paжeннoгo pocтa oтpocткoв и иx apбopизaции). Oбнapyжeнныe изменения в экcпpeccии нeйpoнcпeцифичecкиx белков NF-M и Т-1, а также пpeкpaщeниe cинтeзa пpeжниx белков ^c-чезновение ceкpeтopныx гpaнyл) cвидeтeльcтвyют о том, что в тaкиx клeткax зaпycкaютcя пpoцeccы нeйpoнaльнoй диф-фepeнциpoвки.
Mopфoлoгичecкиe и фeнoтипичecкиe пpeвpaщeния cтpoмaльныx фибpoблacтoпoдoбныx клеток пpи гавместном вoздeйcтвии на ниx PK и TCA и по cpoкaм, и по мopфoлoги-чecкoй кapтинe напоминают изменения, наблюдаемые в пpoтoкoлax c иcпoльзoвaниeм «коктейлей» из pocтoвыx фак-тopoв [эпидepмaльнoгo фaктopa pocтa, о^овного фaктopa pocтa фибpoблacтoв, тpoмбoцитapнoгo фактс^а pocтa и дp.) отдельно или в комбинации c PK [8-11, 16]. Oднaкo доля нeйpoнoпoдoбныx клеток, получаемые в тaкиx пpoтoкoлax, невелика. Наилучшие peзyльтaты yдaлocь получить пpи индукции MMCK человека эпидepмaльным фaктopoм pocтa, ocнoвным фaктopoм poCTa фибpoблacтoв и тpoмбoцитap-ным фaктopoм pocтa, пpи кyльтивиpoвaнии клеток на
фибронектине в бессывороточной среде [11]. В этом случае около 90% клеток приобретали морфологию, напоминающую строение нервных клеток, и экспрессировали повышенный уровень нейрональных маркеров. Наш протокол отличает также высокий процент выхода нейроноподобных клеток (50-70%). При этом мы использовали для индукции ММСК взрослого человека РК без каких-либо ростовых факторов и не снижали содержание сыворотки в индукционной среде. Кроме того, обрабатываемые клетки были культивированы либо на пластике, либо на поли^-лизине — неспецифическом субстрате, чтобы исключить дифференцировочные влияния подложки. Выраженный дифференцировочный эффект связан, по нашему мнению, с потенцированием ТСА действия РК.
Специфический ингибитор гистоновых деацетилаз ТСА усиливает ацетилирование гистонов во многих клеточных типах, включая клетки костного мозга [20]. Результатом такого ацетилирования в клетках Р19 эмбриональной карциномы является изменение локальной структуры хроматина, способствующее связыванию ядерных ретиноидных рецепторов с активаторным фактором [14]. Полагают, что с этим связано усиление нейрогенных эффектов РК при совместном использовании с ТСА на клетках Р19. Обнаруженный нами диффе-ренцировочный эффект комбинированной обработки ММСК РК и ТСА связан, возможно, с этим механизмом. Представленные в данной работе протоколы с использованием двух индукторов РК и ТСА различались только по степени выраженности запускаемых процессов. При однократном введении ТСА в культуру (II протокол) морфологические и фенотипические изменения стромальных клеток начинались (как и в III протоколе) на 12-е сут. индукции, когда в среде уже не оставалось ТСА. Этот факт, наряду с наличием длительного латентного периода индукции, подтверждает выводы о том, что совместное воздействие ТСА и РК на клетки вызывает запуск диффе-ренцировочных процессов. Наблюдаемые морфологические и фенотипические эффекты могут отражать дифференциро-вочный потенциал собственной РК. Механизмы длительного латентного периода индукции дифференцировки, наблюдаемого и в других протоколах с применением нативных индукторов, остаются невыясненными.
Необходимо отметить, что ни в одном исследовании с использованием естественных индукторов, так же, как и в данной работе, запущенные процессы дифференцировки не приводили к превращению стромальных клеток в предшественники нейронов или дифференцированные формы. Клетки приобретали ряд морфологических и фенотипических признаков, свойственных нативным нервным клеткам, но абсолютной идентичности достигнуто не было. Кроме некоторых очевидных отличий в морфологии была обнаружена также аберрантная внутриклеточная локализация некоторых нейронспецифических белков [10]. В то же время, мы обнаружили случаи повышенного синтеза и изменения внутриклеточной локализации нейрональных маркерных белков в стромальных клетках, не подвергшихся морфологической
тттт
трансформации. Очевидно, что переориентация белкового синтеза определяет морфологические превращения, но изменения клеточной формы, как и перестройка внутриклеточной организации, являются, по всей видимости, более длительными процессами.
Вторая популяция нейроноподобных клеток была представлена редкими (не более 0,1%) мелкими клетками, которые имеют больше аналогий с нервными по перечисленным морфологическим признакам. Кроме того, эти клетки обнаруживают значительно более высокую экспрессию нейрон-специфичных белков по сравнению с первой популяцией крупных нейроноподобных клеток. В ряде работ по индукции нейрональной дифференцировки ММСК рассматриваются именно такие клетки [9]. Однако они происходят из отдельной малочисленной популяции плюрипотентных стволовых
клеток, присутствующей как в костном мозге, так и в других тканях взрослого организма [21]. Использование этих клеток для целей клеточной терапии сегодня не представляется возможным.
Первая, более многочисленная, популяция стромальных фибробластоподобных клеток, показывающая способность к нейроноподобной дифференцировке, может рассматриваться как возможный источник клеточного материала для заместительной терапии при лечении различных неврологических заболеваний. Если удастся сделать дифференцировоч-ные эффекты стабильными, то возможность направленной индукции фенотипических превращений, особенно таких, как экспрессия нейротрофических факторов или нейротрансмиттеров, расширила бы перспективы использования ММСК как носителей трофических и медиаторных влияний.
ЛИТЕРАТУРА:
1. Александрова М.А., Сухих Г.Т., Чайлахян Р.К и др. Сравнительный анализ дифференцировки и поведения нейральных и мезенхимальных стволовых клеток человека in vitro и in vivo. Клет. технологии в биол. и мед., 2006; 1: 44-52.
2. Woodbury D., Schwarz E.J., Prockop D.J., Black I.B. Adult РК and human bone marrow stromal cells differentiate into neuron. J. Neurosci. Res. 2000; 61: 364-70.
3. Woodbury D., Reynolds K., Black I.B. Adult bone marrow stromal stem cells express germline, ectodermal, endodermal, and mesodermal genes prior to neurogenesis. J. Neurosci. Res. 2002; 69: 908-17.
4. Hung S.Ch., Cheng H., Pan Ch.Y. et al. In vitro differentiation of size-sieved stem cells into electrically active neuРКl cells. Stem Cells 2002; 20: 522-9.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
5. Lu P., Blesch A., Tuszynski M.H. Induction of bone marrow stromal cells to neurons: differentiation, tРКnsdifferentiation, or artifact? J. Neurosci. Res. 2004; 77: 174-91.
6. Neuhuber B., Gallo G., Howard L. et al. Reevaluation of in vitro differentiation protocols for bone marrow stromal cells: disruption of the actin cytoskeleton induces РКpid morphological changes and mimics neuronal phenotype. J. Neurosci. Res. 2004; 77: 192-204.
7. Rismanchi N., Floyd C.L., Berman R.F., Lyeth B.G. Cell death and longterm maintenance of neuron-like state after differentiation of РК bone marrow stromal cells: a comparison of protocols. BРКin Res. 2003; 991: 46-55.
8. Sanchez-РКmos J., Song S., Cardozo-Pelaez F. et al. Adult bone marrow stromal cells differentiate into neuronal cells in vitro. Exp. Neurol. 2000; 164: 247-56.
9. Jiang Y., Jahargirdar B.N., Reinhardt R.L. et al. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature 2002; 418: 41-9.
10. Jin K., Mao X.O., Batteur S. et al. Induction of neuronal markers in bone marrow cells: differential effects of growth factors and patterns of intРКcellular
expression. Exp. Neurol. 2003; 184: 78-89.
11. Tao H., PKo R., Ma D.D.F. Cytokine-induced stable neuronal differentiation of human bone marrow mesenchymal stem cells in a serum/feeder cell-free condition. Develop. Growth Differ. 2005; 47: 423-33.
12. Riaz S.S., Theofilopoulos S., Jauniaux E. et al. The differentiation potential of human foetal neuronal progenitor cells in vitro. BPKin Res. 2004; 153(1): 39-51.
13. Schuldiner M., Eiges R., Eden A. et al. Induced neuronal differentiation of human embryonic stem cells. BPKin Res. 2001; 913(2): 201-5.
14. Minucci S., Horn V., Bhattacharyya N. et al. A histone deacetylase inhibitor potentiates retinoid receptor action in embryonal carcinoma cells. Proc. Natl. Acad. Sci. USA 1997; 94: 11295-300.
15. Reynolds C.P. Differentiating agents in pediatric malignancies: retinoids in neuroblastoma. Curr. Oncol. Rep. 2000; 2(6): 511-608.
16. Kim B.J., Seo J.H., Bubien J.K., Oh Y.S. Differentiation of adult bone marrow stem cells into neuroprogenitor cells in vitro. Neuroreport 2002; 13(9): 1185-8.
17. Garcia-Villalba P., Jimenez-LaPK A.M., Castillo A.I., APKnda A. Histone acetylation influences thyroid hormone and retinoic acid-mediated gene expression. DNA Cell Biol. 1997; 16(4): 421-31.
18. D’Ippolito G., Schiller P.C., Ricordi C. et al. Age-related osteogenic potential of mesenchymal stromal stem cells from human vertebPKl bone marrow. J. Bone Miner. Res. 1999; 14(7): 1115-22.
19. Simmons P.J., Torok-Storb B. Identification of stromal cell precursors in human bone marrow by a novel monoclonal antibody, STRO-1. Blood 1991; 78(1): 55-62.
20. Golay J., Cuppini L., Leoni F. The histone deacetylase inhibitor ITF2357 has anti-leukemic activity in vitro and in vivo and inhibits IL-6 and VEGF production by stromal cells. Leukemia 2007; 21(9): 1892-900.
21. Lakshmipathy U., Verfaillie C. Stem cell plasticity. Blood Rev. 2005; 19(1): 29-38.
Поступила 14.12.2007
A
Product ID T6933
Cas No. 58880-19-6
Purity ≥98%
| Product Unit Size | Cost | Quantity | Stock |
|---|
-
Description
-
Product Info
-
Shipping and Storage
-
Downloads
-
References
-
Custom Order
Description
Trichostatin A is an inhibitor of class I and II HDACs that exhibits anticancer and immunomodulatory activities. Trichostatin A induces cell cycle arrest, increases phosphorylation of JNK, downregulates activity of MCM-2, induces apoptosis, and inhibits proliferation of colon cancer cells. Trichostatin A also enhances differentiation and activity of CD4+ Foxp3+ Treg cells. Additionally, trichostatin A alters mammalian RNA splicing.
Trichostatin A also alters RNA splicing.
Product Info
| Cas No. |
58880-19-6 |
|---|---|
| Purity |
≥98% |
| Formula |
C17H22N2O3 |
| Formula Wt. |
302.37 |
| Chemical Name |
[R-(E,E)[-7-[4-(Dimethylamino)phenyl]-N-hydroxy- 4,6-dimethyl-7-oxo-2,4-heptadienamide |
| IUPAC Name |
(2E,4E,6R)-7-[4-(dimethylamino)phenyl]-N-hydroxy-4, |
| Synonym |
TSA |
| Melting Point |
150-151°C |
| Solubility |
Soluble in lower alchols. Slightly soluble in chloroform, ethyl acetate, acetone and benzene. |
| Appearance |
Beige Powder |
Shipping and Storage
| Store Temp |
-20°C |
|---|---|
| Ship Temp |
Blue Ice |
References
Liu Y, He G, Wang Y, et al. MCM-2 is a therapeutic target of Trichostatin A in colon cancer cells. Toxicol Lett. 2013 Jul 31;221(1):23-30. PMID: 23770000.
Doñas C, Fritz M, Manríquez V, et al. Trichostatin A promotes the generation and suppressive functions of regulatory T cells. Clin Dev Immunol. 2013;2013:679804. PMID: 23737814.
Cecconi D, Donadelli M, Rinalducci S,et al. Proteomic analysis of pancreatic endocrine tumor cell lines treated with the histone deacetylase inhibitor trichostatin A. Proteomics. 2007 May;7(10):1644-53. PMID: 17443844.
Custom Order
|
Home
|
Vorinostat
|
CI-994
|
MS-275
|
BML-210
|
M344
|
NVP-LAQ824
|
Panobinostat
|
Mocetinostat
|
PXD101
|
Trichostatin A (TSA) is an organic compound that inhibits both class I and II HDACs (histone deacetylases). TSA has potent dose-dependent antitumor activity against breast cancer in vitro and in vivo, strongly supporting HDAC as a molecular target for anticancer therapy in breast cancer.
IUPAC Name: (2E,4E,6R)-7-(4-dimethylaminophenyl)-N-hydroxy-4,6-dimethyl-7-oxohepta-2,4-dienamide
Molecular Weight: 302,38 g/mol
Molecular Formula: C17H22N2O3
SMILES: CN(C)c1ccc(cc1)C(=O)C(C)C=C(C)C=CC(=O)NO
Canonical SMILES: CC(C=C(C)C=CC(=O)NO)C(=O)C1=CC=C(C=C1)N(C)C
InChIKey Identifier: RTKIYFITIVXBLE-QEQCGCAPSA-N
CAS Number: 58880-19-6
Melting point: 141-143°C
Solubility: DMSO, Ethanol
2D Molfile: Get the molfile
Synonyms: TSA
TSA suppresses the activity of HDAC leading to an increase in histone acetylation. This histone acetylation induces an enhancement of the expression of specific genes that elicit extensive cellular morphologic and metabolic changes, such as growth arrest, differentiation and apoptosis.
Trichostatin A has been shown to induce apoptosis in many cancer cells at submicromolar concentrations with very low toxicity toward normal cells.
References:
1) Roh MS, Kim CW, Park BS, Kim GC, Jeong JH, Kwon HC, Suh DJ, Cho KH, Yee SB, Yoo YH. Mechanism of histone deacetylase inhibitor Trichostatin A induced apoptosis in human osteosarcoma cells. Apoptosis. 2004;9:583�589.
2) Vigushin DM, Ali S, Pace PE, Mirsaidi N, Ito K, Adcock I, Coombes RC. Trichostatin A is a histone deacetylase inhibitor with potent antitumor activity against breast cancer in vivo. Clin Cancer Res. 2001 Apr;7(4):971-6.