Описание препарата Венофер® (раствор для внутривенного введения, 20 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2014 году
Дата согласования: 27.11.2014
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Венофер®
- Заказ в аптеках Москвы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для внутривенного введения | 1 мл |
| активное вещество: | |
| железа (III) гидроксид сахарозный комплекс | 540 мг |
| (эквивалентно содержанию железа 20 мг) | |
| вспомогательные вещества: натрия гидроксид; вода для инъекций — до 1 мл |
Описание лекарственной формы
Водный раствор коричневого цвета.
Фармакологическое действие
Фармакологическое действие
—
восполняющее дефицит железа, противоанемическое.
Фармакодинамика
Многоядерные центры железа (III) гидроксида окружены снаружи множеством нековалентно связанных молекул сахарозы. В результате образуется комплекс, молекулярная масса которого составляет приблизительно 43 кД, вследствие чего его выведение через почки в неизмененном виде невозможно. Данный комплекс стабилен и в физиологических условиях не выделяет ионы железа. Железо в этом комплексе связано со структурами, сходными с естественным ферритином.
Фармакокинетика
После однократного в/в введения препарата Венофер®, содержащего 100 мг железа, Cmax железа, в среднем 538 μмоль, достигается спустя 10 мин после инъекции. Vd центральной камеры практически полностью соответствует объему сыворотки (около 3 л).
T1/2 — около 6 ч. Vss составляет примерно 8 л (что указывает на низкое распределение железа в жидких средах организма). Благодаря низкой стабильности железа сахарата в сравнении с трансферрином наблюдается конкурентный обмен железа в пользу трансферрина. В результате за 24 ч переносится около 31 мг железа.
Выделение железа почками первые 4 ч после инъекции составляет менее 5% от общего клиренса. Спустя 24 ч уровень железа сыворотки возвращается к первоначальному (до введения) значению, и примерно 75% сахарозы покидает сосудистое русло.
Показания
Лечение железодефицитных состояний в следующих случаях:
- необходимость быстрого восполнения дефицита железа;
- у больных, которые не переносят пероральные препараты железа или не соблюдают режим лечения;
- при наличии активных воспалительных заболеваний кишечника, когда пероральные препараты железа неэффективны.
Противопоказания
- повышенная чувствительность к препарату Венофер® или его компонентам;
- анемия, не связанная с дефицитом железа;
- признаки перегрузки железом (гемосидероз, гемохроматоз) или нарушение процесса его утилизации;
- I триместр беременности.
С осторожностью: бронхиальная астма, экзема, поливалентная аллергия, аллергические реакции на другие парентеральные препараты железа, низкая железосвязывающая способность сыворотки и/или дефицит фолиевой кислоты; печеночная недостаточность, острые или хронические инфекционные заболевания (в связи с тем, что парентерально вводимое железо может оказывать неблагоприятное действие при наличии бактериальной или вирусной инфекции) и лица, у которых повышены показатели ферритина сыворотки крови.
Применение при беременности и кормлении грудью
Ограниченный опыт применения препарата Венофер® у беременных пациенток показал отсутствие нежелательного влияния сахарата железа на течение беременности и здоровье плода/новорожденного. До настоящего времени не проводилось хорошо контролируемых исследований у беременных женщин. Результаты исследований репродукции у животных не выявили прямых или опосредованных вредных воздействий на развитие эмбриона/плода, роды или постнатальное развитие. Тем не менее, требуется дальнейшее исследование соотношения риск/польза.
Поступление неметаболизированного сахарата железа в грудное молоко маловероятно. Таким образом, Венофер® не представляет опасности для младенцев, находящихся на грудном вскармливании.
Способ применения и дозы
Реклама: ООО «РЛС-Библиомед», ИНН 7714758963, erid=4CQwVszH9pUmKjt23pm
В/в.
Венофер® вводится только в/в — медленно струйно или капельно, а также в венозный участок диализной системы — и не предназначен для в/м введения. Недопустимо одномоментное введение полной терапевтической дозы препарата.
Перед введением первой терапевтической дозы необходимо назначить тест-дозу. Если в течение периода наблюдения возникли явления непереносимости, введение препарата следует немедленно прекратить. Перед вскрытием ампулы нужно осмотреть ее на наличие возможного осадка и повреждений. Можно использовать только коричневый раствор без осадка.
Капельное введение: Венофер® предпочтительнее вводить в ходе капельной инфузии для того, чтобы уменьшить риск выраженного снижения АД и опасность попадания раствора в околовенозное пространство. Непосредственно перед инфузией Венофер® нужно развести 0,9% раствором натрия хлорида в соотношении 1:20, например — 1 мл (20 мг железа) в 20 мл 0,9% раствора натрия хлорида. Полученный раствор вводится со следующей скоростью: 100 мг железа — не менее чем за 15 мин; 200 мг железа — в течение 30 мин; 300 мг железа — в течение 1,5 ч; 400 мг железа — в течение 2,5 ч; 500 мг железа — в течение 3,5 ч. Введение максимально переносимой разовой дозы, составляющей 7 мг железа/кг, следует производить в течение минимум 3,5 ч, независимо от общей дозы препарата.
Перед первым капельным введением терапевтической дозы препарата Венофер® необходимо ввести тест-дозу: 20 мг железа — взрослым и детям с массой тела более 14 кг и половину дневной дозы (1,5 мг железа/кг) — детям, имеющим массу тела менее 14 кг, в течение 15 мин. При отсутствии нежелательных явлений оставшуюся часть раствора следует вводить с рекомендованной скоростью.
Струйное введение: препарат Венофер® также можно вводить в виде неразведенного раствора в/в медленно, со скоростью (норма) 1 мл препарата Венофер® (20 мг железа) в мин, т.о. 5 мл препарата Венофер® (100 мг железа) вводится минимум за 5 мин. Максимальный объем не должен превышать 10 мл препарата Венофер® (200 мг железа) за 1 инъекцию.
Перед первым струйным введением терапевтической дозы препарата Венофер® следует назначить тест-дозу: 1 мл препарата Венофер® (20 мг железа) — взрослым и детям массой тела более 14 кг и половину дневной дозы (1,5 мг железа/кг) — детям массой тела менее 14 кг в течение 1–2 мин. При отсутствии нежелательных явлений в течение последующих 15 мин наблюдения оставшуюся часть раствора следует вводить с рекомендованной скоростью. После инъекции больному рекомендуется на некоторое время зафиксировать руку в вытянутом положении.
Введение в диализную систему: Венофер® возможно вводить непосредственно в венозный участок диализной системы, строго соблюдая правила, описанные для в/в инъекции.
Расчет дозы: доза рассчитывается индивидуально, в соответствии с общим дефицитом железа в организме по формуле:
Общий дефицит железа, мг = масса тела, кг ? (нормальный уровень Hb ? уровень Hb больного), г/л ? 0,24* + депонированное железо, мг.
Для больных массой тела менее 35 кг: нормальный уровень Hb=130 г/л, количество депонированного железа = 15 мг/кг.
Для больных массой тела более 35 кг: нормальный уровень Hb=150 г/л, количество депонированного железа = 500 мг.
*Коэффициент 0,24 = 0,0034?0,07?1000 (содержание железа в Hb=0,34%; объем крови = 7% от массы тела; коэффициент 1000 = перевод из «г» в «мг»).
Общий объем препарата Венофер®, который необходимо ввести (в мл) = общий дефицит железа (мг)/20 мг/мл (см. табл.).
Таблица
Общий объем препарата Венофер® для лечения
| Масса тела, кг | Кумулятивная терапевтическая доза препарата Венофер® для введения | |||||||
| Hb 60 г/л |
Hb 75 г/л |
Hb 90 г/л |
Hb 105 г/л |
|||||
|
мг Fe |
мл |
мг Fe |
мл |
мг Fe |
мл |
мг Fe |
мл |
|
| 5 | 160 | 8 | 140 | 7 | 120 | 6 | 100 | 5 |
| 10 | 320 | 16 | 280 | 14 | 240 | 12 | 220 | 11 |
| 15 | 480 | 24 | 420 | 21 | 380 | 19 | 320 | 16 |
| 20 | 640 | 32 | 560 | 28 | 500 | 25 | 420 | 21 |
| 25 | 800 | 40 | 700 | 35 | 620 | 31 | 520 | 26 |
| 30 | 960 | 48 | 840 | 42 | 740 | 37 | 640 | 32 |
| 35 | 1260 | 63 | 1140 | 57 | 1000 | 50 | 880 | 44 |
| 40 | 1360 | 68 | 1220 | 61 | 1080 | 54 | 940 | 47 |
| 45 | 1480 | 74 | 1320 | 66 | 1140 | 57 | 980 | 49 |
| 50 | 1580 | 79 | 1400 | 70 | 1220 | 61 | 1040 | 52 |
| 55 | 1680 | 84 | 1500 | 75 | 1300 | 65 | 1100 | 55 |
| 60 | 1800 | 90 | 1580 | 79 | 1360 | 68 | 1140 | 57 |
| 65 | 1900 | 95 | 1680 | 84 | 1440 | 72 | 1200 | 60 |
| 70 | 2020 | 101 | 1760 | 88 | 1500 | 75 | 1260 | 63 |
| 75 | 2120 | 106 | 1860 | 93 | 1580 | 79 | 1320 | 66 |
| 80 | 2220 | 111 | 1940 | 97 | 1660 | 83 | 1360 | 68 |
| 85 | 2340 | 117 | 2040 | 102 | 1720 | 86 | 1420 | 71 |
| 90 | 2440 | 122 | 2120 | 106 | 1800 | 90 | 1480 | 74 |
В случае, когда общая терапевтическая доза превышает максимальную допустимую разовую дозу, рекомендуется дробное введение препарата.
Если спустя 1–2 нед после начала лечения препаратом Венофер® не происходит улучшения гематологических показателей, необходимо пересмотреть первоначальный диагноз.
Расчет дозы для восполнения уровня железа после кровопотери или сдачи аутологичной крови
Доза препарата Венофер® подсчитывается по следующей формуле:
— если количество потерянной крови известно: в/в введение 200 мг железа (10 мл препарата Венофер®) приводит к такому же повышению концентрации Hb, как и переливание 1 единицы крови (400 мл с концентрацией Hb=150 г/л).
Количество железа, которое необходимо восполнить (мг) = количество единиц потерянной крови ? 200
или
Необходимый объем препарата Венофер® (мл) = количество единиц потерянной крови ? 10.
— при снижении уровня Hb: используйте предыдущую формулу при условии, что депо железа пополнять не требуется.
Количество железа, которое нужно восполнить (мг) = масса тела, кг ? 0,24 ? (нормальный уровень Hb ? уровень Hb больного), г/л.
Например: масса тела 60 кг, дефицит Hb = 10 г/л « необходимое количество железа » 150 мг « необходимый объем препарата Венофер® = 7,5 мл.
Стандартная дозировка
Взрослые и пожилые больные: 5–10 мл Венофер® (100–200 мг железа) 1–3 раза в неделю, в зависимости от уровня гемоглобина.
Дети: имеются лишь ограниченные данные о применении препарата у детей до 3 лет. Рекомендуемая доза для детей остальных возрастных групп — не более 0,15 мл (3 мг железа) на кг массы тела 1–3 раза в неделю, в зависимости от уровня гемоглобина.
Максимально переносимая разовая доза
Взрослые и пожилые больные:
— для струйного введения: 10 мл препарата Венофер® (200 мг железа), продолжительность введения не менее 10 мин.
— для капельного введения: в зависимости от показаний, разовая доза может достигать 500 мг железа. Максимально допустимая разовая доза составляет 7 мг/кг и вводится 1 раз в неделю, но она не должна превышать 500 мг железа. Время введения препарата и способ разведения см. выше.
Побочные действия
В настоящее время известно о следующих нежелательных явлениях, имеющих временное и возможное причинное отношение к введению препарата Венофер®. Все симптомы наблюдались очень редко (частота возникновения меньше 0,01% и больше или равна 0,001%).
Со стороны нервной системы: головокружение, головная боль, потеря сознания, парестезии.
Со стороны ССС: сердцебиение, тахикардия, снижение АД, коллаптоидные состояния, чувство жара, приливы крови к лицу, периферические отеки.
Со стороны органов дыхания: бронхоспазм, одышка.
Со стороны ЖКТ: разлитые боли в животе, боль в эпигастральной области, диарея, извращение вкуса, тошнота, рвота.
Со стороны кожных покровов: эритема, зуд, сыпь, нарушение пигментации, повышение потливости.
Со стороны опорно-двигательного аппарата: артралгия, боль в спине, отек суставов, миалгия, боль в конечностях.
Со стороны иммунной системы: аллергические, анафилактоидные реакции, в т.ч. отек лица, отек гортани.
Нарушения общего характера и реакции в месте инъекции: астения, боль в груди, чувство тяжести в груди, слабость, боль и отек в месте введения (особенно при экстравазальном попадании препарата), чувство недомогания, бледность, повышение температуры, озноб.
Взаимодействие
Венофер® не должен назначаться одновременно с лекарственными формами железа для приема внутрь, т.к. способствует уменьшению всасывания железа из ЖКТ. Лечение пероральными препаратами железа можно начинать не ранее чем через 5 дней после последней инъекции.
Венофер® можно смешивать в одном шприце только со стерильным физиологическим раствором. Никаких других растворов для в/в введения и терапевтических препаратов добавлять не разрешается, поскольку существует риск преципитации и/или иного фармацевтического взаимодействия. Совместимость с контейнерами из иных материалов, чем стекло, ПЭ и ПВХ не изучена.
Передозировка
Передозировка может вызывать острую перегрузку железом, которая проявляется симптомами гемосидероза.
Лечение: рекомендуется использовать симптоматические средства и, если необходимо, вещества, связывающие железо (хелаты), например дефероксамин в/в.
Особые указания
Венофер® должен назначаться только тем больным, у которых диагноз анемии подтвержден соответствующими лабораторными данными (например результаты определения ферритина сыворотки или уровня гемоглобина и гематокрита, количества эритроцитов и их параметров — среднего объема эритроцита, среднего содержания гемоглобина в эритроците).
В/в препараты железа могут вызывать аллергические или анафилактоидные реакции, которые могут быть потенциально опасными для жизни.
Следует строго соблюдать скорость введения препарата Венофер® (при быстром введении препарата может снижаться АД). Более высокая частота развития нежелательных побочных явлений (в особенности — снижение АД), которые также могут быть и тяжелыми, ассоциируется с увеличением дозы. Таким образом, время введения препарата, приводимое в разделе «Способ применения и дозы», должно строго соблюдаться, даже если пациент не получает препарат в максимально переносимой разовой дозе.
Исследования, проведенные у пациентов, имеющих реакции повышенной чувствительности к декстрану железа, показали отсутствие осложнений на фоне лечения препаратом Венофер®.
Следует избегать проникновения препарата в околовенозное пространство, т.к. попадание Венофера® за пределы сосуда приводит к некрозу тканей и коричневому окрашиванию кожи. В случае развития данного осложнения для ускорения выведения железа и предотвращения его дальнейшего проникновения в окружающие ткани, рекомендуется нанесение на место инъекции гепаринсодержащих препаратов (гель или мазь наносят легкими движениями, не втирая).
Срок хранения после первого вскрытия контейнера: с микробиологической точки зрения, препарат следует использовать незамедлительно.
Срок хранения после разведения физиологическим раствором: химическая и физическая стабильность после разведения при комнатной температуре сохраняется в течение 12 ч. С микробиологической точки зрения, раствор следует использовать незамедлительно. Если препарат не был использован сразу же после разведения, пользователь несет ответственность за условия и время хранения, которое в любом случае не должно превышать 3 ч при комнатной температуре в том случае, если разведение было выполнено в контролируемых и гарантированных асептических условиях.
Влияние на способность к вождению автомобиля и работе с механизмами. Маловероятно, что препарат Венофер® может оказывать нежелательное действие на способность к вождению автомобиля и работе с механизмами.
Форма выпуска
Раствор для внутривенного введения, 20 мг/мл: в бесцветных, прозрачных стеклянных ампулах (тип I, Европейская Фармакопея) по 2 или 5 мл; в упаковке контурной ячейковой 5 амп.; в пачке картонной 1 упаковка.
Производитель
Вифор C.A. Рут де Монкор, 10, СН-1752, Виллар-сюр-Глан, Швейцария.
Владелец регистрационного удостоверения. Вифор (Интернэшнл) Инк. Рехенштрассе, 37, СН-9014, Ст. Галлен, Швейцария.
Организация, принимающая претензии Вифор (Интернэшнл) Инк. 125047, Москва, ул. 3-я Тверская-Ямская, 44.
Тел.: (495) 564-82-66; факс: (495) 251-58-08.
Эл. почта: info@vifor.com.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре 4–25 °C.
В оригинальной упаковке. Не замораживать
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Фармакологическое действие
Препарат железа. Многоядерные центры железа (III) гидроксида окружены снаружи множеством нековалентно связанных молекул сахарозы. В результате образуется комплекс, молекулярная масса которого составляет приблизительно 43 кД, вследствие этого его выведение почками в неизмененном виде невозможно. Данный комплекс стабилен и в физиологических условиях не выделяет ионы железа. Железо в этом комплексе связано со структурами, сходными с естественным ферритином.
Фармакокинетика
Распределение
После однократного в/в введения препарата Венофер®, содержащего 100 мг железа, Cmax железа, в среднем 538 мкмоль, достигается спустя 10 мин после инъекции.
Vd центральной камеры практически полностью соответствует объему сыворотки — около 3 л.
Vd в равновесном состоянии составляет примерно 8 л (что указывает на низкое распределение железа в жидких средах организма). Благодаря низкой стабильности железа сахарата в сравнении с трансферрином, наблюдается конкурентный обмен железа в пользу трансферрина. В результате за 24 ч переносится около 31 мг железа (III).
Выведение
T1/2 — около 6 ч. В первые 4 ч почками выводится менее 5% железа от общего клиренса. Спустя 24 ч уровень железа сыворотки возвращается к первоначальному (до введения) значению, и примерно 75% сахарозы покидает сосудистое русло.
Показания препарата
Венофер®
Железодефицитные состояния:
- при необходимости быстрого восполнения железа;
- при непереносимости пероральных препаратов железа или несоблюдении режима лечения;
- при наличии активных воспалительных заболеваний кишечника, когда пероральные препараты железа неэффективны.
Режим дозирования
Венофер вводят только в/в (медленно капельно или струйно) или в венозный участок диализной системы. Не предназначен для в/м введения. Недопустимо одномоментное введение полной терапевтической дозы препарата.
Перед введением первой терапевтической дозы необходимо назначить тест-дозу. Если в течение периода наблюдения возникли явления непереносимости, введение препарата следует немедленно прекратить. Перед вскрытием ампулы следует осмотреть ее на наличие возможного осадка и повреждений. Можно использовать только коричневый раствор без осадка.
Капельное введение: Венофер® предпочтительно вводить в ходе капельной инфузии для того, чтобы уменьшить риск выраженного снижения АД и опасность попадания раствора в околовенозное пространство. Непосредственно перед инфузией Венофер® следует развести 0.9% раствором натрия хлорида в соотношении 1:20, например, 1 мл (20 мг железа) в 20 мл 0.9% раствора натрия хлорида. Полученный раствор следует вводить со следующей скоростью: 100 мг железа — не менее, чем за 15 мин; 200 мг железа — в течение 30 мин; 300 мг железа — в течение 1.5 ч; 400 мг железа — в течение 2.5 ч; 500 мг железа — в течение 3.5 ч. Введение максимально переносимой разовой дозы, составляющей 7 мг железа/кг, следует производить в течение минимум 3.5 ч, независимо от общей дозы препарата.
Перед первым капельным введением терапевтической дозы препарата Венофер® необходимо ввести тест-дозу: 20 мг железа взрослым и детям с массой тела более 14 кг, и половину дневной дозы (1.5 мг железа/кг) детям, имеющим массу тела менее 14 кг, в течение 15 мин. При отсутствии нежелательных явлений, оставшуюся часть раствора следует вводить с рекомендованной скоростью.
Струйное введение: препарат Венофер® также можно вводить в виде неразведенного раствора в/в медленно, со скоростью (норма) 1 мл препарата Венофер® (20 мг железа) в мин; 5 мл препарата Венофер® (100 мг железа) следует вводить минимум за 5 мин. Максимальный объем препарата не должен превышать 10 мл препарата Венофер® (200 мг железа) за 1 инъекцию.
Перед первым струйным введением терапевтической дозы препарата Венофер® следует назначить тест-дозу: 1 мл препарата Венофер® (20 мг железа) взрослым и детям массой тела более 14 кг и половину дневной дозы (1.5 мг железа/кг) детям массой тела менее 14 кг в течение 1-2 мин. При отсутствии нежелательных явлений в течение последующих 15 мин наблюдения оставшуюся часть раствора следует вводить с рекомендованной скоростью. После инъекции больному рекомендуется на некоторое время зафиксировать руку в вытянутом положении.
Введение в диализную систему
Венофер® можно вводить непосредственно в венозный участок диализной системы, строго соблюдая правила, описанные для в/в инъекции.
Расчет дозы: доза рассчитывается индивидуально в соответствии с общим дефицитом железа в организме по формуле:
Общий дефицит железа (мг) = масса тела (кг) × [нормальный уровень Hb — уровень Hb больного] (г/л) × 0.24* + депонированное железо (мг).
Для больных массой тела менее 35 кг: нормальный уровень Hb=130 г/л, количество депонированного железа = 15 мг/кг массы тела.
Для больных массой тела более 35 кг: нормальный уровень Hb=150 г/л, количество депонированного железа = 500 мг.
*Коэффициент 0.24 = 0.0034×0.07×1000 (содержание железа в Hb=0.34%; объем крови = 7% от массы тела; коэффициент 1000 = перевод из «г» в «мг»).
Общий объем (мл) препарата Венофер®, который необходимо ввести = общий дефицит железа (мг)/20 мг/мл (таблицы 1 и 2).
Таблица 1
Таблица 2
В случае, когда общая терапевтическая доза превышает максимальную допустимую разовую дозу, рекомендуется дробное введение препарата. Если спустя 1–2 нед. после начала лечения препаратом Венофер® не происходит улучшения гематологических показателей, необходимо пересмотреть первоначальный диагноз.
Расчет дозы для восполнения уровня железа после кровопотери или сдачи аутологичной крови
Доза препарата Венофер® рассчитывается по следующей формуле:
Если количество потерянной крови известно: в/в введение 200 мг железа (10 мл препарата Венофер®) приводит к такому же повышению концентрации Hb, как и переливание 1 единицы крови (=400 мл с концентрацией Hb=150 г/л).
Количество железа, которое необходимо восполнить (мг) = количество единиц потерянной крови × 200 или Необходимый объем препарата Венофер® (мл) = количество единиц потерянной крови × 10.
При снижении уровня Hb: следует использовать предыдущую формулу при условии, что депо железа пополнять не требуется.
Количество железа (мг), которое нужно восполнить = масса тела (кг) × 0.24 × [нормальный уровень Hb — уровень Hb больного] (г/л).
Например: масса тела 60 кг, дефицит Hb = 10 г/л: необходимое количество железа составляет приблизительно 150 мг, а необходимый объем препарата Венофер® = 7.5 мл.
Стандартная доза
Взрослым и пациентам пожилого возраста назначают 5-10 мл препарата Венофер® (100-200 мг железа) 1-3 раза в неделю в зависимости от уровня гемоглобина.
Имеются лишь ограниченные данные о применении препарата у детей в возрасте до 3 лет. В случае необходимости рекомендуется вводить не более 0.15 мл препарата Венофер® (3 мг железа) на кг массы тела 1-3 раза в неделю в зависимости от уровня гемоглобина.
Максимальная переносимая разовая доза
Взрослым и пациентам пожилого возраста: для струйного введения — 10 мл препарата Венофер® (200 мг железа), продолжительность введения не менее 10 мин; для капельного введения в зависимости от показаний разовая доза может достигать 500 мг железа. Максимальная допустимая разовая доза составляет 7 мг/кг и вводится 1 раз в неделю, но она не должна превышать 500 мг железа. Время введения препарата и способ разведения, как указано выше.
Побочное действие
Побочные эффекты, вероятно связанные с введением препарата Венофер®, наблюдались очень редко (< 0.01% и ≥ 0.001%).
Со стороны нервной системы: головокружение, головная боль, потеря сознания, парестезии.
Со стороны сердечно-сосудистой системы: сердцебиение, тахикардия, снижение АД, коллаптоидные состояния, чувство жара, «приливы» крови к лицу.
Со стороны органов дыхания: бронхоспазм, одышка.
Со стороны пищеварительной системы: разлитые боли в животе, боль в эпигастральной области, диарея, извращение вкуса, тошнота, рвота.
Со стороны кожных покровов: эритема, зуд, сыпь, нарушение пигментации, повышенная потливость.
Со стороны костно-мышечной системы: артралгия, боль в спине, отек суставов, миалгия, боль в конечностях.
Аллергические реакции: анафилактоидные реакции, отек лица, отек гортани.
Местные реакции: боль и отек в месте введения (особенно при экстравазальном попадании препарата).
Нарушения общего характера: астения, боль в груди, чувство тяжести в груди, слабость, периферические отеки, чувство недомогания, бледность, повышение температуры, озноб.
Противопоказания к применению
- анемия, не связанная с дефицитом железа;
- признаки перегрузки железом (гемосидероз, гемохроматоз);
- нарушение процесса утилизации железа;
- I триместр беременности;
- повышенная чувствительность к компонентам препарата.
С осторожностью назначают препарат больным бронхиальной астмой, при экземе, поливалентной аллергии, аллергических реакциях на иные парентеральные препараты железа; пациентам с низкой железосвязывающей способностью сыворотки и/или дефицитом фолиевой кислоты; пациентам с печеночной недостаточностью, с острыми или хроническими инфекционными заболеваниями, при повышенном содержании ферритина в сыворотке в связи с тем, что железо при парентеральном введении может оказывать неблагоприятное действие при наличии бактериальной или вирусной инфекции.
Применение при беременности и кормлении грудью
Противопоказано в I триместре беременности.
Ограниченный опыт применения препарата Венофер® у беременных пациенток показал отсутствие нежелательного влияния сахарата железа на течение беременности и здоровье плода/новорожденного. До настоящего времени не проводилось хорошо контролируемых исследований у беременных женщин. В экспериментальных исследованиях влияния на репродукцию у животных не выявлено прямого или опосредованного вредного воздействия на развитие эмбриона/плода, роды или постнатальное развитие. Тем не менее, требуется дальнейшее исследование соотношения ожидаемой пользы терапии для матери и возможного риска для плода.
Поступление неметаболизированного сахарата железа в грудное молоко маловероятно. Таким образом, Венофер® не представляет опасности для младенцев, находящихся на грудном вскармливании.
Применение при нарушениях функции печени
С осторожностью назначают пациентам с печеночной недостаточностью.
Применение у пожилых пациентов
Применение возможно согласно режиму дозирования.
Особые указания
Венофер® следует назначать только тем больным, у которых диагноз анемии подтвержден соответствующими лабораторными данными (например, результатами определения ферритина сыворотки или уровня гемоглобина и гематокрита, количества эритроцитов и их параметров — среднего объема эритроцита, среднего содержания гемоглобина в эритроците).
В/в препараты железа могут вызывать аллергические или анафилактоидные реакции, которые могут быть потенциально опасными для жизни.
Следует строго соблюдать скорость введения препарата Венофер® (при быстром введении препарата может снижаться АД). Более высокая частота развития нежелательных побочных реакций (в особенности — снижение АД), которые также могут быть и тяжелыми, ассоциируется с увеличением дозы. Таким образом, следует строго соблюдать рекомендуемое время введения препарата, даже если пациент не получает препарат в максимально переносимой разовой дозе.
Исследования, проведенные у пациентов, имеющих реакции повышенной чувствительности к декстрану железа, показали отсутствие осложнений на фоне лечения препаратом Венофер®.
Следует избегать проникновения препарата в околовенозное пространство, т.к. попадание Венофера за пределы сосуда приводит к некрозу тканей и коричневому окрашиванию кожи. В случае развития данного осложнения для ускорения выведения железа и предотвращения его дальнейшего проникновения в окружающие ткани, рекомендуется нанесение на место инъекции гепарин-содержащих препаратов (гель или мазь наносят легкими движениями, не втирая).
С микробиологической точки зрения, препарат следует использовать незамедлительно.
Срок хранения после разведения физиологическим раствором: химическая и физическая стабильность после разведения при комнатной температуре составляет 12 ч. С микробиологической точки зрения, препарат следует использовать незамедлительно. Если препарат не был использован сразу же после разведения, пользователь несет ответственность за условия и время хранения, которое в любом случае не должно превышать 3 ч при комнатной температуре в том случае, если разведение было выполнено в контролированных и гарантированных асептических условиях.
Влияние на способность к управлению транспортными средствами и механизмами
Маловероятно, что препарат Венофер® может оказывать нежелательное действие на способность к вождению автотранспорта и работе с механизмами.
Передозировка
Симптомы: гемосидероз вследствие острой перегрузки.
Лечение: рекомендуется проведение симптоматической терапии и, если необходимо, применение препаратов, связывающих железо (хелаты), например, дефероксамин в/в.
Лекарственное взаимодействие
Не следует назначать препарат одновременно с лекарственными формами железа для приема внутрь, т.к. уменьшается всасывание железа из ЖКТ. Лечение пероральными препаратами железа можно начинать не ранее чем через 5 дней после последней инъекции.
Фармацевтическое взаимодействие
Венофер® можно смешивать в одном шприце только с физиологическим раствором. Никаких других растворов для в/в введения и терапевтических препаратов добавлять не разрешается, поскольку существует риск преципитации и/или иного фармацевтического взаимодействия. Совместимость с контейнерами из иных материалов, чем стекло, полиэтилен и поливинилхлорид не изучена.
Условия хранения препарата Венофер®
Препарат следует хранить в недоступном для детей месте, в оригинальной упаковке, при температуре от 4° до 25°C; не замораживать.
Срок годности препарата Венофер®
Срок годности — 3 года.
Условия реализации
Препарат отпускается по рецепту.
Венофер — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
Торговое название:
Венофер® (Venofer®)
Международное непатентованное или группировочное название:
железа(III) гидроксид сахарозный комплекс
Лекарственная форма:
раствор для внутривенного введения
Состав:
1 мл препарата содержит:
Активное вещество:
железо(Ш) 20 мг
в виде железа(Ш) гидроксид сахарозного комплекса 510-570 мг
Вспомогательные вещества:
натрия гидроксид 0-5 мг
в виде 10 % раствора натрия гидроксида q.s. до доведения pH 10,5-11,0
вода для инъекций 580-640 мг
Описание
Водный раствор коричневого цвета.
Фармакотерапевтическая группа:
противоанемическое средство, препарат железа для парентерального введения.
Код АТХ:
В03АС
Фармакологические свойства
Фармакодинамика
Механизм действия
Активный компонент препарата Венофер® — железо-сахарозный комплекс — состоит из ядра многоядерного гидроксида железа(Ш), окруженного большим количеством нековалентно связанных молекул сахарозы. Средняя молекулярная масса этого комплекса примерно равна 43 кДа. Структура многоядерного железосодержащего ядра сходна со структурой ядра белка ферритина — физиологического депо железа. Этот комплекс предназначен для создания управляемого источника утилизируемого железа для белков, отвечающих за транспорт и депонирование железа в организме (соответственно трансферрина и ферритина).
После внутривенного введения многоядерное железосодержащее ядро этого комплекса захватывается преимущественно ретикулоэндотелиальной системой печени, селезенки и костного мозга. На следующем этапе железо используется для синтеза гемоглобина, миоглобина и других железосодержащих ферментов, либо хранится преимущественно в печени в форме ферритина.
Фармакокинетика
Распределение
Феррокинетика железо-сахарозного комплекса, меченного 52Fe и 59Fe, оценивалась у пациентов с анемией и хронической почечной недостаточностью. В течение первых 6-8 часов 52Fe захватывался печенью, селезенкой и костным мозгом. Считается, что захват радиоактивной метки селезенкой, богатой макрофагами, является типичным для захвата железа ретикулоэндотелиальной системой.
После внутривенного введения однократной дозы препарата Венофер®, содержащей 100 мг железа, здоровым добровольцам максимальные суммарные концентрации железа в сыворотке достигались через 10 минут после инъекции, при этом средняя концентрация составляла 538 μ моль/л. Объем распределения центральной камеры полностью соответствовал объему плазмы (около 3 л).
Биотрансформация
После инъекции сахароза по большей части распадается, а многоядерное железосодержащее ядро захватывается преимущественно ретикулоэндотелиальной системой печени, селезенки и костного мозга. Через 4 недели после введения утилизация железа эритроцитами составляет от 59 до 97 %.
Выведение
Средняя молекулярная масса железо-сахарозного комплекса примерно равна 43 кДа, что достаточно много для предотвращения выведения через почки.
Выведение железа почками в первые 4 часа после инъекции дозы препарата Венофер®, содержащей 100 мг железа, составляло менее 5 % от введенной дозы. Через 24 часа суммарная концентрация железа в сыворотке снижалась до уровня перед введением. Выведение сахарозы почками составляло около 75 % от введенной дозы.
Показания к применению
Венофер® применяется для лечения железодефицитных состояний в следующих случаях:
- при клинической потребности в быстром восполнении запасов железа;
- у пациентов, которые не переносят пероральные препараты железа или не соблюдают режим лечения;
- при наличии активного воспалительного заболевания кишечника, когда пероральные препараты железа неэффективны.
Противопоказания
Применение препарата Венофер® противопоказано в следующих случаях:
- повышенная чувствительность к железо-сахарозному комплексу, раствору железосахарозного комплекса или к любому из компонентов данного лекарственного препарата;
- анемия, не обусловленная дефицитом железа;
- наличие признаков перегрузки железом или врожденные нарушения процессов его утилизации;
- I триместр беременности.
С осторожностью
Пациентам с бронхиальной астмой, экземой, поливалентной аллергией, аллергическими реакциями на иные парентеральные препараты железа и лицам, имеющим низкую железосвязывающую способность сыворотки и/или дефицит фолиевой кислоты Венофер® нужно назначать с осторожностью. Также осторожность требуется при введении препаратов железа пациентам с печеночной недостаточностью, с острыми или хроническими инфекционными заболеваниями и лицам, у которых повышены показатели ферритина сыворотки крови в связи с тем, что парентерально вводимое железо может оказывать неблагоприятное действие при наличии бактериальной или вирусной инфекции.
Применение во время беременности и в период грудного вскармливания
Умеренное количество данных по применению препарата Венофер® беременными женщинами во II и III триместрах беременности не выявило каких-либо угроз для матери или новорожденного.
Однако Венофер® следует применять во время II и III триместра беременности только тогда, когда потенциальная польза для матери превышает потенциальный риск для плода.
Применение препарата в первом триместре беременности противопоказано.
Результаты исследований на животных не выявили прямых или опосредованных вредных воздействий на течение беременности, развитие эмбриона/плода, роды или постнатальное развитие.
Количество данных по выделению железа с грудным молоком человека после внутривенного введения железо-сахарозного комплекса ограничено. В рамках небольшого клинического исследования здоровые, кормящие грудью матери с дефицитом железа получали 100 мг железа в виде железо-сахарозного комплекса. Через 4 дня после лечения содержание железа в грудном молоке не повышалось, и разницы в сравнении с контрольной группой (n=5) не наблюдалось. Нельзя исключить тот факт, что железо из препарата Венофер® может поступать новорожденному/младенцу с молоком матери, поэтому следует проводить оценку соотношения риска и пользы.
Способ применения и дозы
Применение
Препарат Венофер® вводится только внутривенно: путем капельной инфузии, или медленной инъекции, или непосредственно в венозный участок диализной системы.
Перед использованием ампулы/флаконы следует осмотреть на предмет отсутствия осадка или повреждений. Использовать следует только ампулы/флаконы с однородным, не содержащим осадка раствором коричневого цвета.
Каждая ампула/флакон препарата Венофер® предназначены исключительно для одноразового использования. Любые остатки неиспользованного лекарственного препарата или его отходы следует утилизировать в соответствии с локальными требованиями.
Введение препарата Венофер® должно осуществляться под наблюдением медицинского персонала, имеющего опыт диагностики и лечения анафилактических реакций, в условиях специализированного отделения. Должна быть обеспечена возможность проведения противошоковой терапии, включающая 0,1 % раствор эпинефрина (адреналина), антигистаминные и/или кортикостероидные препараты. Тест-доза не является надежным прогностическим фактором развития в последующем реакций гиперчувствительности, в связи с чем ее предварительное введение не рекомендуется.
Во время введения препарата и непосредственно после введения пациенты должны находиться под наблюдением врача. При появлении первых признаков анафилактических реакций применение препарата должно быть немедленно прекращено.
Необходимо наблюдать за каждым пациентом в течение как минимум 30 минут после каждого введения препарата Венофер® в терапевтической дозе на предмет отсутствия нежелательных явлений.
Внутривенная капельная инфузия
Венофер® разводится только стерильным 0,9 % (масса/объем) раствором натрия хлорида (NaCl). Разведенный раствор должен быть прозрачным, коричневого цвета. Разведение следует производить непосредственно перед инфузией, а полученный раствор следует вводить следующим образом:
Разведение препарата до более низких концентраций железа недопустимо по причинам, связанным со стабильностью раствора.
Внутривенная инъекция
Венофер® может вводиться путем медленной внутривенной инъекции со скоростью 1 мл неразведенного раствора в минуту и его доза не должна превышать 10 мл (200 мг железа) на инъекцию.
Инъекция в венозный участок диализной системы
Венофер® можно вводить во время сеанса гемодиализа непосредственно в венозный участок диализной системы при соблюдении тех же условий, что и для внутривенной инъекции.
Дозы
Для каждого пациента следует индивидуально рассчитывать кумулятивную дозу препарата Венофер®, которую нельзя превышать.
Расчет дозы
Общая кумулятивная доза препарата Венофер®, эквивалентная общему дефициту железа (мг), определяется на основании содержания гемоглобина (Hb) и массы тела (МТ). Дозу препарата Венофер® следует индивидуально рассчитывать для каждого пациента в соответствии с общим дефицитом железа, рассчитанным по нижеприведенной формуле Ганзони, например:
Общий дефицит железа [мг] = масса тела [кг] х (целевое содержание гемоглобина -фактическое содержание гемоглобина) [г/л] х 0,24* + депонированное железо [мг]
При массе тела менее 35 кг: целевое содержание гемоглобина = 130 г/л, а количество депонированного железа = 15 мг/кг массы тела
При массе тела 35 кг и больше: целевое содержание гемоглобина = 150 г/л, а количество депонированного железа = 500 мг
* Коэффициент 0,24 = 0,0034 (содержание железа в гемоглобине = 0,34 %) х 0,07 (масса крови ~ 7 % от массы тела) х 1000 (перевод [г] в [мг])
Общее количество препарата Венофер®, которое следует ввести (в мл) = Общий дефицит железа [мг] / 20 мг железа/мл
Общее количество препарата Венофер® (мл), которое следует ввести, в зависимости от массы тела, фактического содержания гемоглобина и целевого содержания гемоглобина* :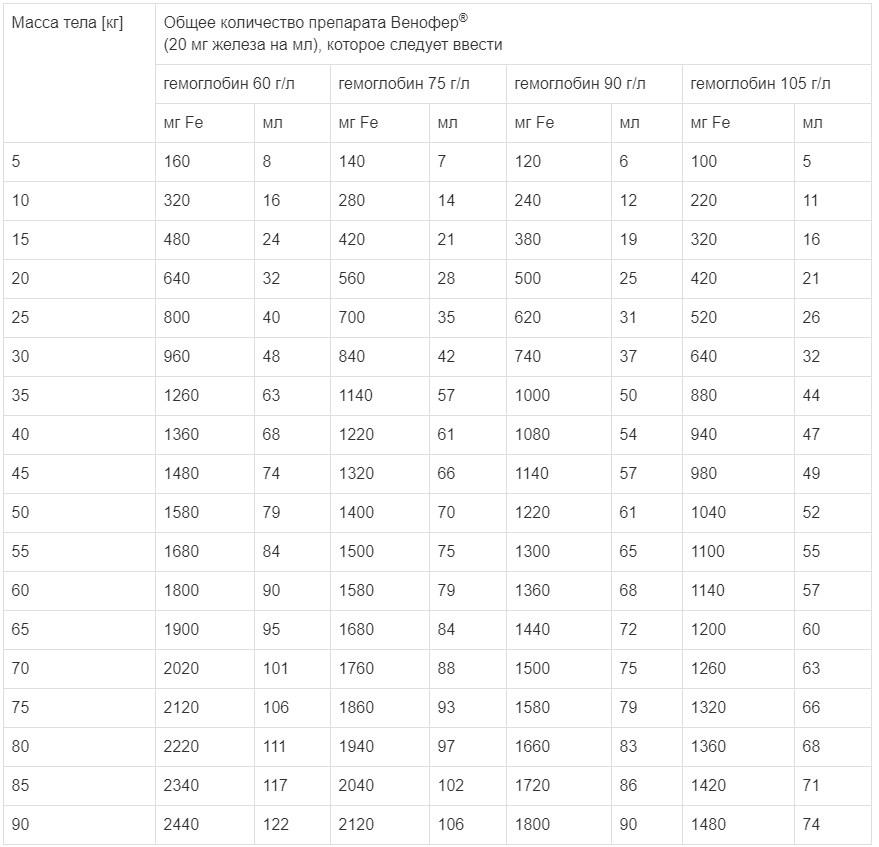
* При массе тела менее 35 кг: Целевое содержание гемоглобина = 130 г/л
При массе тела 35 кг и больше: Целевое содержание гемоглобина = 150 г/л
Для перевода гемоглобина (ммоль) в гемоглобин (г/л) умножьте первое значение на 16. Если общая необходимая доза превышает максимальную дозволенную однократную дозу, ее следует разделить на несколько введений.
Если через 1-2 недели не наблюдается ответа со стороны гематологических параметров, первоначальный диагноз следует пересмотреть.
Расчет дозы для восполнения запасов железа после кровопотери или при сдаче аутологичной крови
Дозу препарата Венофер®, необходимую для компенсации дефицита железа, можно рассчитать по следующим формулам:
Если количество потерянной крови известно: введение 200 мг железа (10 мл препарата Венофер®) должно приводить приблизительно к такому же повышению концентрации гемоглобина, что и переливание 1 порции крови (400 мл с концентрацией гемоглобина = 150 г/л).
Количество железа, которое необходимо восполнить [мг] = количество порций потерянной крови х 200 мг
или
Необходимый объем препарата Венофер® [мл] = количество порций потерянной крови х 10 мл
Если содержание гемоглобина ниже желаемого: формула предполагает, что депо железа пополнять не требуется.
Количество железа, которое необходимо восполнить [мг] = масса тела [кг] х 0,24 х (целевое содержание гемоглобина — фактическое содержание гемоглобина) [г/л]
Пример:
При массе тела = 60 кг и снижении содержания гемоглобина = 10 г/л
⇒≈150 мг железа необходимо восполнить
⇒ необходимо 7,5 мл препарата Венофер®
Максимальная переносимая разовая и недельная дозы указаны ниже в разделах «Стандартные дозы» и «Максимальная переносимая разовая и недельная дозы».
Стандартные дозы
Пациенты взрослого и пожилого возраста
5-10 мл препарата Венофер® (100-200 мг железа) 1-3 раза в неделю.
Время введения препарата и способ разведения указаны в разделе «Применение».
Дети
Имеется лишь умеренное количество данных о применении препарата у детей в рамках исследований. В случае клинической необходимости применения не рекомендуется превышать дозу 0,15 мл препарата Венофер® (3 мг железа) на кг массы тела не чаще 3 раз в неделю.
Время введения препарата и способ разведения указаны в разделе «Применение».
Максимально переносимая разовая и недельная дозы
Пациенты взрослого и пожилого возраста
Максимальная переносимая доза в сутки, вводимая в виде инъекции не чаще 3 раз в неделю:
- 10 мл препарата Венофер® (200 мг железа), вводимые в течение минимум 10 минут.
Максимальная переносимая доза в сутки, вводимая в виде инфузии не чаще 1 раза в неделю:
- Пациенты с массой тела более 70 кг: 500 мг железа (25 мл препарата Венофер®), вводимые в течение минимум 3,5 часов.
- Пациенты с массой тела 70 кг и менее: 7 мг железа/кг массы тела, вводимые в течение минимум 3,5 часов.
Следует строго придерживаться времени инфузии, указанного в разделе «Применение», даже если пациент не получил максимальной переносимой разовой дозы.
Побочное действие
Наиболее частой нежелательной лекарственной реакцией (НЛР), регистрировавшейся в рамках клинических исследований препарата Венофер®, являлось изменение вкусовых ощущений, которое наблюдалось с частотой 4,5 явления на 100 субъектов. Наиболее важными серьезными нежелательными лекарственными реакциями, связанными с применением препарата Венофер®, являлись реакции гиперчувствительности, которые наблюдались в рамках клинических исследований с частотой 0,25 явления на 100 субъектов.
В таблице ниже представлены нежелательные лекарственные реакции, зарегистрированные после применения препарата Венофер® в рамках клинических исследований, а также в пострегистрационном периоде.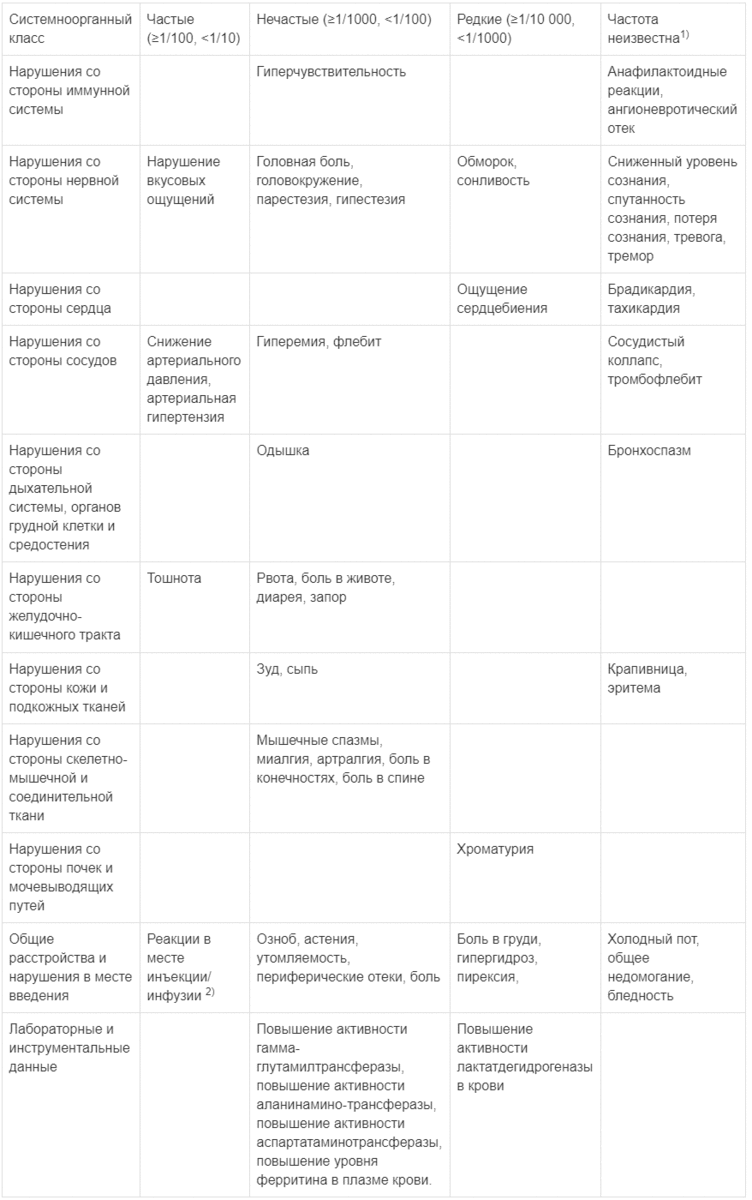
1)Спонтанные сообщения, полученные в пострегистрационном периоде
2)Наиболее частые: боль в месте инъекции/инфузии, экстравазация в месте инъекции/инфузии, раздражение в месте инъекции/инфузии, реакция в месте инъекции/инфузии, изменение окрашивания кожи в месте инъекции/инфузии, кровоподтек в месте инъекции/инфузии, зуд в месте инъекции/инфузии.
Передозировка
Передозировка может вызывать перегрузку железом, которая может проявляться симптомами гемосидероза. Передозировку следует лечить с использованием хелатирующего средства для связывания железа или в соответствии со стандартами медицинской практики.
Взаимодействие с другими лекарственными средствами
Как и при применении всех парентеральных препаратов железа, препарат Венофер® не рекомендуется применять одновременно с пероральными препаратами железа, поскольку всасывание перорального железа может снижаться, поэтому терапию пероральными препаратами железа следует начинать не ранее, чем через 5 дней после последней инъекции.
Венофер можно смешивать только со стерильным 0,9 % (масса/объем) раствором натрия хлорида. При смешивании с другими растворами или лекарственными препаратами имеется риск выпадения осадка и/или взаимодействия. Совместимость с контейнерами из других материалов, помимо стекла, полиэтилена и поливинилхлорида, не изучена.
Особые указания
Парентерально вводимые препараты железа могут вызывать аллергические или анафилактоидные реакции, которые потенциально могут быть летальными, поэтому в наличии должны иметься противоаллергические препараты, а также оборудование для проведения сердечно-легочной реанимации и соответствующих процедур. После предшествовавших неосложненных введений парентеральных комплексов железа также отмечались реакции гиперчувствительности. После каждой инъекции препарата Венофер® за всеми пациентами следует наблюдать на предмет отсутствия нежелательных явлений в течение как минимум 30 минут.
Пациентам, имеющим в анамнезе бронхиальную астму, экзему, другие виды атопических аллергий или аллергические реакции на другие парентеральные препараты железа, препарат Венофер® следует применять с осторожностью, поскольку такие пациенты в особенности могут иметь риск развития аллергической реакции.
Пациентам с нарушением функции печени парентеральное железо следует применять только после тщательной оценки соотношения риска и пользы. Пациентам с нарушением функции печени, когда перегрузка железом является провоцирующим фактором, не следует применять парентеральное железо. Для того чтобы избежать перегрузки железом, рекомендуется проводить тщательный мониторинг уровня железа в организме.
Парентеральное железо следует применять с осторожностью при наличии острой или хронической инфекции. Пациентам с бактериемией рекомендуется прекратить применение препарата Венофер®. У пациентов с хронической инфекцией следует провести оценку соотношения риска и пользы.
Следует избегать проникновения препарата в околовенозное пространство, поскольку это может привести к появлению боли, развитию воспаления и окрашиванию кожи в коричневый цвет. В случаях непреднамеренного проникновения препарата в околовенозное пространство лечение следует проводить в соответствии со стандартами медицинской практики.
Венофер® следует применять только в тех случаях, когда показание к применению подтверждено результатами соответствующих исследований (например, уровень ферритина в сыворотке, уровень насыщения трансферрина, содержание гемоглобина (Hb), эритроцитарные показатели — MCV, MCH, MCHC).
Срок годности после первого вскрытия контейнера
С микробиологической точки зрения, препарат следует использовать незамедлительно.
Срок годности после разведения 0,9 % раствором натрия хлорида (NaCl)
Химическая и физическая стабильность после разведения при комнатной температуре (15-25 °С) составляет 12 часов. Однако с микробиологической точки зрения, препарат следует использовать сразу после разведения. Если препарат не был использован сразу же после разведения, тот, кто использует данный раствор, несёт ответственность за условия и время хранения после разведения, которое в любом случае не должно превышать 3 часов при комнатной температуре, кроме тех случаев, когда разведение было выполнено в контролируемых и надлежащих асептических условиях.
Влияние на способность управлять транспортными средствами или работать с другими механизмами
Данных о влиянии на способность управлять транспортными средствами или работать с другими механизмами не имеется. Однако некоторые нежелательные реакции (такие, как головокружение, спутанность сознания и прочие (указаны в разделе «Побочное действие»)) могут оказывать негативное влияние на способность управлять транспортными средствами или работать с другими механизмами. Пациентам, у которых отмечаются данные нежелательные реакции, рекомендовано воздержаться от управления транспортными средствами или работы с другими механизмами до полного исчезновения данных симптомов.
Форма выпуска
Раствор для внутривенного введения 20 мг/мл.
По 5 мл препарата в бесцветные, прозрачные стеклянные ампулы (тип I по Евр. Ф.), имеющие насечку на шейке ампулы и технические цветные метки в виде одного или двух ободков и точки.
По 5 мл препарата в бесцветные, прозрачные стеклянные флаконы (тип I по Евр. Ф.), закрытые эластичной пробкой и алюминиевым колпачком с отрывным элементом.
По 5 ампул или флаконов в контурной ячейковой упаковке из поливинилхлорида вместе с инструкцией по применению упаковывают в картонную пачку.
Условия хранения
В оригинальной упаковке при температуре не выше 25 °С.
Препарат не подлежит замораживанию.
Хранить в местах, недоступных для детей.
Срок годности
3 года.
Не применять по истечении срока годности.
Условия отпуска
По рецепту.
Юридическое лицо, на имя которого выдано регистрационное удостоверение / Компания, осуществляющая выпускающий контроль качества
Вифор (Интернэшнл) Инк.
Рехенштрассе 37, 9014 Ст. Галлен, Швейцария
Vifor (International) Inc.
Rechenstrasse 37, 9014 St. Gallen, Switzerland
Производитель
БИПСО ГмбХ, Роберт-Гервиг-Штрассе 4, 78224 Зинген, Германия
(BIPSO GmbH, Robert-Gerwig-Strasse 4, 78224 Singen, Germany)
АйДиТи Биологика ГмбХ, Ам Фармапарк, 06861 Дессау-Росслау, Германия
(IDT Biologika GmbH, Am Pharmapark, 06861 Dessau-Rosslau, Germany)
Организация, принимающая претензии потребителей
ООО «Такеда Фармасьютикалс»
119048, г. Москва, ул. Усачева, д. 2, стр. 1
Купить Венофер в Планета Здоровья
Купить Венофер в ГорЗдрав
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Венофер®
МНН: Железа (III) гидроксид сахарозный комплекс
Производитель: ИДТ Биологика ГмбХ
Анатомо-терапевтическо-химическая классификация: Saccharated iron oxide
Номер регистрации в РК:
№ РК-ЛС-5№122086
Информация о регистрации в РК:
16.02.2016 — 16.02.2021
- Скачать инструкцию медикамента
Торговое название
Венофер®
Международное непатентованное название
Нет
Лекарственная форма
Раствор для внутривенного введения 20 мг/мл
Состав
1 мл препарата содержит
активное вещество – железо (III) 20 мг
(в виде железа (III) гидроксида сахарозного комплекса 510–570 мг) вспомогательные вещества: натрия гидроксид (10% раствор), вода для инъекций.
Описание
Водный раствор коричневого цвета
Фармакотерапевтическая группа
Антианемические препараты. Препараты железа. Препараты железа для парентерального применения. Сахарат оксида железа.
Код АТХ В03АС02
Фармакологические свойства
Фармакокинетика
Распределение
Феррокинетику железо-сахарозного комплекса, меченного 52Fe и 59Fe, оценивали у 6 пациентов с анемией и хронической почечной недостаточностью. В течение первых 6–8 часов 52Fe захватывался печенью, селезенкой и костным мозгом. Считается, что захват радиоактивной метки богатой макрофагами селезенкой является характерным для захвата железа ретикулоэндотелиальной системой.
После однократной внутривенной инъекции здоровым добровольцам дозы железо-сахарозного комплекса, содержащей 100 мг железа, максимальные общие концентрации железа в сыворотке были зарегистрированы через 10 минут после инъекции и составляли в среднем 538 мкмоль/л. Объем распределения в центральном компартменте точно соответствовал объему плазмы (примерно 3 литрам).
Биотрансформация
После инъекции большая часть сахарозы диссоциирует, и многоядерное железосодержащеее ядро захватывается главным образом ретикулоэндотелиальной системой печени, селезенки и костного мозга. Через 4 недели после введения утилизация эритроцитами составляла от 59 до 97%.
Выведение
Средняя молекулярная масса (ММ) железо-сахарозного комплекса примерно равна 43 кДа, что достаточно много для предотвращения выведения почками. Выведение железа почками, происходящее в течение первых 4 часов после инъекции дозы Венофера®, содержащей 100 мг железа, соответствовало менее чем 5% от введенной дозы. Через 24 часа общая концентрация железа в сыворотке снижалась до уровня, отмеченного до введения препарата. Выведение сахарозы почками составляло примерно 75% от введенной дозы.
Фармакодинамика
Механизм действия
Активный компонент препарата Венофер® — железо-сахарозный комплекс — состоит из многоядерного ядра гидроксида железа(III), окруженного большим количеством нековалентно связанных молекул сахарозы. Средняя молекулярная масса (ММ) этого комплекса примерно равна 43 кДа. Структура многоядерного железосодержащего ядра сходна со структурой ядра белка ферритина – физиологического депо железа. Этот комплекс предназначен для создания управляемого источника утилизируемого железа для белков, отвечающих за транспорт и депонирование железа в организме (соответственно трансферрина и ферритина).
После внутривенного введения многоядерное железосодержащее ядро, входящее в состав данного комплекса, захватывается главным образом ретикулоэндотелиальной системой печени, селезенки и костного мозга. На следующем этапе железо используется для синтеза гемоглобина, миоглобина и других железосодержащих ферментов, либо депонируется преимущественно в печени в форме ферритина.
Показания к применению
Венофер® предназначен для лечения железодефицитных состояний в следующих ситуациях:
-
при потребности в быстром восполнении запасов железа
-
у пациентов, которые не переносят пероральные препараты железа или не соблюдают режим лечения
-
при наличии активных воспалительных заболеваний кишечника, когда пероральные препараты железа неэффективны.
Венофер® следует применять только в тех случаях, когда показание к применению подтверждено результатами соответствующих лабораторных исследований.
Способ применения и дозы
Способ применения
Венофер® вводится только внутривенно. Он может вводиться путем капельной инфузии, медленной инъекции или непосредственно в венозный участок диализной системы. Препарат не предназначен для внутримышечного введения.
Внутривенная капельная инфузия
Венофер® разводится только стерильным 0,9% раствором натрия хлорида (NaCl) (масса/объем). Разведение следует производить непосредственно перед инфузией, а полученный раствор следует вводить следующим образом:
|
Доза препарата Венофер® (мг железа) |
Доза препарата Венофер® (мл препарата Венофер) |
Максимальный объем стерильного 0,9% раствора NaCl для разведения (масса/объем) |
Минимальное время инфузии |
|
100 мг |
5 мл |
100 мл |
15 минут |
|
200 мг |
10 мл |
200 мл |
30 минут |
|
300 мг |
15 мл |
300 мл |
1,5 часа |
|
400 мг |
20 мл |
400 мл |
2,5 часа |
|
500 мг |
25 мл |
500 мл |
3,5 часа |
Разведение препарата до более низких концентраций железа недопустимо.
Внутривенная инъекция
Венофер® может вводиться путем медленной внутривенной инъекции со скоростью 1 мл неразведенного раствора в минуту и его доза не должна превышать 10 мл (200 мг железа) на инъекцию в течение, по крайней мере, 10 минут.
Введение в венозный участок диализной системы
Венофер® можно вводить во время сеанса гемодиализа непосредственно в венозный участок диализной системы при соблюдении тех же условий, что и для внутривенной инъекции.
Доза
Для каждого пациента следует индивидуально рассчитывать кумулятивную дозу препарата Венофер®, которую нельзя превышать. График введения так же должен быть составлен индивидуально для каждого пациента.
Стандартные дозы
Взрослые
5–10 мл препарата Венофер® (100–200 мг железа) 1–3 раза в неделю, в зависимости от уровня гемоглобина.
Время введения препарата и способ разведения указаны в разделе «Способ применения».
Максимально переносимые разовая и недельная дозы:
Взрослые
Максимальная переносимая доза на сутки, вводимая в виде инъекции не чаще 3 раз в неделю:
-
10 мл препарата Венофер® (200 мг железа), вводимые в течение минимум 10 минут
Максимальная переносимая доза в сутки, вводимая в виде инфузии не чаще одного раза в неделю:
-
Пациенты с массой тела более 70 кг: 500 мг железа (25 мл препарата Венофер®), вводимые в течение минимум 3,5 часов
-
Пациенты с массой тела 70 кг и менее: 7 мг железа/кг массы тела, вводимые в течение минимум 3,5 часов
Следует строго придерживаться времени инфузии, указанного в подразделе «Способ применения», даже если пациент не получает максимальной переносимой разовой дозы.
Расчет дозировки
Общая кумулятивная доза препарата Венофер®, эквивалентная общему дефициту железа (мг), определяется на основании уровня гемоглобина (Hb) и массы тела (МТ). Дозу препарата Венофер® следует индивидуально рассчитывать для каждого пациента в соответствии с общим дефицитом железа, рассчитанным по нижеприведенной формуле Ганзони, например:
|
Общий дефицит железа [мг] = масса тела [кг] × (целевой уровень Hb – фактический уровень Hb) [г/дл] х 2,4* + депонированное железо [мг] |
||
|
При массе тела менее 35 кг: |
Целевой уровень Hb = 13 г/дл, количество депонированного железа = 15 мг/кг массы тела |
|
|
При массе тела 35 кг и более: |
Целевой уровень Hb = 15 г/дл, количество депонированного железа = 500 мг |
|
|
* Коэффициент 2,4 = 0,0034 (содержание железа в Hb = 0,34%) × 0,07 (объем крови = 7% от массы тела) × 1000 (перевод из [г] в [мг]) × 10 |
||
|
Общее количество препарата Венофер®, которое следует = ввести (в мл) |
Общий дефицит железа [мг] 20 мг железа/мл |
Общее количество препарата Венофер® (мл), которое следует ввести, в зависимости от массы тела, фактического уровня Hb и целевого уровня Hb*:
|
МТ |
Общее количество препарата Венофер® (20 мг железа на мл), которое следует ввести: |
|||||||
|
Hb 6,0 г/дл |
Hb 7,5 г/дл |
Hb 9,0 г/дл |
Hb 10,5 г/дл |
|||||
|
мг Fe |
мл |
мг Fe |
мл |
мг Fe |
мл |
мг Fe |
мл |
|
|
30 кг |
960 |
48 |
840 |
42 |
740 |
37 |
640 |
32 |
|
35 кг |
1260 |
63 |
1140 |
57 |
1000 |
50 |
880 |
44 |
|
40 кг |
1360 |
68 |
1220 |
61 |
1080 |
54 |
940 |
47 |
|
45 кг |
1480 |
74 |
1320 |
66 |
1140 |
57 |
980 |
49 |
|
50 кг |
1580 |
79 |
1400 |
70 |
1220 |
61 |
1040 |
52 |
|
55 кг |
1680 |
84 |
1500 |
75 |
1300 |
65 |
1100 |
55 |
|
60 кг |
1800 |
90 |
1580 |
79 |
1360 |
68 |
1140 |
57 |
|
65 кг |
1900 |
95 |
1680 |
84 |
1440 |
72 |
1200 |
60 |
|
70 кг |
2020 |
101 |
1760 |
88 |
1500 |
75 |
1260 |
63 |
|
75 кг |
2120 |
106 |
1860 |
93 |
1580 |
79 |
1320 |
66 |
|
80 кг |
2220 |
111 |
1940 |
97 |
1660 |
83 |
1360 |
68 |
|
85 кг |
2340 |
117 |
2040 |
102 |
1720 |
86 |
1420 |
71 |
|
90 кг |
2440 |
122 |
2120 |
106 |
1800 |
90 |
1480 |
74 |
|
*При массе тела менее 35 кг: |
Целевой уровень Hb = 13 г/дл |
|
При массе тела 35 кг и более: |
Целевой уровень Hb = 15 г/дл |
Для перевода Hb (ммоль) в Hb (г/дл), умножьте первое значение на 1,6.
Если общая необходимая доза превышает максимальную дозволенную однократную дозу, ее следует разделить на несколько введений.
Если через 1–2 недели после начала лечения препаратом Венофер® не наблюдается ответа со стороны гематологических параметров, первоначальный диагноз следует пересмотреть.
Дети
Применение препарата Венофер® детьми достаточно не изучено, поэтому его не рекомендуется применять детям.
Побочные действия
Наиболее частой нежелательной лекарственной реакцией (НЛР), регистрировавшейся в рамках клинических исследований препарата Венофер®, являлось изменение вкусовых ощущений, которое наблюдалось с частотой 4,5 явления на 100 субъектов. Наиболее важными серьезными нежелательными лекарственными реакциями, связанными с применением препарата Венофер®, являлись реакции гиперчувствительности, которые наблюдались в рамках клинических исследований с частотой 0,25 явления на 100 субъектов.
Ниже представлены нежелательные лекарственные реакции, зарегистрированные после применения препарата Венофер® у 4046 субъектов в рамках клинических исследований.
Часто (≥1/100, <1/10)
-
нарушение вкусовых ощущений
-
артериальная гипотензия, артериальная гипертензия
-
тошнота
-
боль в месте инъекции
Нечасто (≥1/1000, <1/100)
-
полицитемия1)
-
повышенная чувствительность
-
головная боль, головокружение, чувство жжения, парестезия, гипестезия
-
тромбофлебит, флебит
-
одышка
-
хроматурия
-
рвота, боль в животе, диарея, запор
-
зуд, сыпь
-
мышечные судороги, миалгия, артралгия, боль в конечностях, боль в спине
-
озноб, реакции в месте инъекции, раздражение в месте инъекции, экстравазация в месте инъекции, изменение цвета кожи в месте инъекции, чувство жжения в месте инъекции, отек в месте инъекции, астения, утомляемость, боль
Редко (≥1/10 000, <1/1000)
-
пневмония
-
перегрузка железом
-
обморок, мигрень, сонливость
-
ощущение сердцебиения
-
гиперемия
-
сухость во рту
-
ощущение дискомфорта в конечностях, мышечные спазмы
-
чувство жара, боль в груди, пирексия, отек, зуд в месте инъекции, кровоподтек в месте инъекции
-
периферический отек
Патологические изменения лабораторных параметров
Нечасто (≥1/1000, <1/100)
-
повышение уровня гамма-глутамилтрансферазы, повышение уровня аланинаминотрансферазы, повышение уровня аспартатаминотрансферазы, патологические изменения в результатах печеночных проб
Редко (≥1/10 000, <1/1000)
-
повышение уровня ферритина в сыворотке1), повышение уровня креатинина в крови, повышение уровня лактатдегидрогеназы в крови
1) Возможно, как последствие передозировки железом или перегрузки железом
Побочные реакции, наблюдавшиеся в пострегистрационном периоде, некоторые из которых потенциально могут привести к летальному исходу
Частота неизвестна:
-
анафилактоидные реакции, ангионевротический отек
-
сниженный уровень сознания, спутанность сознания, потеря сознания, тревога, тремор
-
брадикардия, тахикардия
-
сосудистый коллапс, тромбоз поверхностных вен
-
бронхоспазм
-
крапивница, эритема
-
гипотония мышц
-
гипергидроз, холодный пот, общее недомогание, бледность
Противопоказания
-
повышенная чувствительность к железо-сахарозному комплексу, препарату Венофер® или какому-либо из вспомогательных веществ, перечисленных в разделе «Состав»
-
известная гиперчувствительность к другим парентеральным препаратам железа
-
анемия, не связанная с дефицитом железа
-
наличие признаков перегрузки железом или врожденные нарушения процессов его утилизации
-
первый триместр беременности
Лекарственные взаимодействия
Как и при применении всех парентеральных препаратов железа, препарат Венофер® не рекомендуется применять одновременно с пероральными препаратами железа, поскольку всасывание перорального железа может снижаться.
Венофер® разводится только стерильным 0,9% раствором натрия хлорида (масса/объем). При смешивании с другими растворами или лекарственными препаратами имеется риск преципитации и/или взаимодействия. Совместимость с контейнерами из других материалов, помимо стекла, полиэтилена и поливинилхлорида, не изучена.
Особые указания
Лечение препаратом Венофер® следует назначать только после тщательной постановки диагноза лечащим врачом.
Парентерально вводимые препараты железа могут вызывать анафилактические/анафилактоидные реакции, которые потенциально могут быть летальными. После предшествовавших неосложненных введений парентеральных комплексов железа, в том числе железо-сахарозного комплекса, также отмечались реакции повышенной чувствительности. Пациентов необходимо активно опрашивать перед каждым введением Венофера® относительно побочных действий препарата. Венофер® должен использоваться персоналом, обученным на выявление и купирование анафилактических реакций, в наличии должны иметься противоаллергические препараты, а также оборудование для проведения сердечно-легочной реанимации и соответствующие процедуры. После каждой инъекции препарата Венофер® за всеми пациентами следует наблюдать на предмет отсутствия нежелательных явлений в течение минимум 30 минут.
В случае развития аллергической реакции лечение должно быть немедленно прекращено. Должна быть обеспечена возможность проведения противошоковой терапии (0,1% раствор адреналина, антигистаминные и/или кортикостероидные препараты).
Риск реакций гиперчувствительности повышается у пациентов с известными аллергиями, включая лекарственную аллергию, у пациентов с бронхиальной астмой, экземой или другими атопическими аллергическими реакциями. Также увеличен риск реакций гиперчувствительности на парентеральные комплексы железа у пациентов с иммунологическими и воспалительными заболеваниями (например, системная красная волчанка, ревматоидный артрит).
Пациентам с нарушением функции печени парентеральное железо следует применять только после тщательной оценки соотношения между риском и пользой. Пациентам с нарушением функции печени, когда перегрузка железом является провоцирующим фактором, в особенности, развития поздней порфирии кожи, не следует применять парентеральное железо. Для того чтобы избежать перегрузки железом, рекомендуется проводить тщательный мониторинг уровня железа в организме.
Парентеральное железо следует применять с осторожностью при наличии острой или хронической инфекции. Пациентам с продолжающейся бактериемией рекомендуется прекратить применение препарата Венофер®. У пациентов с хронической инфекцией следует провести оценку соотношения между риском и пользой, учитывая возможность подавления эритропоэза.
Могут развиться эпизоды гипотензии, в случае, если препарат вводится слишком быстро. Аллергические реакции, иногда включая артралгию, наблюдались чаще при превышении рекомендуемой дозы. Следует избегать околовенозной утечки, поскольку утечка препарата Венофер® в месте инъекции может приводить к появлению боли, развитию воспаления, некроза тканей и окрашиванию кожи в коричневый цвет.
Особенности применения после первого вскрытия контейнера
С микробиологической точки зрения, препарат следует использовать незамедлительно.
Особенности применения после разведения 0,9% раствором натрия хлорида (NaCl) (масса/объем)
Было показано, что химическая и физическая стабильность после разведения составляет 12 часов при комнатной температуре. С микробиологической точки зрения, препарат следует использовать незамедлительно. Если препарат не был использован сразу же после разведения, пользователь несет ответственность за условия и время хранения после разведения, которое в любом случае не должно превышать 3 часов при комнатной температуре, кроме тех случаев, когда разведение было выполнено в контролируемых и валидированных асептических условиях.
Применение во время беременности и кормления грудью
Период беременности
Должным образом контролируемые исследования применения Венофер® у беременных женщин до настоящего времени не проводились. Аллергические реакции на парентеральные препараты железа, развившиеся во время беременности, подвергают опасности жизнь матери и ребенка. Препараты железа для внутривенного введения не должны использоваться во время беременности, если в этом нет крайней необходимости. Венофер® следует применять во втором и третьем триместрах беременности только тогда, когда потенциальная польза для матери перевешивает потенциальный риск для плода.
Применение препарата в первом триместре беременности противопоказано.
Результаты исследований на животных не выявили прямых или опосредованных вредных воздействий на беременность, развитие эмбриона/плода, роды или постнатальное развитие. Данные, полученные у ограниченного числа беременных женщин, указывают на отсутствие неблагоприятного действия Венофера® на беременность или здоровье плода/новорожденного.
Период лактации
Количество данных по выделению железа с грудным молоком человека после внутривенного введения железо-сахарозного комплекса ограничено. В рамках одного клинического исследования 10 здоровых, кормящих грудью матерей с дефицитом железа получали 100 мг железа в виде железо-сахарозного комплекса. Через 4 дня после лечения содержание железа в грудном молоке не повышалось, и разницы в сравнении с контрольной группой (n=5) не наблюдалось. Нельзя исключить тот факт, что железо из препарата Венофер® может поступать к новорожденному/младенцу с молоком матери, поэтому препарат следует назначать с осторожностью с учетом оценки соотношения между риском и пользой.
Результаты доклинических исследований не выявили прямых или опосредованных вредных воздействий на ребенка, находящегося на грудном вскармливании. У лактирующих крыс, которым вводили меченный 59Fe железо-сахарозный комплекс, наблюдалась низкая степень секреции железа в молоко и передачи железа потомству. Поступление неметаболизированного железо-сахарозного комплекса в грудное молоко маловероятно.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Маловероятно, что препарат Венофер® может влиять на способность управлять транспортными средствами или работать с другими автоматизированными системами. Однако при развитии после применения препарата Венофер® таких симптомов, как головокружение, спутанность сознания или полуобморочное состояние, пациенты не должны управлять транспортными средствами или работать с другими автоматизированными системами до исчезновения этих симптомов.
Передозировка
Симптомы: передозировка может вызывать перегрузку железом, которая сама по себе может проявляться симптомами гемосидероза.
Лечение: передозировку следует лечить, на усмотрение лечащего врача, с использованием хелатора железа или в соответствии со стандартами медицинской практики.
Форма выпуска и упаковка
По 5 мл препарата помещают в бесцветные прозрачные стеклянные ампулы, имеющие насечку в виде одного или двух ободков и точки на шейке ампулы.
По 5 ампул помещают в контурную ячейковую упаковку из поливинилхлорида.
1 упаковку вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную коробку.
Условия хранения
Хранить при температуре не выше 25 °С. Препарат не подлежит замораживанию!
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Производитель
ИДТ Биологика ГмбХ, Германия
Am Pharmapark, 06861 Dessau-Rosslau, Germany/
Ам Фармапарк, 06861 Дессау-Рослау, Германия
Владелец регистрационного удостоверения и выпускающий контроль качества
Вифор (Интернэшнл) Инк., Швейцария
Rechenstrasse 37, 9014 St. Gallen, Switzerland /
Рехенштрассе 37, 9014 Санкт-Галлен, Швейцария
Адрес организации, принимающей претензии от потребителей по качеству продукции (товара) на территории Республики Казахстан
Представительство компании «Takeda Osteuropa Holding GmbH» (Австрия) в Казахстане
Алматы, ул. Шашкина 44
Телефон: (727) 2444004
Факс: (727) 2444005
Адрес электронной почты: DSO-KZ@takeda.com
| 339936831477976278_ru.doc | 147.5 кб |
| 389096171477977463_kz.doc | 137.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники