Бринэвис
МНН: Вернакалант
Производитель: Гамельн Фармасьютикалс ГмбХ
Анатомо-терапевтическо-химическая классификация: Вернакалант
Номер регистрации в РК:
№ РК-ЛС-5№019985
Информация о регистрации в РК:
28.06.2013 — 28.06.2018
- Скачать инструкцию медикамента
Торговое название
Бринэвис
Международное непатентованное название
Вернакалант
Лекарственная форма
Концентрат для приготовления раствора для инфузий, 20 мг/мл
Состав
1 мл концентрата содержит
активное вещество: вернакаланта гидрохлорид 20 мг,
вспомогательные вещества: лимонной кислоты моногидрат, натрия хлорид, натрия гидроксид, вода для инъекций.
Описание
Прозрачная бесцветная жидкость без видимых механических включений.
Фармакотерапевтическая группа
Препараты для лечения заболеваний сердца. Антиаритмические препараты I и III классов. Прочие антиаритмические препараты I класса. Вернакалант.
Код АТХ C01BG11
Фармакологические свойства
Фармакокинетика
Всасывание. У пациентов средние максимальные концентрации вернакаланта в плазме крови составили 3,9 мкг/мл после однократной 10-минутной инфузии вернакаланта гидрохлорида в дозе 3 мг/кг и 4,3 мкг/мл после второй инфузии в дозе 2 мг/кг с 15‑минутным интервалом между введениями.
Распределение Вернакалант экстенсивно и быстро распределяется в организме; объем распределения составляет приблизительно 2 л/кг. Показатели Сmax и AUC были пропорциональными дозе при дозировке в диапазоне 0,5 мг/кг – 5 мг/кг. У пациентов типичный общий клиренс вернакаланта из организма составляет 0,41 л/ч/кг. Свободная фракция вернакаланта в сыворотке крови человека составляет 53 – 63% в диапазоне концентрации 1 – 5 мкг/мл.
Выведение/выделение. Вернакалант преимущественно выводится путем О‑деметилирования, опосредованного CYP2D6 у пациентов с экстенсивным метаболизмом CYP2D6. У пациентов с медленным метаболизмом CYP2D6 основными механизмами выведения являются глюкуронидация и выведение почками. Средний период полувыведения вернакаланта составляет приблизительно 3 часа у пациентов с быстрым метаболизмом CYP2D6 и около 5,5 часа у пациентов с медленным метаболизмом CYP2D6.
Отдельные группы пациентов
Пол, застойная сердечная недостаточность в анамнезе, нарушение функции почек в анамнезе, одновременное применение бета-блокаторов и других препаратов, в том числе варфарина, метопролола, фуросемида и дигоксина, не оказывают значительного влияния на фармакокинетику Бринэвиса. У пациентов с нарушением функции печени экспозиция повышается на 9–25%. Нет необходимости в коррекции дозы препарата Бринэвис при указанных выше состояниях, а также в зависимости от возраста, уровней креатинина сыворотки крови или скорости метаболизма CYP2D6.
Фармакодинамика
Механизм действия. Вернакалант – антиаритмический препарат, который действует преимущественно на предсердия, увеличивая продолжительность рефрактерного периода предсердий и частотно-зависимо замедляя проводимость импульсов. Считается, что это антифибрилляционное влияние на рефрактерность и проводимость подавляет механизм возбуждения, усиливает действие на предсердие во время фибрилляции предсердий. Предполагается, что относительная селективность действия вернакаланта на рефрактерный период предсердий, а не желудочков, возникает благодаря блокированию токов в предсердиях, но не в желудочках, а также вследствие уникального электрофизиологического состояния фибриллирующего предсердия. Однако была зарегистрирована блокада катионных токов, в том числе каналов hERG и потенциалозависимых натриевых каналов, присутствующих в желудочках.
Вернакалант блокирует токи во всех фазах предсердного потенциала действия, в том числе калиевые токи, которые специфически проявляются в предсердиях (например, воздействуя на сверхбыстрые компоненты замедленного выпрямляющего и ацетилхолин-зависимого калиевого тока). Во время фибрилляции предсердий частотно- и потенциалзависимая блокада натриевых каналов в дальнейшем фокусирует действие препарата относительно быстро активирующейся и частично деполяризированной ткани предсердия, а не относительно биения желудочков нормальной поляризации, частота сокращений которых ниже. Дополнительно, способность вернакаланта блокировать поздний компонент натриевого тока ограничивает влияние на реполяризацию желудочков, вызываемую блокадой калиевых токов в желудочке. Направленное действие на ткани предсердия в сочетании с блокированием позднего натриевого тока предполагает низкий проаритмический потенциал вернакаланта. В целом, комбинация действия вернакаланта на калиевые и натриевые токи приводит к значительному антиаритмическому эффекту, который, главным образом, концентрируется в предсердиях.
В исследованиях электрофизиологии у пациентов вернакалант дозозависимо пролонгировал эффективный рефрактерный период предсердий, что не ассоциировалось с существенным увеличением эффективного рефрактерного периода желудочков.
Показания к применению
Быстрое восстановление синусового ритма при недавно возникшей фибрилляции предсердий у взрослых:
-
у пациентов, не подвергавшихся оперативному вмешательству: при длительности фибрилляции предсердий ≤ 7 дней
-
у пациентов, перенесших операцию на сердце: при длительности фибрилляции предсердий ≤ 3 дней
Способ применения и дозы
Бринэвис следует вводить в виде внутривенной инфузии, в контролируемых клинических условиях, приспособленных для проведения кардиоверсии. Инфузию препарата Бринэвис должен проводить только квалифицированный медицинский персонал, а во время инфузии и, по крайней мере, в течение 15 минут после окончания проведения инфузии следует часто контролировать состояние пациента относительно появления признаков и симптомов внезапного снижения артериального давления или уменьшения частоты сердечных сокращений.
Дозировка
Дозу препарата Бринэвис рассчитывают по массе тела пациента, максимальный вес для расчета дозы соответствует 113 кг.
Рекомендованная доза начальной инфузии составляет 3 мг/кг в течение 10 минут. Для пациентов с массой тела ≥ 113 кг максимальная начальная доза не должна превышать 339 мг (84,7 мл раствора в концентрации 4 мг/мл). Если конверсия в синусовый ритм не произошла в течение 15 минут после окончания начальной инфузии, можно выполнить повторную инфузию в дозе 2 мг/кг в течение 10 минут. Для пациентов с массой тела ≥ 113 кг максимальная повторная доза не должна превышать 226 мг (56,5 мл раствора в концентрации 4 мг/мл). Суммарная доза в течение 24 часов не должна превышать 5 мг/кг. Нет клинических данных о введении повторных доз после первой и второй инфузии. Через 24 часа уровни вернакаланта становятся незначительными.
Если конверсия в синусовый ритм произошла во время первой или второй инфузии, инфузию следует завершить. Если наблюдается гемодинамически стабильное трепетание предсердий после первой инфузии, можно выполнить повторную инфузию препарата Бринэвис, поскольку у пациентов возможна конверсия в синусовый ритм.
Для введения препарата предпочтительно использовать инфузионную помпу. Однако можно применять и шприцевую помпу, при условии, что рассчитанный объем будет введен на протяжении указанного времени.
Не вводить внутривенно струйно или болюсно.
В качестве растворителя рекомендовано использовать 0,9 % раствор натрия хлорида для инъекций, раствор Рингера с лактатом для инъекций или 5 % глюкозу для инъекций.
Перед введением препарата необходимо ознакомиться со всеми этапами приготовления к проведению инфузии.
Приготовление препарата Бринэвис для инфузии
Этап 1: Перед применением флаконы препарата Бринэвис проверьте визуально на присутствие механических примесей и изменение цвета. Нельзя использовать флаконы с признаками механических примесей или изменения цвета.
Примечание. Концентрат Бринэвис для приготовления раствора для инфузий имеет цвет от бесцветного до бледно-желтого. Оттенки цвета в данном диапазоне не влияют на активность препарата.
Этап 2: Разведение концентрата. Для гарантии правильного введения необходимо приготовить достаточное количество препарата Бринэвис в концентрации 20 мг/мл перед началом терапии для проведения первой или второй инфузии, если она понадобится.
Необходимо приготовить раствор в концентрации 4 мг/мл в соответствии с указанными ниже инструкциями:
Пациенты с массой тела ≤100 кг: 25 мл препарата Бринэвис в концентрации 20 мг/мл добавить к 100 мл растворителя.
Пациенты весом >100 кг: 30 мл препарата Бринэвис в концентрации 20 мг/мл добавить к 120 мл растворителя.
Этап 3: Осмотр раствора. Разведенный стерильный раствор должен быть прозрачным от бесцветного до бледно-желтого цвета. Перед использованием визуально еще раз проверьте раствор на присутствие механических примесей и изменение цвета.
Способ применения.
Флаконы препарата Бринэвис предназначены только для одноразового использования; препарат должен быть разведен перед применением. Разведенный стерильный концентрат химически и физически стабилен в течение 12 часов при температуре не выше 25° C.
С микробиологической точки зрения препарат следует использовать немедленно. Если препарат не используется немедленно, за сроки и условия хранения препарата ответственность несет потребитель, и они не должны превышать 24 часа при температуре 2–8° С, за исключением случаев, когда разведение препарата проводится в контролируемых и валидированных асептических условиях.
Этап 4: Проведение первой инфузии.
Первую инфузию препарата Бринэвис в дозе 3 мг/кг проводят в течение 10 минут. На протяжении этого периода состояние пациента следует тщательно наблюдать относительно появления признаков и симптомов внезапного снижения артериального давления или уменьшения частоты сердечных сокращений. Если появляются такие признаки (с/без симптоматической артериальной гипотензии или брадикардии), инфузию следует немедленно прекратить.
Этап 5: Наблюдение за состоянием пациента. Если конверсия в синусовый ритм не произошла, следует проводить наблюдение основных показателей жизненно-важных функций организма и сердечного ритма пациента в течение дополнительных 15 минут.
Этап 6: Проведение второй инфузии. Если конверсия в синусовый ритм не произошла при проведении первой инфузии или в течение 15 минут наблюдения, проводят вторую инфузию в дозе 2 мг/кг в течение 10 минут.
Суммарные дозы свыше 565 мг не изучались.
Пациенты, перенесшие операцию на сердце
Нет необходимости в коррекции дозы.
Нарушение функции почек
Нет необходимости в коррекции дозы.
Нарушение функции печени
Нет необходимости в коррекции дозы.
Пациенты пожилого возраста (≥ 65 лет).
Нет необходимости в коррекции дозы.
Дети
Не рекомендуется применять препарат у детей младше 18 лет, в связи недостаточностью данных об эффективности и безопасности в данной возрастной группе.
Побочные действия
Частота возникновения побочных эффектов определенная как очень часто ≥ 1/10, часто ≥ 1/100 < 1/10, нечасто ≥ 1/1000 < 1/100
Расстройства нервной системы
Очень часто: дисгевзия
Часто: парестезия; головокружение; гипестезия
Нечасто: чувство жжения; паросмия; сонливость; вазовагальный обморок
Расстройства зрения
Нечасто: раздражение слизистой оболочки глаз; увеличение слезоотделения; нарушение зрения
Расстройства сердечной деятельности
Часто: брадикардия; трепетание предсердий
Нечасто: блокада синусового узла; полная АV блокада; AV блокада первой степени; блокада левой ножки пучка Гиса; блокада правой ножки пучка Гиса; желудочковые экстрасистолы; трепетания; синусовая брадикардия; желудочковая тахикардия; удлиненный комплекс QRS на ЭКГ; пролонгация QT на ЭКГ; кардиогенный шок
Сосудистые расстройства
Часто: гипотензия
Нечасто: приливы крови; бледность, повышение диастолического артериального давления
Респираторные, торакальные и медиастинальные расстройства
Очень часто: чихание
Часто: кашель; дискомфорт в носу
Нечасто: диспноэ; асфиксия; ринорея; першение в горле; ощущение удушья; заложенность носа
Желудочно-кишечные расстройства
Часто: тошнота; рвота; оральная парестезия
Нечасто: сухость во рту; оральная гипестезия, диарея; позывы к дефекации;
Расстройства кожи и подкожной ткани
Часто: зуд; гипергидроз
Нечасто: генерализованный зуд; холодный пот
Расстройства скелетно-мышечной и соединительной ткани
Нечасто: боль в конечностях
Расстройства общего характера и состояние места ввода препарата
Часто: боль в месте введения препарата; жар
Нечасто: раздражение, гиперчувствительность, парестезия; чувство дискомфорта; чувство дискомфорта в груди; утомляемость
Противопоказания
-
повышенная чувствительность к активному веществу или любому другому компоненту препарата
-
пациенты с тяжелым аортальным стенозом, пациенты с систолическим давлением < 100 мм рт. ст. и пациенты с сердечной недостаточностью IV и III класса по NYHA
-
пациенты с удлиненным интервалом QT в исходном состоянии (неоткорректированный > 440 мсек) или тяжелой брадикардией, нарушением функции синусового узла или блокадой сердца второй и третьей степени при отсутствии водителя ритма
-
применение внутривенных антиаритмических препаратов для контроля ритма (I и III классов) за 4 часа до применения препарата Бринэвис, а также в первые 4 часа после введения препарата Бринэвис
-
острый коронарный синдром (включая инфаркт миокарда) в течение предшествующих 30 дней.
Лекарственные взаимодействия
Исследований взаимодействия инъекционных форм вернакаланта с другими препаратами не проводилось. Прием других пероральных антиаритмических препаратов отменяют на 2 часа после введения Бринэвиса. Затем можно возобновить или начать прием пероральных поддерживающих антиаритмических препаратов.
Хотя вернакалант является субстратом CYP2D6, популяционный фармакокинетический анализ продемонстрировал отсутствие существенных отличий при острой экспозиции вернакаланта (Сmax и AUC0-90мин), если слабые или мощные ингибиторы CYP2D6 применяли на протяжении 1 дня до внутривенного введения вернакаланта по сравнению с пациентами, которые одновременно не принимали ингибиторы CYP2D6. Кроме того, острая экспозиция вернакаланта у пациентов с медленным метаболизмом CYP2D6 лишь минимально отличалась от таковой у пациентов с быстрым метаболизмом. Не требуется коррекции дозы вернакаланта в зависимости от скорости метаболизма CYP2D6 или при применении вернакаланта одновременно с ингибиторами 2D6.
Вернакалант – умеренный, конкурентный ингибитор CYP2D6. Однако при неотложном внутривенном введении вернакаланта не ожидается выраженного влияния на фармакокинетику постоянно применяемых субстратов 2D6 по причине краткого периода полураспада вернакаланта и последующего преходящего характера ингибирования 2D6.
Не ожидается возникновение существенных взаимодействий с другими препаратами при инфузионном введении вернакаланта по причине быстрого распределения и преходящей экспозиции, низкого уровня связывания с белками, отсутствия способности ингибировать другие ферменты (CYP3A4, 1A2, 2C9, 2C19 и 2E1) и Р-гликопротеин в исследовании транспорта дигоксина.
Несовместимость
Данный препарат нельзя смешивать с другими лекарственными средствами, за исключением растворителей, указанных в разделе «Способ применения и дозы».
Особые указания
Сообщалось о серьезных случаях развития артериальной гипотензии во время инфузии препарата Бринэвис и непосредственно после ее проведения. Необходимо обеспечить тщательное наблюдение за состоянием пациента с оценкой жизненно-важных показателей и постоянный мониторинг сердечного ритма во время введения препарата и на протяжении, как минимум, 15 минут после завершения инфузии.
Если появляется какой-либо из указанных ниже признаков и симптомов, введение препарата Бринэвис следует прекратить и назначить пациенту соответствующее медикаментозное лечение:
-
Внезапное снижение артериального давления или уменьшение частоты сердечных сокращений (с/без симптоматической артериальной гипотензии или брадикардии);
-
Артериальная гипотензия;
-
Брадикардия;
-
Изменения на ЭКГ (например, клинически значимая синусовая пауза, полная блокада сердца, новая блокада ножки пучка Гиса, значительное удлинение интервала QRS или QT, изменения, указывающие на ишемию или инфаркт, желудочковая аритмия).
Если такие явления возникают во время первой инфузии препарата Бринэвис, вторую инфузию проводить не следует.
Состояние пациента следует в дальнейшем контролировать на протяжении 2 часов после начала инфузии и до достижения стабилизации клинических показателей и ЭКГ.
При отсутствии терапевтического ответа на введение Бринэвиса можно рассмотреть вопрос о проведении кардиоверсии постоянным током. Нет клинического опыта проведения кардиоверсии постоянным током менее чем через 2 часа после применения препарата.
Перед проведением фармакологической кардиоверсии следует убедиться, что у пациента адекватные гидратация и гемодинамические показатели; если необходимо, следует назначить антикоагулянты в соответствии с рекомендациями по лечению. У пациентов с гипокалиемией (уровни калия в сыворотке крови ниже 3,5 ммоль/л) перед введением Бринэвиса следует нормализовать уровень калия.
Гипотензия
У некоторых пациентов может возникать гипотензия (вернакалант 7,6%, плацебо 5,1%). Гипотензия обычно развивается на раннем этапе – во время проведения инфузии или сразу после завершения инфузии, и, как правило, устраняется проведением стандартных поддерживающих процедур. Нечасто наблюдались случаи тяжелой гипотензии. Пациенты с застойной сердечной недостаточностью (ЗСН) определены как группа высокого риска в отношении развития гипотензии.
Во время инфузии и, по крайней мере, в течение 15 минут после окончания проведения инфузии необходимо наблюдать состояние пациента относительно появления признаков и симптомов внезапного снижения артериального давления или уменьшения частоты сердечных сокращений.
Застойная сердечная недостаточность (ЗСН)
У пациентов с ЗСН более высокая общая частота развития гипотензии на протяжении первых 2 часов после введения вернакаланта, по сравнению с пациентами, получавшими плацебо (16,1% и 4,7%, соответственно). Разница в частоте возникновения гипотензии в первые 2 часа после введения вернакаланта у пациентов с ЗСН по сравнению с пациентами, получавшими плацебо, была незначительной (5,7% по сравнению с 5,2%). О гипотензии как о серьезной побочной реакции или как о причине отмены препарата сообщалось у 2,9% пациентов с ЗСН после применения препарата Бринэвис, в то время как в плацебо группе у пациентов с ЗСН гипотензия не встречалась.
У пациентов с ЗСН в анамнезе отмечена более высокая частота возникновения желудочковой аритмии в первые 2 часа после введения препарата (Бринэвис – 7,3%, плацебо – 1,6%). Как правило, эти аритмии были бессимптомными, мономорфными, непродолжительными (в среднем 3–4 удара) желудочковыми тахикардиями. Однако сообщалось о подобной частоте возникновения желудочковой аритмии и у пациентов без ЗНС в анамнезе после применения препарата Бринэвис или плацебо (Бринэвис – 3,2%, плацебо – 3,6%).
По причине более высокой частоты возникновения таких побочных реакций, как гипотензия и желудочковая аритмия у пациентов с ЗНС, необходимо с осторожностью применять вернакалант у пациентов с гемодинамически стабильными показателями и ЗНС I–II функционального класса по NYHA. Ограничен опыт применения вернакаланта у пациентов с ранее зафиксированным показателем фракции выброса левого желудочка ≤ 35%. Применять препарат у таких пациентов не рекомендовано. Препарат противопоказан пациентам с ЗНС III или IV функционального класса по NYHA.
Трепетание предсердий
Не установлено, что препарат Бринэвис эффективен в восстановлении синусового ритма при трепетании предсердий. У пациентов, получающих препарат Бринэвис, более высокая частота преобразования в трепетание предсердий в первые 2 часа после введения препарата. Такой риск выше у пациентов, принимающих антиаритмические препараты I класса. Если наблюдается трепетание предсердий на фоне лечения, следует рассмотреть вопрос о продолжении инфузии.
Применение антиаритмических препаратов до или после введения препарата Бринэвис
Не рекомендуется применять препарат Бринэвис у пациентов, которым за 4–24 часа до применения вернакаланта вводили внутривенно антиаритмические препараты (I и III классов), поскольку данных недостаточно. Препарат Бринэвис не следует применять у пациентов, которым внутривенно вводили антиаритмические препараты (I и III классов) на протяжении 4 часов до применения вернакаланта.
С осторожностью следует применять препарат Бринэвис у пациентов, принимающих пероральные антиаритмические препараты (I и III класса), поскольку опыт применения ограничен. Риск возникновения трепетания предсердий может быть повышенным у пациентов, получающих антиаритмические препараты I класса.
Имеется ограниченный опыт применения внутривенных антиаритмических препаратов для контроля ритма (I и III классов) в первые 4 часа после введения препарата Бринэвис, поэтому на протяжении этого периода такие препараты применять не следует.
Через 2 часа после введения вернакаланта можно рассмотреть вопрос о возобновлении или начале применения пероральных поддерживающих антиаритмических препаратов.
Заболевания клапанов сердца
У пациентов с заболеванием клапана сердца чаще возникала желудочковая аритмия при применении вернакаланта. Такие пациенты требуют более тщательного мониторинга.
Другие заболевания и состояния, которые не изучались
Не наблюдалось повышения риска возникновения желудочковой тахикардии типа «пируэт» при применении препарата Бринэвис у пациентов с неоткорректированным интервалом QT менее 440 мс.
Кроме того, отсутствуют данные применения препарата Бринэвис у пациентов с клинически значимым клапанным стенозом, гипертрофической обструктивной кардиомиопатией, рестриктивной кардиомиопатией или констриктивным перикардитом, поэтому в таких случаях препарат применять не рекомендовано. Опыт применения препарата Бринэвис у пациентов с водителем ритма ограничен.
Поскольку опыт использования препарата в клинических исследованиях у пациентов с терминальной стадией нарушения функции печени ограничен, вернакалант не рекомендован таким пациентам.
Лекарственный препарат содержит приблизительно 1,4 ммоль (32 мг) натрия в каждом флаконе по 200 мг. Каждый флакон по 500 мг содержит приблизительно 3,5 ммоль (80 мг) натрия. Эту информацию следует учитывать у пациентов, которые контролируют употребление натрия с пищей.
Беременность и период лактации
Отсутствуют данные о применении вернакаланта гидрохлорида у беременных женщин. В качестве меры предосторожности предпочтительно избегать применения вернакаланта в период беременности.
Неизвестно, выделяется ли вернакалант и его метаболиты с грудным молоком у человека. Нельзя исключать риск для детей, находящихся на грудном вскармливании.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Исследования влияния препарата Бринэвис на способность управлять автотранспортом и механизмами не проводились. Однако при управлении автотранспортом и механизмами следует помнить, что сообщалось о возникновении головокружения в течение первых двух часов после введения препарата Бринэвис.
Передозировка
Симптомы: Не было случаев передозировки препарата Бринэвис в клинических исследованиях. Получено единичное сообщение о случайной передозировке 3 мг/кг в течение 5 минут (вместо 10 минут), в результате чего наблюдалась гемодинамически стабильная тахикардия с широкими желудочковыми комплексами на кардиограмме, которая впоследствии разрешилась без осложнений.
Лечение: Специфического антидота нет, при передозировке требуется постоянный кардиомониторинг, контроль гемодинамики и общего состояния, при необходимости симптоматическая терапия.
Форма выпуска и упаковка
По 25 мл во флаконы из прозрачного бесцветного стекла, укупоренные пробками резиновыми, обжатые алюминиевыми колпачками и закрытые сверху пластмассовой крышечкой
1 флакон вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную коробку.
Условия хранения
Хранить при температуре не выше 250 С.
Хранить в недоступном для детей месте.
Срок хранения
3 года
Не применять по истечении срока годности, указанного на упаковке
Условия отпуска из аптек
По рецепту
Производитель
Гамельн Фармасьютикалс ГмбХ., Германия
Упаковщик
Мерк Шарп и Доум Б.В., Нидерланды
Владелец регистрационного удостоверения
Кардиом ЮК Лимитед, Великобритания
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
ТОО «Jetcross» (Джеткросс)
Г. Алматы, ул. Тимирязева, 42, павильон 15/1 офис 1
Тел. +7(727) 269-54-20
E-mail: s.aygul1971@mail.ru
| 654029001477976919_ru.doc | 107 кб |
| 579276041477978094_kz.doc | 141.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Вернакалант
Vernakalant
Фармакологическое действие
Вернакалант — синтетический антиаритмический препарат Ⅲ класса. Вернакалант действует преимущественно на предсердия, увеличивая продолжительность рефрактерного периода предсердий и частотно-зависимо замедляя проводимость импульсов. Считается, что это антифибрилляционное влияние на рефрактерность и проводимость подавляет механизм возбуждения, усиливает действие на предсердие во время фибрилляции предсердий. Предполагается, что относительная селективность действия вернакаланта на рефрактерный период предсердий, а не желудочков, возникает благодаря блокированию токов в предсердиях, но не в желудочках, а также вследствие уникального электрофизиологического состояния фибриллирующего предсердия. Однако была зарегистрирована блокада катионных токов, в том числе каналов hERG и потенциалозависимых натриевых каналов, присутствующих в желудочках.
Вернакалант блокирует токи во всех фазах предсердного потенциала действия, в том числе калиевые токи, которые специфически проявляются в предсердиях (например, воздействуя на сверхбыстрые компоненты замедленного выпрямляющего и ацетилхолин-зависимого калиевого тока). Во время фибрилляции предсердий частотно- и потенциалзависимая блокада натриевых каналов в дальнейшем фокусирует действие препарата относительно быстро активирующейся и частично деполяризированной ткани предсердия, а не относительно биения желудочков нормальной поляризации, частота сокращений которых ниже. Дополнительно, способность вернакаланта блокировать поздний компонент натриевого тока ограничивает влияние на реполяризацию желудочков, вызываемую блокадой калиевых токов в желудочке. Направленное действие на ткани предсердия в сочетании с блокированием позднего натриевого тока предполагает низкий проаритмический потенциал вернакаланта. В целом, комбинация действия вернакаланта на калиевые и натриевые токи приводит к значительному антиаритмическому эффекту, который, главным образом, концентрируется в предсердиях.
В исследованиях электрофизиологии у пациентов вернакалант дозозависимо пролонгировал эффективный рефрактерный период предсердий, что не ассоциировалось с существенным увеличением эффективного рефрактерного периода желудочков.
Фармакокинетика
Абсорбция
У пациентов средние максимальные концентрации вернакаланта в плазме крови составили 3,9 мкг/мл после однократной 10-минутной инфузии вернакаланта гидрохлорида в дозе 3 мг/кг и 4,3 мкг/мл после второй инфузии в дозе 2 мг/кг с 15-минутным интервалом между введениями.
Распределение
Вернакалант экстенсивно и быстро распределяется в организме; Vd (объём распределения) составляет приблизительно 2 л/кг. Показатели Cmax (максимальная плазменная концентрация) и AUC (Area under the plasma drug concentration-time curve — площадь под кривой «концентрация-время») были пропорциональными дозе при дозировке в диапазоне 0,5–5 мг/кг. У пациентов типичный общий клиренс вернакаланта из организма составляет 0,41 л/ч/кг. Свободная фракция вернакаланта в сыворотке крови человека составляет 53–63 % в диапазоне концентрации 1–5 мкг/мл.
Элиминация
Вернакалант преимущественно выводится путём О-деметилирования, опосредованного CYP2D6 у пациентов с экстенсивным метаболизмом CYP2D6. У пациентов с медленным метаболизмом CYP2D6 основными механизмами выведения являются глюкуронидация и выведение почками. Средний период полувыведения вернакаланта составляет приблизительно 3 часа у пациентов с быстрым метаболизмом CYP2D6 и около 5,5 часа у пациентов с медленным метаболизмом CYP2D6.
Отдельные группы пациентов
Пол, застойная сердечная недостаточность в анамнезе, нарушение функции почек в анамнезе, одновременное применение бета-блокаторов и других препаратов, в том числе варфарина, метопролола, фуросемида и дигоксина, не оказывают значительного влияния на фармакокинетику вернакаланта. У пациентов с нарушением функции печени экспозиция повышается на 9–25 %. Нет необходимости в коррекции дозы вернакаланта при указанных выше состояниях, а также в зависимости от возраста, уровней креатинина сыворотки крови или скорости метаболизма CYP2D6.
Показания
Быстрое восстановление синусового ритма при недавно возникшей фибрилляции предсердий у взрослых:
- у пациентов, не подвергавшихся оперативному вмешательству: при длительности фибрилляции предсердий ≤7 дней;
- у пациентов, перенёсших операцию на сердце: при длительности фибрилляции предсердий ≤3 дней.
Противопоказания
- Повышенная чувствительность к вернакаланту;
- пациенты с тяжёлым аортальным стенозом, пациенты с систолическим давлением <100 мм рт. ст. и пациенты с сердечной недостаточностью IV и III класса по NYHA;
- пациенты с удлиненным интервалом QT в исходном состоянии (неоткорректированный >440 мсек) или тяжёлой брадикардией, нарушением функции синусового узла или блокадой сердца второй и третьей степени при отсутствии водителя ритма;
- применение внутривенных антиаритмических препаратов для контроля ритма (I и III классов) за 4 часа до применения вернакаланта, а также в первые 4 часа после введения препарата;
- острый коронарный синдром (включая инфаркт миокарда) в течение предшествующих 30 дней.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и строго контролируемых исследований по безопасности применения вернакаланта при беременности у человека не проведено.
В качестве меры предосторожности предпочтительно избегать применения вернакаланта в период беременности.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения вернакаланта в период грудного вскармливания не проведено.
Неизвестно, выделяется ли вернакалант и его метаболиты с грудным молоком у человека. Нельзя исключать риск для детей, находящихся на грудном вскармливании.
Способ применения и дозы
Парентерально, перорально.
Побочные действия
Определение частоты побочных эффектов: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1 000 и <1/100); редко (≥1 /10 000 и <1/1 000); очень редко (<1/10 000, включая отдельные случаи).
Со стороны нервной системы
Очень часто — дисгевзия; часто — парестезия, головокружение, гипестезия; нечасто — чувство жжения, паросмия, сонливость, вазовагальный обморок.
Со стороны органа зрения
Нечасто — раздражение слизистой оболочки глаз, увеличение слезоотделения, нарушение зрения.
Со стороны сердечной деятельности
Часто — брадикардия, трепетание предсердий; нечасто — блокада синусового узла, полная АV блокада, AV блокада I степени, блокада левой ножки пучка Гиса, блокада правой ножки пучка Гиса, желудочковые экстрасистолы, трепетания, синусовая брадикардия, желудочковая тахикардия, удлиненный комплекс QRS на ЭКГ, пролонгация QT на ЭКГ, кардиогенный шок.
Со стороны сосудистой системы
Часто — гипотензия; нечасто — приливы крови, бледность, повышение диастолического артериального давления.
Респираторные, торакальные и медиастинальные расстройства
Очень часто — чихание; часто — кашель, дискомфорт в носу; нечасто — диспноэ, асфиксия, ринорея, першение в горле, ощущение удушья, заложенность носа.
Желудочно-кишечные расстройства
Часто — тошнота, рвота, оральная парестезия; нечасто — сухость во рту, оральная гипестезия, диарея, позывы к дефекации.
Расстройства кожи и подкожной ткани
Часто — зуд, гипергидроз; нечасто — генерализованный зуд, холодный пот.
Расстройства скелетно-мышечной и соединительной ткани
Нечасто — боль в конечностях.
Расстройства общего характера и состояние места ввода препарата
Часто — боль в месте введения препарата, жар; нечасто — раздражение, гиперчувствительность, парестезия, чувство дискомфорта, чувство дискомфорта в груди, утомляемость.
Передозировка
Симптомы
Не было случаев передозировки вернакаланта в клинических исследованиях. Получено единичное сообщение о случайной передозировке 3 мг/кг в течение 5 минут (вместо 10 минут), в результате чего наблюдалась гемодинамически стабильная тахикардия с широкими желудочковыми комплексами на кардиограмме, которая впоследствии разрешилась без осложнений.
Лечение
Специфический антидот неизвестен, при передозировке требуется постоянный кардиомониторинг, контроль гемодинамики и общего состояния, при необходимости симптоматическая терапия.
Взаимодействие
Исследований взаимодействия инъекционных форм вернакаланта с другими препаратами не проводилось. Приём других пероральных антиаритмических препаратов отменяют на 2 часа после введения вернакаланта. Затем можно возобновить или начать приём пероральных поддерживающих антиаритмических препаратов.
Хотя вернакалант является субстратом CYP2D6, популяционный фармакокинетический анализ продемонстрировал отсутствие существенных отличий при острой экспозиции вернакаланта (Cmax и AUC0–90 мин), если слабые или мощные ингибиторы CYP2D6 применяли на протяжении 1 дня до внутривенного введения вернакаланта по сравнению с пациентами, которые одновременно не принимали ингибиторы CYP2D6. Кроме того, острая экспозиция вернакаланта у пациентов с медленным метаболизмом CYP2D6 лишь минимально отличалась от таковой у пациентов с быстрым метаболизмом. Не требуется коррекции дозы вернакаланта в зависимости от скорости метаболизма CYP2D6 или при применении вернакаланта одновременно с ингибиторами 2D6.
Вернакалант — умеренный, конкурентный ингибитор CYP2D6. Однако при неотложном внутривенном введении вернакаланта не ожидается выраженного влияния на фармакокинетику постоянно применяемых субстратов 2D6 по причине краткого периода полураспада вернакаланта и последующего преходящего характера ингибирования 2D6.
Не ожидается возникновение существенных взаимодействий с другими препаратами при инфузионном введении вернакаланта по причине быстрого распределения и преходящей экспозиции, низкого уровня связывания с белками, отсутствия способности ингибировать другие ферменты (CYP3A4, 1A2, 2C9, 2C19 и 2E1) и Р-гликопротеин в исследовании транспорта дигоксина.
Несовместимость
Инъекционные формы препарата нельзя смешивать с другими лекарственными средствами, за исключением растворителей, указанных в разделе «Способ применения и дозы» соответствующей лекарственной формы.
Меры предосторожности
Сообщалось о серьёзных случаях развития артериальной гипотензии во время инфузии вернакаланта и непосредственно после её проведения. Необходимо обеспечить тщательное наблюдение за состоянием пациента с оценкой жизненно-важных показателей и постоянный мониторинг сердечного ритма во время введения препарата и на протяжении, как минимум, 15 минут после завершения инфузии.
Если появляется какой-либо из указанных ниже признаков и симптомов, введение вернакаланта следует прекратить и назначить пациенту соответствующее медикаментозное лечение:
- Внезапное снижение артериального давления или уменьшение частоты сердечных сокращений (с/без симптоматической артериальной гипотензии или брадикардии);
- Артериальная гипотензия;
- Брадикардия;
- Изменения на ЭКГ (например, клинически значимая синусовая пауза, полная блокада сердца, новая блокада ножки пучка Гиса, значительное удлинение интервала QRS или QT, изменения, указывающие на ишемию или инфаркт, желудочковая аритмия).
Если такие явления возникают во время первой инфузии вернакаланта, вторую инфузию проводить не следует.
Состояние пациента следует в дальнейшем контролировать на протяжении 2 часов после начала инфузии и до достижения стабилизации клинических показателей и ЭКГ.
При отсутствии терапевтического ответа на введение вернакаланта можно рассмотреть вопрос о проведении кардиоверсии постоянным током. Нет клинического опыта проведения кардиоверсии постоянным током менее чем через 2 часа после применения препарата.
Перед проведением фармакологической кардиоверсии следует убедиться, что у пациента адекватные гидратация и гемодинамические показатели; если необходимо, следует назначить антикоагулянты в соответствии с рекомендациями по лечению. У пациентов с гипокалиемией (уровни калия в сыворотке крови ниже 3,5 ммоль/л) перед введением вернакаланта следует нормализовать уровень калия.
Гипотензия
У некоторых пациентов может возникать гипотензия (вернакалант 7,6 %, плацебо 5,1 %). Гипотензия обычно развивается на раннем этапе — во время проведения инфузии или сразу после завершения инфузии, и, как правило, устраняется проведением стандартных поддерживающих процедур. Нечасто наблюдались случаи тяжёлой гипотензии. Пациенты с застойной сердечной недостаточностью (ЗСН) определены как группа высокого риска в отношении развития гипотензии.
Во время инфузии и, по крайней мере, в течение 15 минут после окончания проведения инфузии необходимо наблюдать состояние пациента относительно появления признаков и симптомов внезапного снижения артериального давления или уменьшения частоты сердечных сокращений.
Застойная сердечная недостаточность (ЗСН)
У пациентов с ЗСН более высокая общая частота развития гипотензии на протяжении первых 2 часов после введения вернакаланта, по сравнению с пациентами, получавшими плацебо (16,1 % и 4,7 %, соответственно). Разница в частоте возникновения гипотензии в первые 2 часа после введения вернакаланта у пациентов с ЗСН по сравнению с пациентами, получавшими плацебо, была незначительной (5,7 % по сравнению с 5,2 %). О гипотензии как о серьезной побочной реакции или как о причине отмены препарата сообщалось у 2,9 % пациентов с ЗСН после применения вернакаланта, в то время как в плацебо группе у пациентов с ЗСН гипотензия не встречалась.
У пациентов с ЗСН в анамнезе отмечена более высокая частота возникновения желудочковой аритмии в первые 2 часа после введения препарата (вернакалант — 7,3 %, плацебо — 1,6 %). Как правило, эти аритмии были бессимптомными, мономорфными, непродолжительными (в среднем 3–4 удара) желудочковыми тахикардиями. Однако сообщалось о подобной частоте возникновения желудочковой аритмии и у пациентов без ЗНС в анамнезе после применения вернакаланта или плацебо (вернакалант — 3,2 %, плацебо — 3,6 %).
По причине более высокой частоты возникновения таких побочных реакций, как гипотензия и желудочковая аритмия у пациентов с ЗНС, необходимо с осторожностью применять вернакалант у пациентов с гемодинамически стабильными показателями и ЗНС Ⅰ–Ⅱ функционального класса по NYHA. Ограничен опыт применения вернакаланта у пациентов с ранее зафиксированным показателем фракции выброса левого желудочка ≤35 %. Применять препарат у таких пациентов не рекомендовано. Препарат противопоказан пациентам с ЗНС Ⅲ или Ⅳ функционального класса по NYHA.
Трепетание предсердий
Не установлено, что вернакалант эффективен в восстановлении синусового ритма при трепетании предсердий. У пациентов, получающих вернакалант, более высокая частота преобразования в трепетание предсердий в первые 2 часа после введения препарата. Такой риск выше у пациентов, принимающих антиаритмические препараты Ⅰ класса. Если наблюдается трепетание предсердий на фоне лечения, следует рассмотреть вопрос о продолжении инфузии.
Применение антиаритмических препаратов до или после введения вернакаланта
Не рекомендуется применять препарат у пациентов, которым за 4–24 часа до применения вернакаланта вводили внутривенно антиаритмические препараты (Ⅰ и Ⅲ классов), поскольку данных недостаточно. Препарат не следует применять у пациентов, которым внутривенно вводили антиаритмические препараты (Ⅰ и Ⅲ классов) на протяжении 4 часов до применения вернакаланта.
С осторожностью следует применять вернакалант у пациентов, принимающих пероральные антиаритмические препараты (Ⅰ и Ⅲ класса), поскольку опыт применения ограничен. Риск возникновения трепетания предсердий может быть повышенным у пациентов, получающих антиаритмические препараты Ⅰ класса.
Имеется ограниченный опыт применения внутривенных антиаритмических препаратов для контроля ритма (Ⅰ и Ⅲ классов) в первые 4 часа после введения вернакаланта, поэтому на протяжении этого периода такие препараты применять не следует.
Через 2 часа после введения вернакаланта можно рассмотреть вопрос о возобновлении или начале применения пероральных поддерживающих антиаритмических препаратов.
Заболевания клапанов сердца
У пациентов с заболеванием клапана сердца чаще возникала желудочковая аритмия при применении вернакаланта. Такие пациенты требуют более тщательного мониторинга.
Другие заболевания и состояния, которые не изучались
Не наблюдалось повышения риска возникновения желудочковой тахикардии типа «пируэт» при применении вернакаланта у пациентов с неоткорректированным интервалом QT менее 440 мс.
Кроме того, отсутствуют данные применения вернакаланта у пациентов с клинически значимым клапанным стенозом, гипертрофической обструктивной кардиомиопатией, рестриктивной кардиомиопатией или констриктивным перикардитом, поэтому в таких случаях препарат применять не рекомендовано. Опыт применения вернакаланта у пациентов с водителем ритма ограничен.
Поскольку опыт использования препарата в клинических исследованиях у пациентов с терминальной стадией нарушения функции печени ограничен, вернакалант не рекомендован таким пациентам.
Лекарственный препарат содержит приблизительно 1,4 ммоль (32 мг) натрия в каждом флаконе по 200 мг. Каждый флакон по 500 мг содержит приблизительно 3,5 ммоль (80 мг) натрия. Эту информацию следует учитывать у пациентов, которые контролируют употребление натрия с пищей.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследования влияния вернакаланта на способность управлять автотранспортом и механизмами не проводились. Однако при управлении автотранспортом и механизмами следует помнить, что сообщалось о возникновении головокружения в течение первых двух часов после введения вернакаланта.
Классификация
-
АТХ
C01BG11
-
Фармакологическая группа
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Вернакалант предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Вернакалант, содержатся в инструкции производителя, прилагаемой к упаковке.
From Wikipedia, the free encyclopedia
 |
|
| Clinical data | |
|---|---|
| Trade names | Brinavess |
| Other names | RSD1235 |
| License data |
|
| Routes of administration |
Intravenous,[1] oral[citation needed] |
| ATC code |
|
| Legal status | |
| Legal status |
|
| Pharmacokinetic data | |
| Protein binding | low |
| Metabolism | CYP2D6, glucuronidation |
| Elimination half-life | 3–5.5 hours |
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.121.790 |
| Chemical and physical data | |
| Formula | C20H31NO4 |
| Molar mass | 349.471 g·mol−1 |
| 3D model (JSmol) |
|
|
SMILES
|
|
|
InChI
|
|
| |
Vernakalant (INN; EU trade name Brinavess; proposed US trade name Kynapid) is a pharmaceutical drug for the acute conversion of atrial fibrillation, a kind of irregular heartbeat, in form of an intravenous infusion. It has been approved for use in the European Union and the UK since 2010. The US Food and Drug Administration denied approval in 2008 and 2019.
Medical uses[edit]
The drug is used for the treatment of atrial fibrillation lasting up to three days in adults after heart surgery, or lasting up to seven days in other adults, as an intravenous infusion.[1]
Contraindications[edit]
Vernakalant is contraindicated in a number of heart conditions: severe aortic stenosis, low blood pressure (systolic pressure under 100 mmHg), heart failure (NYHA class III–IV), prolonged QT time, severe bradycardia (slow heart rate), sinus node dysfunction, second or third-degree atrioventricular block, and acute coronary syndrome including heart attack. Vernakalant and other intravenous rhythm control drugs (class I and class III antiarrhythmics) must not be given within four hours of each other.[1]
Side effects[edit]
The most common adverse effects in studies were dysgeusia (taste disturbance, in 18% of patients), sneezing (13%) and paraesthesia (abnormal skin sensations, 7%); they were transient and rarely led to an abortion of the treatment. Potentially serious side effects included low blood pressure and conversion of the heart rhythm to atrial flutter instead of a normal sinus rhythm; flutter mostly responded to a second dose of vernakalant.[1]
Overdose[edit]
There is a single case report of a person receiving an infusion of the full vernakalant dose in half the recommended time, resulting in tachycardia (fast heartbeat) without lasting adverse effects.[1]
Interactions[edit]
Drugs that inhibit the liver enzyme CYP2D6 might theoretically increase vernakalant concentrations in the body, as the latter is metabolized by this enzyme; but this has been found to be of no clinical significance. While the drug itself is a moderate CYP2D6 inhibitor, it is not expected to have a relevant impact on other pharmaceuticals that are broken down by this enzyme, because it only remains in the body for a short time. Vernakalant probably interacts with other antiarrhythmic drugs, although no formal studies have been done.[1]
Pharmacology[edit]
Mechanism of action[edit]
Like other class III antiarrhythmics, vernakalant blocks atrial potassium channels, thereby prolonging repolarization. It differs from typical class III agents by blocking a certain type of potassium channel, the cardiac transient outward potassium current, with increased potency as the heart rate increases. This means that it is more effective at high heart rates, while other class III agents tend to lose effectiveness under these circumstances. It also slightly blocks the hERG potassium channel, leading to a prolonged QT interval. This may theoretically increase the risk of ventricular tachycardia, though this does not seem to be clinically relevant.[2]
The drug also blocks atrial sodium channels.[2]
Pharmacokinetics and pharmacogenomics[edit]
After infusion, the substance is rapidly distributed in the body. In the blood serum, 53–56% are circulating freely and are not bound to plasma proteins. In people with normal CYP2D6 function, the main route of degradation is by O-demethylation via this enzyme. In 2D6 poor metabolizers, vernakalant is mainly inactivated by glucuronidation and excreted by the kidney. Elimination half-life is three hours in 2D6 extensive (normal) metabolizers and 5.5 hours in poor metabolizers. The differences between poor and extensive metabolizers regarding peak concentrations, AUC and half-life are not clinically relevant.[1][3]
Vernakalant does not inhibit the enzymes CYP3A4, CYP1A2, CYP2C9, CYP2C19, CYP2E1, nor the transporter protein P-gp.[1]
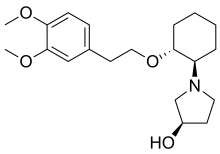
Chemistry[edit]
The molecule has three asymmetric carbon atoms, allowing for 23 = 8 stereomers. The trans stereomers are known to be pharmacologically active, but only the RRR-form is contained in the marketed formulation. The SRR-form (with the hydroxyl group in S configuration) is a minor metabolite that is formed in the human body, mainly in poor metabolizers.[3]
The infusion contains vernakalant hydrochloride, which is highly water-soluble.[3]
History[edit]
Vernakalant was initially developed by Cardiome Pharma, and the intravenous formulation was bought for further development by Merck in April 2009.[4] In September 2012, Merck terminated its agreements with Cardiome and has consequently returned all rights of the drug back to Cardiome, which as of 2018 is known as Correvio Pharma.
On 11 December 2007, the Cardiovascular and Renal Drugs Advisory Committee of the US Food and Drug Administration (FDA) voted to recommend the approval of vernakalant,[5] but in August 2008 the FDA judged that additional information was necessary for approval.[4]
In Europe, the drug was approved under the trade name Brinavess on 1 September 2010.[6]
An oral formulation underwent Phase II clinical trials between 2005 and 2008.[7][8]
On 10 December 2019 the resubmitted New Drug Application for vernakalant was discussed by the Cardiovascular and Renal Drugs Advisory Committee.[9] The Advisory Committee voted not to recommend the approval.[10]
See also[edit]
- Almokalant
References[edit]
- ^ a b c d e f g h «Brinavess: EPAR – Product information» (PDF). European Medicines Agency. 19 December 2019.
- ^ a b Finnin M (July 2010). «Vernakalant: A novel agent for the termination of atrial fibrillation». American Journal of Health-System Pharmacy. 67 (14): 1157–64. doi:10.2146/ajhp080501. PMID 20592320.
- ^ a b c «Brinavess: EPAR – Public assessment report» (PDF). European Medicines Agency. 25 June 2010.
- ^ a b «Merck and Cardiome Pharma Sign License Agreement for Vernakalant, an Investigational Drug for Treatment of Atrial Fibrillation». FierceBiotech. 9 April 2009. Retrieved 12 October 2010.
- ^ «FDA Advisory Committee Recommends Approval of Kynapid for Acute Atrial Fibrillation». Drugs.com. Retrieved 15 March 2008.
- ^ «Brinavess (vernakalant) for Infusion Approved in the European Union for Rapid Conversion of Recent Onset Atrial Fibrillation» (Press release). Merck & Co., Inc. 1 September 2010. Archived from the original on 28 September 2010. Retrieved 28 September 2010.
- ^ Clinical trial number NCT00267930 for «Study of RSD1235-SR for the Prevention of Atrial Fibrillation/Atrial Flutter Recurrence» at ClinicalTrials.gov
- ^ Clinical trial number NCT00526136 for «Vernakalant (Oral) Prevention of Atrial Fibrillation Recurrence Post-Conversion Study» at ClinicalTrials.gov
- ^ «December 10, 2019 Meeting of the Cardiovascular and Renal Drugs Advisory Committee Meeting Announcement». FDA.gov. Retrieved 9 December 2019.
- ^ «FDA Panel Shoots Down Afib Cardioversion Drug Over Safety». MedPage Today. Retrieved 11 December 2019.
|
Вернакалант (Merck/Cardiome Pharma), новый препарат для внутривенного введения, который блокирует раннюю активацию К+каналов и частотно-зависимых Na+ каналов, в соответствии с результатами исследования AVRO более эффективен чем амиодарон при использовании для быстрого преобразования фибрилляции предсердий (ФП) синусового ритма [1]. Кроме того пациенты у которых применялся вернакалант имели значительно чаще облегчение симптомов за 90 минут и чаще отмечали улучшение общего состояния за 2 часа, сообщают исследователи. Результаты исследования, ранее представленные в ходе Научной сессии Общество сердечного ритма/ Heart Rhythm Society (HRS) 2010 Scientific Sessions ведущим исследователем Д-м A John Camm (St George»s University, London, UK), было опубликовано 18 января 2011 в Journal of the American College of Cardiology. Несмотря на опубликованные результаты исследования AVRO, вернакалант находиться в США в неопределенном положении. В декабре 2007, члены экспертного совета FDA проголосовали шесть против двух за одобрение данного препарата, но вернакалант не был одобрен на тот момент из-за неясности вопроса по поводу случаев гипотонии и возможности его использования у пациентов с сердечной недостаточностью и острым коронарным синдромом. Третья фаза исследования ACT 5 была остановлена в 2008 году FDA в связи с зарегистрированным серьезным случаем кардиогенного шока у пациента получающего данный препарат. Источник: prescript.ru |
2015-11-13 00:00:004637
Исследователи рандомизировали 100 пациентов с недавно выявленной фибрилляцией предсердий (ФП), которые поступили в приемное отделение специализированного учреждения, на короткие (не более двух) инфузии вернакаланта (3 мг/кг, 2 мг/кг) или ибутилида (1 мг/кг, 1 мг/кг). Исследователи зафиксировали время до конверсии, частоту конверсии, неблагоприятные события и другие параметры.
Согласно данным, представленным на научной сессии Американской ассоциации сердца, медиана времени от ФП до восстановления синусового ритма составила 10 минут у пациентов на вернакаланте по сравнению с 26 минутами у пациентов на ибутилиде (P = 0,02).
Кроме того, частота успешной конверсии в течение 90 минут составила 69% в группе вернакаланта по сравнению с 43% в группе ибутилида (P = .01).
Никаких серьезных побочных эффектов не было отмечено ни в одной группе.
Источник: www.healio.com
Теги:
{{ isErrorSetToBasket === false ? ‘Товар добавлен вкорзину’ : ‘Не удалось добавить товар в корзину’}}
Перейти в корзину
{{Object.keys(error)[0]}}:
{{Object.values(error)[0]}}
Продолжить покупки
{{isErrorSetToBasket === true && countBasket != 0 ? » : `(${countBasket})`}}

Вернакалант гидрохлорид
Кат. №: AG00G3QF-5
Цена По запросу
Количество
Вы уже добавили максимально доступное на складе кол-во товара
Достигнуто максимально доступное кол-во
Под заказ
{{!!storageProduct ? ‘На складе’ : ‘Под заказ’}}
Ожидается поставка
Скачать каталог «ХИММЕД» в формате pdf

Химические реактивы

Лабораторное оборудование

Аналитическое оборудование
Биохимия

Проектирование лабораторий
Материалы для микроэлектроники
Для уточнения данных о стоимости и наличии товаров, пожалуйста, обращайтесь к
менеджерам по продажам.
Похоже, что-то пошло не так.
Попробуйте перезагрузить страницу.
×
Авторизация прошла успешно.