1. Indications and Usage for Yasmin
Yasmin® is indicated for use by females of reproductive potential to prevent pregnancy.
2. Yasmin Dosage and Administration
2.1 How to Take Yasmin
Take one tablet by mouth at the same time every day. The failure rate may increase when pills are missed or taken incorrectly.
To achieve maximum contraceptive effectiveness, Yasmin must be taken as directed, in the order directed on the blister pack. Single missed pills should be taken as soon as remembered.
2.2 How to Start Yasmin
Instruct the patient to begin taking Yasmin either on the first day of her menstrual period (Day 1 Start) or on the first Sunday after the onset of her menstrual period (Sunday Start).
Day 1 Start
During the first cycle of Yasmin use, instruct the patient to take one yellow Yasmin daily, beginning on Day 1 of her menstrual cycle. (The first day of menstruation is Day 1.) She should take one yellow Yasmin daily for 21 consecutive days, followed by one white tablet daily on Days 22 through 28. Yasmin should be taken in the order directed on the package at the same time each day, preferably after the evening meal or at bedtime with some liquid, as needed. Yasmin can be taken without regard to meals. If Yasmin is first taken later than the first day of the menstrual cycle, Yasmin should not be considered effective as a contraceptive until after the first 7 consecutive days of product administration. Instruct the patient to use a non-hormonal contraceptive as back-up during the first 7 days. The possibility of ovulation and conception prior to initiation of medication should be considered.
Sunday Start
During the first cycle of Yasmin use, instruct the patient to take one yellow Yasmin daily, beginning on the first Sunday after the onset of her menstrual period. She should take one yellow Yasmin daily for 21 consecutive days, followed by one white tablet daily on Days 22 through 28. Yasmin should be taken in the order directed on the package at the same time each day, preferably after the evening meal or at bedtime with some liquid, as needed. Yasmin can be taken without regard to meals. Yasmin should not be considered effective as a contraceptive until after the first 7 consecutive days of product administration. Instruct the patient to use a non-hormonal contraceptive as back-up during the first 7 days. The possibility of ovulation and conception prior to initiation of medication should be considered.
The patient should begin her next and all subsequent 28-day regimens of Yasmin on the same day of the week that she began her first regimen, following the same schedule. She should begin taking her yellow tablets on the next day after ingestion of the last white tablet, regardless of whether or not a menstrual period has occurred or is still in progress. Anytime a subsequent cycle of Yasmin is started later than the day following administration of the last white tablet, the patient should use another method of contraception until she has taken a yellow Yasmin daily for seven consecutive days.
When switching from a different birth control pill
When switching from another birth control pill, Yasmin should be started on the same day that a new pack of the previous oral contraceptive would have been started.
When switching from a method other than a birth control pill
When switching from a transdermal patch or vaginal ring, Yasmin should be started when the next application would have been due. When switching from an injection, Yasmin should be started when the next dose would have been due. When switching from an intrauterine contraceptive or an implant, Yasmin should be started on the day of removal.
Withdrawal bleeding usually occurs within 3 days following the last yellow tablet. If spotting or breakthrough bleeding occurs while taking Yasmin, instruct the patient to continue taking Yasmin by the regimen described above. Counsel her that this type of bleeding is usually transient and without significance; however, advise her that if the bleeding is persistent or prolonged, she should consult her healthcare provider.
Although the occurrence of pregnancy is low if Yasmin is taken according to directions, if withdrawal bleeding does not occur, consider the possibility of pregnancy. If the patient has not adhered to the prescribed dosing schedule (missed one or more active tablets or started taking them on a day later than she should have), consider the possibility of pregnancy at the time of the first missed period and take appropriate diagnostic measures. If the patient has adhered to the prescribed regimen and misses two consecutive periods, rule out pregnancy. Discontinue Yasmin if pregnancy is confirmed.
The risk of pregnancy increases with each active yellow tablet missed. If breakthrough bleeding occurs following missed tablets, it will usually be transient and of no consequence. If the patient misses one or more white tablets, she should still be protected against pregnancy provided she begins taking a new cycle of yellow tablets on the proper day.
For postpartum women who do not breastfeed or after a second trimester abortion, start Yasmin no earlier than 4 weeks postpartum due to the increased risk of thromboembolism. If the patient starts Yasmin postpartum and has not yet had a period, evaluate for possible pregnancy, and instruct her to use an additional method of contraception until she has taken Yasmin for 7 consecutive days.
2.3 Missed Doses
|
If one yellow active tablet is missed |
Take it as soon as possible. Take the next tablet at the regular time. This means two tablets may be taken in one day. A back-up birth control method is not required if the patient has sex. |
|
If two yellow active tablets in a row are missed in Week 1 or Week 2 |
Take two tablets as soon as possible and two tablets the next day. Then take one tablet a day until the pack is finished. Additional nonhormonal contraception (such as condoms and spermicide) should be used as back-up if the patient has sex within 7 days after missing tablets. |
|
If two yellow active tablets in a row are missed in Week 3 or Week 4 |
Day 1 Start: Throw out the rest of the pack and start a new pack that same day. Sunday Start: Keep taking one tablet every day until Sunday. On Sunday, throw out the rest of the pack and start a new pack that same day. Additional nonhormonal contraception (such as condoms and spermicide) should be used as back-up if the patient has sex within 7 days after missing tablets. The patient may not have their period this month but this is expected. However, if they miss their period two months in a row, they should call their healthcare provider because they might be pregnant. |
|
If three or more yellow active tablets in a row are missed during any week |
Day 1 Start: Throw out the rest of the pack and start a new pack that same day. Sunday Start: Keep taking one tablet every day until Sunday. On Sunday, throw out the rest of the pack and start a new pack that same day. Additional nonhormonal contraception (such as condoms and spermicide) should be used as back-up if the patient has sex within 7 days after missing tablets. The patient may not have their period this month but this is expected. However, if they miss their period two months in a row, they should call their healthcare provider because they might be pregnant. |
|
If any of the seven white inactive tablets are missed in Week 4 |
Throw away the tablets that were missed. Keep taking one tablet each day until the pack is empty. They do not need a back-up method. |
|
Finally, if they are still not sure what to do about the tablets they have missed |
Use nonhormonal contraception (such as condoms and spermicides) anytime they have sex.Contact their healthcare provider and continue taking one active yellow tablet each day until otherwise directed. |
2.4 Advice in Case of Gastrointestinal Disturbances
In case of severe vomiting or diarrhea, absorption may not be complete and additional contraceptive measures should be taken. If vomiting occurs within 3-4 hours after tablet-taking, this can be regarded as a missed tablet.
3. Dosage Forms and Strengths
Yasmin (drospirenone/ethinyl estradiol) tablets are available in blister packs.
Each blister pack contains 28 film-coated, round, bi-convex tablets in the following order:
- •
- 21 yellow tablets each containing 3 mg drospirenone (DRSP) and 0.03 mg ethinyl estradiol (EE) embossed with a “DO” in a regular hexagon on one side
- •
- 7 inert white tablets embossed with a “DP” in a regular hexagon on one side
4. Contraindications
Yasmin is contraindicated in females who are known to have or develop the following conditions:
- •
- Renal impairment
- •
- Adrenal insufficiency
- •
- A high risk of arterial or venous thrombotic diseases. Examples include women who are known to:
- •
- Smoke, if over age 35 [see Boxed Warning and Warnings and Precautions (5.1)]
- •
- Have deep vein thrombosis or pulmonary embolism, now or in the past [see Warnings and Precautions (5.1)]
- •
- Have cerebrovascular disease [see Warnings and Precautions (5.1)]
- •
- Have coronary artery disease [see Warnings and Precautions (5.1)]
- •
- Have thrombogenic valvular or thrombogenic rhythm diseases of the heart (for example, subacute bacterial endocarditis with valvular disease, or atrial fibrillation) [see Warnings and Precautions (5.1)]
- •
- Have inherited or acquired hypercoagulopathies [see Warnings and Precautions (5.1)]
- •
- Have uncontrolled hypertension [see Warnings and Precautions (5.6)]
- •
- Have diabetes mellitus with vascular disease [see Warnings and Precautions (5.8)]
- •
- Have headaches with focal neurological symptoms or have migraine headaches with or without aura if over age 35 [see Warnings and Precautions (5.9)]
- •
- Undiagnosed abnormal uterine bleeding [see Warnings and Precautions (5.10)]
- •
- Current diagnosis of, or history of, breast cancer, which may be hormone-sensitive [see Warnings and Precautions (5.3)]
- •
- Liver tumor (benign or malignant) or liver disease [see Warnings and Precautions (5.4) and Use in Specific Populations (8.7)]
- •
- Use of Hepatitis C drug combinations containing ombitasvir, paritaprevir/ritonavir, with or without dasabuvir due to the potential for ALT elevations [see Warnings and Precautions (5.5) and Drug Interactions (7.2)]
5. Warnings and Precautions
5.1 Thromboembolic Disorders and Other Vascular Problems
Stop Yasmin if an arterial or venous thrombotic (VTE) event occurs.
Based on presently available information on Yasmin, DRSP-containing COCs may be associated with a higher risk of venous thromboembolism (VTE) than COCs containing the progestin levonorgestrel or some other progestins. Epidemiologic studies that compared the risk of VTE reported that the risk ranged from no increase to a three-fold increase. Before initiating use of Yasmin in a new COC user or a woman who is switching from a contraceptive that does not contain DRSP, consider the risks and benefits of a DRSP-containing COC in light of her risk of a VTE. Known risk factors for VTE include smoking, obesity, and family history of VTE, in addition to other factors that contraindicate use of COCs [see Contraindications (4)].
A number of studies have compared the risk of VTE for users of Yasmin to the risk for users of other COCs, including COCs containing levonorgestrel. Those that were required or sponsored by regulatory agencies are summarized in Table 2.
|
||
|
Epidemiologic Study |
Comparator Product |
Hazard Ratio (HR) |
|
i3 Ingenix |
All COCs available in the US |
HR: 0.9 |
|
EURAS |
All COCs available in Europe |
HR: 0.9 |
|
Levonorgestrel/EE |
HR: 1.0 |
|
|
FDA-funded study” (2011) |
||
|
New users* |
Other COCs available during the course of the study§ |
HR: 1.8 |
|
Levonorgestrel/0.03 mg EE |
HR: 1.6 |
|
|
All users |
Other COCs available during the course of the study§ |
HR: 1.7 |
|
Levonorgestrel/0.03 mg EE |
HR: 1.5 |
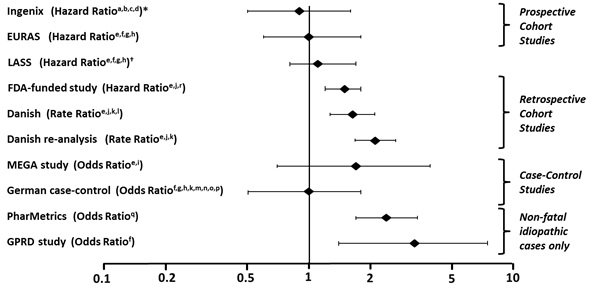
In addition to these “regulatory studies,” other studies of various designs have been conducted. Overall, there are two prospective cohort studies (see Table 2): the US post-approval safety study Ingenix [Seeger 2007], the European post-approval safety study EURAS (European Active Surveillance Study) [Dinger 2007]. An extension of the EURAS study, the Long-Term Active Surveillance Study (LASS), did not enroll additional subjects, but continued to assess VTE risk. There are three retrospective cohort studies: one study in the US funded by the FDA (see Table 2), and two from Denmark [Lidegaard 2009, Lidegaard 2011]. There are two case-control studies: the Dutch MEGA study analysis [van Hylckama Vlieg 2009] and the German case-control study [Dinger 2010]. There are two nested case-control studies that evaluated the risk of non-fatal idiopathic VTE: the PharMetrics study [Jick 2011] and the GPRD study [Parkin 2011]. The results of all of these studies are presented in Figure 1.
Figure 1: VTE Risk with Yasmin Relative to LNG-Containing COCs (adjusted risk#)
Risk ratios displayed on logarithmic scale; risk ratio < 1 indicates a lower risk of VTE for DRSP, > 1 indicates an increased risk of VTE for DRSP.
*Comparator “Other COCs”, including LNG- containing COCs
† LASS is an extension of the EURAS study
#Some adjustment factors are indicated by superscript letters: a) Current heavy smoking, b) hypertension, c) obesity, d) family history, e) age, f) BMI, g) duration of use, h) VTE history, i) period of inclusion, j) calendar year, k) education, l) length of use, m) parity, n) chronic disease, o) concomitant medication, p) smoking, q) duration of exposure, r) site
(References: Ingenix [Seeger 2007]1, EURAS (European Active Surveillance Study) [Dinger 2007]2, LASS (Long-Term Active Surveillance Study) [Dinger, unpublished document on file], FDA-funded study [Sidney 2011]3, Danish [Lidegaard 2009]4, Danish re-analysis [ Lidegaard 2011]5, MEGA study [van Hylckama Vlieg 2009]6, German Case-Control study [Dinger 2010]7, PharMetrics [Jick 2011]8, GPRD study [Parkin 2011]9)
Although the absolute VTE rates are increased for users of hormonal contraceptives compared to non-users, the rates during pregnancy are even greater, especially during the post-partum period (see Figure 2). The risk of VTE in women using COCs has been estimated to be 3 to 9 per 10,000 woman-years. The risk of VTE is highest during the first year of use. Data from a large, prospective cohort safety study of various COCs suggest that this increased risk, as compared to that in non-COC users, is greatest during the first 6 months of COC use. Data from this safety study indicate that the greatest risk of VTE is present after initially starting a COC or restarting (following a 4 week or greater pill-free interval) the same or a different COC.
The risk of thromboembolic disease due to oral contraceptives gradually disappears after COC use is discontinued.
Figure 2 shows the risk of developing a VTE for women who are not pregnant and do not use oral contraceptives, for women who use oral contraceptives, for pregnant women, and for women in the postpartum period. To put the risk of developing a VTE into perspective: If 10,000 women who are not pregnant and do not use oral contraceptives are followed for one year, between 1 and 5 of these women will develop a VTE.
Figure 2: Likelihood of Developing a VTE
If feasible, stop Yasmin at least 4 weeks before and through 2 weeks after major surgery or other surgeries known to have an elevated risk of thromboembolism.
Start Yasmin no earlier than 4 weeks after delivery, in women who are not breastfeeding. The risk of postpartum thromboembolism decreases after the third postpartum week, whereas the risk of ovulation increases after the third postpartum week.
Use of COCs also increases the risk of arterial thromboses such as strokes and myocardial infarctions, especially in women with other risk factors for these events.
COCs have been shown to increase both the relative and attributable risks of cerebrovascular events (thrombotic and hemorrhagic strokes), although, in general, the risk is greatest among older (>35 years of age), hypertensive women who also smoke. COCs also increase the risk for stroke in women with other underlying risk factors.
Oral contraceptives must be used with caution in women with cardiovascular disease risk factors.
Stop Yasmin if there is unexplained loss of vision, proptosis, diplopia, papilledema, or retinal vascular lesions. Evaluate for retinal vein thrombosis immediately. [See Adverse Reactions (6).]
5.2 Hyperkalemia
Yasmin contains 3 mg of the progestin DRSP, which has anti-mineralocorticoid activity, including the potential for hyperkalemia in high-risk patients, comparable to a 25 mg dose of spironolactone. Yasmin is contraindicated in patients with conditions that predispose to hyperkalemia (that is, renal impairment, hepatic impairment, and adrenal insufficiency). Women receiving daily, long-term treatment for chronic conditions or diseases with medications that may increase serum potassium concentration should have their serum potassium concentration checked during the first treatment cycle. Medications that may increase serum potassium concentration include ACE inhibitors, angiotensin–II receptor antagonists, potassium-sparing diuretics, potassium supplementation, heparin, aldosterone antagonists, and NSAIDs. Consider monitoring serum potassium concentration in high-risk patients who take a strong CYP3A4 inhibitor long-term and concomitantly. Strong CYP3A4 inhibitors include azole antifungals (e.g. ketoconazole, itraconazole, voriconazole), HIV/HCV protease inhibitors (e.g., indinavir, boceprevir), and clarithromycin [see Clinical Pharmacology (12.3)].
5.3 Malignant Neoplasms
Breast Cancer
Yasmin is contraindicated in females who currently have or have had breast cancer because breast cancer may be hormonally sensitive [see Contraindications (4)].
Epidemiology studies have not found a consistent association between use of combined oral contraceptives (COCs) and breast cancer risk. Studies do not show an association between ever (current or past) use of COCs and risk of breast cancer. However, some studies report a small increase in the risk of breast cancer among current or recent users (<6 months since last use) and current users with longer duration of COC use [see Adverse Reactions (6.2)].
Cervical Cancer
Some studies suggest that COCs are associated with an increase in the risk of cervical cancer or intraepithelial neoplasia. However, there is controversy about the extent to which these findings may be due to differences in sexual behavior and other factors.
5.4 Liver Disease
Discontinue Yasmin if jaundice develops. Steroid hormones may be poorly metabolized in patients with impaired liver function. Acute or chronic disturbances of liver function may necessitate the discontinuation of COC use until markers of liver function return to normal and COC causation has been excluded.
Hepatic adenomas are associated with COC use. An estimate of the attributable risk is 3.3 cases/100,000 COC users. Rupture of hepatic adenomas may cause death through intra-abdominal hemorrhage.
Studies have shown an increased risk of developing hepatocellular carcinoma in long-term (>8 years) COC users. However, the attributable risk of liver cancers in COC users is less than one case per million users.
Oral contraceptive-related cholestasis may occur in women with a history of pregnancy-related cholestasis. Women with a history of COC-related cholestasis may have the condition recur with subsequent COC use.
5.5 Risk of Liver Enzyme Elevations with Concomitant Hepatitis C Treatment
During clinical trials with the Hepatitis C combination drug regimen that contains ombitasvir/paritaprevir/ritonavir, with or without dasabuvir, ALT elevations greater than 5 times the upper limit of normal (ULN), including some cases greater than 20 times the ULN, were significantly more frequent in women using ethinyl estradiol-containing medications, such as COCs. Discontinue Yasmin prior to starting therapy with the combination drug regimen ombitasvir/paritaprevir/ritonavir, with or without dasabuvir [see Contraindications (4)]. Yasmin can be restarted approximately 2 weeks following completion of treatment with the Hepatitis C combination drug regimen.
5.6 High Blood Pressure
For women with well-controlled hypertension, monitor blood pressure and stop Yasmin if blood pressure rises significantly. Women with uncontrolled hypertension or hypertension with vascular disease should not use COCs.
An increase in blood pressure has been reported in women taking COCs, and this increase is more likely in older women and with extended duration of use. The incidence of hypertension increases with increasing concentration of progestin.
5.7 Gallbladder Disease
Studies suggest a small increased relative risk of developing gallbladder disease among COC users.
5.8 Carbohydrate and Lipid Metabolic Effects
Carefully monitor prediabetic and diabetic women who are taking Yasmin. COCs may decrease glucose tolerance in a dose-related fashion.
Consider alternative contraception for women with uncontrolled dyslipidemia. A small proportion of women will have adverse lipid changes while on COCs.
Women with hypertriglyceridemia, or a family history thereof, may be at an increased risk of pancreatitis when using COCs.
5.9 Headache
If a woman taking Yasmin develops new headaches that are recurrent, persistent, or severe, evaluate the cause and discontinue Yasmin if indicated.
An increase in frequency or severity of migraine during COC use (which may be prodromal of a cerebrovascular event) may be a reason for immediate discontinuation of the COC.
5.10 Bleeding Irregularities
Unscheduled (breakthrough or intracyclic) bleeding and spotting sometimes occur in patients on COCs, especially during the first three months of use. If bleeding persists or occurs after previously regular cycles, check for causes such as pregnancy or malignancy. If pathology and pregnancy are excluded, bleeding irregularities may resolve over time or with a change to a different COC.
Data from ten contraceptive efficacy clinical trials (N=2,467) show that the percent of women who took Yasmin and experienced unscheduled bleeding decreased over time from 12% at cycle 2 to 6% (cycle 13). A total of 24 subjects out of 2,837 in the Yasmin trials (<1%) discontinued due to bleeding complaints. These are described as metrorrhagia, vaginal hemorrhage, menorrhagia, abnormal withdrawal bleeding, and menometrorrhagia.
The average duration of scheduled bleeding episodes in the majority of subjects (86%-88%) was 4-7 days. Women who use Yasmin may experience absence of withdrawal bleeding, even if they are not pregnant. Based on subject diaries from contraceptive efficacy trials, during cycles 2–13, 1-11% of women per cycle experienced no withdrawal bleeding. Some women may encounter post-pill amenorrhea or oligomenorrhea, especially when such a condition was pre-existent.
If withdrawal bleeding does not occur, consider the possibility of pregnancy. If the patient has not adhered to the prescribed dosing schedule (missed one or more active tablets or started taking them on a day later than she should have), consider the possibility of pregnancy at the time of the first missed period and take appropriate diagnostic measures. If the patient has adhered to the prescribed regimen and misses two consecutive periods, rule out pregnancy.
5.11 Depression
Women with a history of depression should be carefully observed and Yasmin discontinued if depression recurs to a serious degree.
5.12 Interference with Laboratory Tests
The use of COCs may change the results of some laboratory tests, such as coagulation factors, lipids, glucose tolerance, and binding proteins. Women on thyroid hormone replacement therapy may need increased doses of thyroid hormone because serum concentrations of thyroid-binding globulin increase with use of COCs [see Drug Interactions (7.2)].
DRSP causes an increase in plasma renin activity and plasma aldosterone induced by its mild anti-mineralocorticoid activity.
5.13 Monitoring
A woman who is taking COCs should have a yearly visit with her healthcare provider for a blood pressure check and for other indicated healthcare.
5.14 Other Conditions
In women with hereditary angioedema, exogenous estrogens may induce or exacerbate symptoms of angioedema. Chloasma may occasionally occur, especially in women with a history of chloasma gravidarum. Women with a tendency to chloasma should avoid exposure to the sun or ultraviolet radiation while taking COCs.
6. Adverse Reactions/Side Effects
The following serious adverse reactions with the use of COCs are discussed elsewhere in the labeling:
- •
- Serious cardiovascular events and stroke [see Boxed Warning and Warnings and Precautions (5.1)]
- •
- Vascular events [see Warnings and Precautions (5.1)]
- •
- Liver disease [see Warnings and Precautions (5.4)]
6.1 Clinical Trials Experience
Because clinical trials are conducted under widely varying conditions, the adverse reaction rates observed cannot be directly compared to rates in other clinical trials and may not reflect the rates observed in practice.
The data provided reflect the experience with the use of Yasmin (3 mg DRSP/0.03 mg EE) in the adequate and well-controlled studies for contraception (N=2,837). The US pivotal clinical study (N=326) was a multicenter, open-label trial in healthy women aged 18 -35 who were treated for up to 13 cycles. The second pivotal study (N=442)was a multicenter, randomized, open-label comparative European study of Yasmin vs. 0.150 mg desogestrel/0.03 mg EE conducted in healthy women aged 17-40 who were treated for up to 26 cycles.
The most common adverse reactions (≥ 2% of users) were: premenstrual syndrome (13.2%), headache/migraine (10.7%), breast pain/tenderness/discomfort (8.3%), nausea/vomiting (4.5%) abdominal pain/discomfort/tenderness (2.3%) and mood changes (depression, depressed mood, irritability, mood swings, mood altered and affect lability (2.3%).
Adverse Reactions (≥ 1%) Leading to Study Discontinuation:
Of 2,837 women, 6.7% discontinued from the clinical trials due to an adverse reaction; the most frequent adverse reaction leading to discontinuation was headache/migraine (1.5%).
Serious Adverse Reactions:
Depression, pulmonary embolism, toxic skin eruption, and uterine leiomyoma.
6.2 Postmarketing Experience
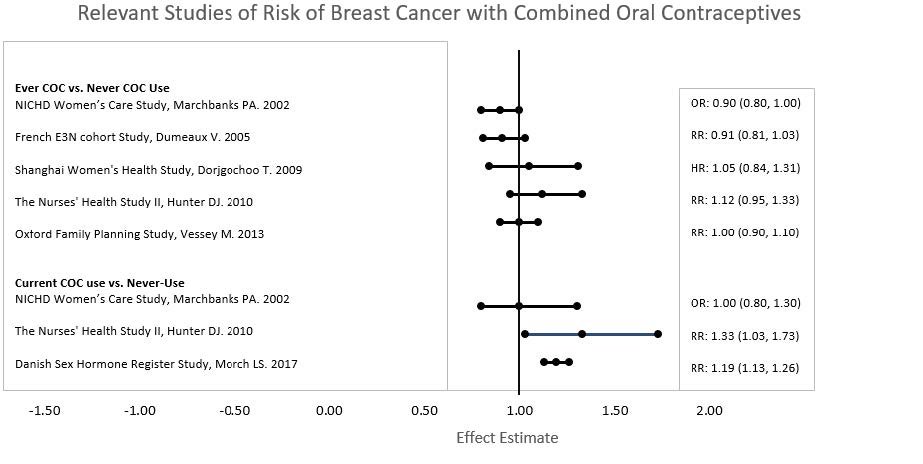
Five studies that compared breast cancer risk between ever-users (current or past use) of COCs and never-users of COCs reported no association between ever use of COCs and breast cancer risk, with effect estimates ranging from 0.90 — 1.12 (Figure 3).
Three studies compared breast cancer risk between current or recent COC users (<6 months since last use) and never users of COCs (Figure 3). One of these studies reported no association between breast cancer risk and COC use. The other two studies found an increased relative risk of 1.19 — 1.33 with current or recent use. Both of these studies found an increased risk of breast cancer with current use of longer duration, with relative risks ranging from 1.03 with less than one year of COC use to approximately 1.4 with more than 8-10 years of COC use.
Figure 3: Relative Studies of Risk of Breast Cancer with Combined Oral Contraceptives
RR = relative risk; OR = odds ratio; HR = hazard ratio. “ever COC” are females with current or past COC use; “never COC use” are females that never used COCs.
The following adverse reactions have been identified during post-approval use of Yasmin. Because these reactions are reported voluntarily from a population of uncertain size, it is not always possible to reliably estimate their frequency or establish a causal relationship to drug exposure.
Adverse reactions, including fatalities, are grouped into System Organ Classes and ordered by frequency.
Vascular disorders: Venous and arterial thromboembolic events (including pulmonary emboli, deep vein thrombosis, intracardiac thrombosis, intracranial venous sinus thrombosis, sagittal sinus thrombosis, retinal vein occlusion, myocardial infarction and stroke), hypertension
Hepatobiliary disorders: Gallbladder disease
Immune system disorders: Hypersensitivity
Metabolism and nutrition disorders: Hyperkalemia
Skin and subcutaneous tissue disorders: Chloasma
7. Drug Interactions
Consult the labeling of all concurrently-used drugs to obtain further information about interactions with hormonal contraceptives or the potential for enzyme alterations.
7.1 Effects of Other Drugs on Combined Oral Contraceptives
Substances diminishing the efficacy of COCs: Drugs or herbal products that induce certain enzymes, including cytochrome P450 3A4 (CYP3A4), may decrease the effectiveness of COCs or increase breakthrough bleeding. Some drugs or herbal products that may decrease the effectiveness of hormonal contraceptives include phenytoin, barbiturates, carbamazepine, bosentan, felbamate, griseofulvin, oxcarbazepine, rifampin, topiramate and products containing St. John’s wort. Interactions between oral contraceptives and other drugs may lead to breakthrough bleeding and/or contraceptive failure. Counsel women to use an alternative method of contraception or a back-up method when enzyme inducers are used with COCs, and to continue back-up contraception for 28 days after discontinuing the enzyme inducer to ensure contraceptive reliability.
Substances increasing the plasma concentrations of COCs: Co-administration of atorvastatin and certain COCs containing EE increase AUC values for EE by approximately 20%. Ascorbic acid and acetaminophen may increase plasma EE concentrations, possibly by inhibition of conjugation.
Concomitant administration of moderate or strong CYP3A4 inhibitors such as azole antifungals (e.g., ketoconazole, itraconazole, voriconazole, fluconazole), verapamil, macrolides (e.g., clarithromycin, erythromycin), diltiazem, and grapefruit juice can increase the plasma concentrations of the estrogen or the progestin or both. In a clinical drug-drug interaction study conducted in premenopausal women, once daily co-administration of DRSP 3 mg/EE 0.02 mg containing tablets with strong CYP3A4 inhibitor, ketoconazole 200 mg twice daily for 10 days resulted in a moderate increase of DRSP systemic exposure. The exposure of EE was increased mildly [see Warnings and Precautions (5.2) and Clinical Pharmacology (12.3)].
Human immunodeficiency virus (HIV)/Hepatitis C virus (HCV) protease inhibitors and non-nucleoside reverse transcriptase inhibitors: Significant changes (increase or decrease) in the plasma concentrations of estrogen and progestin have been noted in some cases of co-administration with HIV/HCV protease inhibitors or with non-nucleoside reverse transcriptase inhibitors.
Antibiotics: There have been reports of pregnancy while taking hormonal contraceptives and antibiotics, but clinical pharmacokinetic studies have not shown consistent effects of antibiotics on plasma concentrations of synthetic steroids.
7.2 Effects of Combined Oral Contraceptives on Other Drugs
COCs containing EE may inhibit the metabolism of other compounds. COCs have been shown to significantly decrease plasma concentrations of lamotrigine, likely due to induction of lamotrigine glucuronidation. This may reduce seizure control; therefore, dosage adjustments of lamotrigine may be necessary. Consult the labeling of the concurrently-used drug to obtain further information about interactions with COCs or the potential for enzyme alterations.
COCs Increasing the Plasma Concentrations of CYP450 Enzymes: In clinical studies, administration of a hormonal contraceptive containing EE did not lead to any increase or only to a weak increase in plasma concentrations of CYP3A4 substrates (e.g., midazolam) while plasma concentrations of CYP2C19 substrates (e.g., omeprazole and voriconazole) and CYP1A2 substrates (e.g., theophylline and tizanidine) can have a weak or moderate increase.
Clinical studies did not indicate an inhibitory potential of DRSP towards human CYP enzymes at clinically relevant concentrations [see Clinical Pharmacology (12.3)].
Women on thyroid hormone replacement therapy may need increased doses of thyroid hormone because serum concentration of thyroid-binding globulin increases with use of COCs.
Potential to Increase Serum Potassium Concentration: There is a potential for an increase in serum potassium concentration in women taking Yasmin with other drugs that may increase serum potassium concentration [see Warnings and Precautions (5.2) and Clinical Pharmacology (12.3)].
7.3 Concomitant Use with HCV Combination Therapy – Liver Enzyme Elevation
Do not co-administer Yasmin with HCV drug combinations containing ombitasvir/paritaprevir/ritonavir, with or without dasabuvir, due to potential for ALT elevations [see Warnings and Precautions (5.5)].
7.4 Interference with Laboratory Tests
The use of contraceptive steroids may influence the results of certain laboratory tests, such as coagulation factors, lipids, glucose tolerance, and binding proteins. DRSP causes an increase in plasma renin activity and plasma aldosterone induced by its mild anti-mineralocorticoid activity [see Warnings and Precautions (5.12) and Drug Interactions (7.2)].
8. Use In Specific Populations
8.1 Pregnancy
Risk Summary
There is no use for contraception in pregnancy; therefore, Yasmin should be discontinued during pregnancy. Epidemiologic studies and meta-analyses have not found an increased risk of genital or non-genital birth defects (including cardiac anomalies and limb-reduction defects) following exposure to CHCs before conception or during early pregnancy. In the U.S. general population, the estimated background risk of major birth defects and miscarriage in clinically recognized pregnancies is 2 to 4 percent and 15 to 20 percent, respectively.
Data
Human Data
A retrospective database study of women in Norway, that included 44,734 pregnancies of which 368 were women who inadvertently took drospirenone/ethinyl estradiol during the first trimester of a pregnancy, found there were no adverse effects on pre-term birth, small for gestational age, or birth weight Z-scores.
Post-marketing adverse event data on the use of Yasmin in pregnant women suggest that frequencies of miscarriage and congenital anomalies were not higher than the estimated background risk in the general population.
8.2 Lactation
Risk Summary
DRSP is present in human milk. After a single oral administration of 3 mg DRSP/0.03 mg EE tablets, DRSP concentration in breast milk over the 24-h period ranged from 1.4 to 7.0 ng/mL, with a mean ± standard deviation value of 3.7 ± 1.9 ng/mL.The estimated mean infant dose was 0.003 mg/day, which is about 0.1% of maternal dose (see Data).There is limited information on the effects of Yasmin on the breast-fed infant. CHCs can reduce milk production in breast-feeding females. This reduction can occur at any time but is less likely to occur once breast-feeding is well-established. When possible, advise the nursing female to use other methods of contraception until she discontinues breast-feeding. [See also Dosage and Administration (2.2)].
The developmental and health benefits of breast-feeding should be considered along with the mother’s clinical need for Yasmin and any potential adverse effects on the breast-fed child from Yasmin or from the underlying maternal condition.
Data
Human Data
An open-label study evaluated the degree of DRSP transfer into milk within 72 hours following a single oral administration of 3 mg DRSP/0.03 mg EE tablets to 6 healthy lactating women who were 1 week to 3 months post-partum. DRSP was present in breast milk with a mean Cmax of 13.5 ng/mL, while the mean Cmax in serum of lactating women was 30.8 ng/mL. The DRSP concentration in breast milk over the 24-hour period following dosing ranged from 1.4 to 7.0 ng/mL, with a mean ± standard deviation value of 3.7 ± 1.9 ng/mL. Based on single dose data, the maximal daily infant dose of DRSP was calculated to be 0.003 mg/day, which represented a mean of 0.1% of the maternal dose.
8.4 Pediatric Use
Safety and efficacy of Yasmin has been established in women of reproductive age. Efficacy is expected to be the same for postpubertal adolescents under the age of 18 and for users 18 years and older. Use of this product before menarche is not indicated.
8.5 Geriatric Use
Yasmin has not been studied in postmenopausal women and is not indicated in this population.
8.6 Patients with Renal Impairment
Yasmin is contraindicated in patients with renal impairment [see Contraindications (4) and Warnings and Precautions (5.2)].
In subjects with creatinine clearance (CLcr) of 50–79 mL/min, serum DRSP concentrations were comparable to those in a control group with CLcr ≥ 80 mL/min. In subjects with CLcr of 30–49 mL/min, serum DRSP concentrations were on average 37% higher than those in the control group. In addition, there is a potential to develop hyperkalemia in subjects with renal impairment whose serum potassium is in the upper reference range, and who are concomitantly using potassium sparing drugs [see Clinical Pharmacology (12.3)].
8.7 Patients with Hepatic Impairment
Yasmin is contraindicated in patients with hepatic disease [see Contraindications (4) and Warnings and Precautions (5.4)]. The mean exposure to DRSP in women with moderate liver impairment is approximately three times higher than the exposure in women with normal liver function. Yasmin has not been studied in women with severe hepatic impairment.
8.8 Race
No clinically significant difference was observed between the pharmacokinetics of DRSP or EE in Japanese versus Caucasian women [see Clinical Pharmacology (12.3)].
10. Overdosage
There have been no reports of serious ill effects from overdose, including ingestion by children. Overdosage may cause withdrawal bleeding in females and nausea.
DRSP is a spironolactone analogue which has anti-mineralocorticoid properties. Serum concentration of potassium and sodium, and evidence of metabolic acidosis, should be monitored in cases of overdose.
11. Yasmin Description
Yasmin (drospirenone/ethinyl estradiol) tablets provide an oral contraceptive regimen consisting of 28 film-coated tablets that contain the ingredients specified for each tablet below:
- •
- 21 yellow tablets each containing 3 mg DRSP and 0.03 mg EE
- •
- 7 inert white tablets
- •
- The inactive ingredients in the yellow tablets are lactose monohydrate NF, corn starch NF, pregelatinized starch NF, povidone 25000 NF, magnesium stearate NF, hypromellose USP, macrogol 6000 NF, titanium dioxide USP, talc USP, and ferric oxide pigment, yellow NF. The white inert film-coated tablets contain lactose monohydrate NF, microcrystalline cellulose NF, magnesium stearate NF, hypromellose USP, talc USP, and titanium dioxide USP.
Drospirenone (6R,7R,8R,9S,10R,13S,14S,15S,16S,17S)-1,3′,4′,6,6a,7,8,9,10,11,12,13, 14,15,15a,16-hexadecahydro-10,13-dimethylspiro-[17H-dicyclopropa-[6,7:15,16] cyclopenta[a]phenanthrene-17,2′(5H)-furan]-3,5′(2H)-dione) is a synthetic progestational compound and has a molecular weight of 366.5 and a molecular formula of C24H30O3.
Ethinyl estradiol (19-nor-17α-pregna 1,3,5(10)-triene-20-yne-3,17-diol) is a synthetic estrogenic compound and has a molecular weight of 296.4 and a molecular formula of C20H24O2.
The structural formulas are as follows:
12. Yasmin — Clinical Pharmacology
12.1 Mechanism of Action
COCs lower the risk of becoming pregnant primarily by suppressing ovulation.
12.2 Pharmacodynamics
Drospirenone is a spironolactone analogue with anti-mineralocorticoid activity. The estrogen in Yasmin is ethinyl estradiol (EE).
No specific pharmacodynamic studies were conducted with Yasmin.
12.3 Pharmacokinetics
Absorption
The absolute bioavailability of DRSP from a single entity tablet is about 76%. The absolute bioavailability of EE is approximately 40% as a result of presystemic conjugation and first-pass metabolism. The absolute bioavailability of Yasmin, which is a combination tablet of DRSP and EE, has not been evaluated. Serum concentrations of DRSP and EE reached peak levels within 1-2 hours after administration of Yasmin.
The pharmacokinetics of DRSP are dose proportional following single doses ranging from 1-10 mg. Following daily dosing of Yasmin, steady state DRSP concentrations were observed after 8 days. There was about 2 to 3 fold accumulation in serum Cmax and AUC (0-24h) values of DRSP following multiple dose administration of Yasmin (see Table 3).
For EE, steady-state conditions are reported during the second half of a treatment cycle. Following daily administration of Yasmin serum Cmax and AUC (0-24h) values of EE accumulate by a factor of about 1.5 to 2 (see Table 3).
|
|||||
|
DRSP |
|||||
|
Cycle / Day |
No. of Subjects |
Cmax |
Tmax |
AUC(0-24h) (ng•h/mL) |
t1/2 |
|
1/1 |
12 |
36.9 (13) |
1.7 (47) |
288 (25) |
NA* |
|
1/21 |
12 |
87.5 (59) |
1.7 (20) |
827 (23) |
30.9 (44) |
|
6/21 |
12 |
84.2 (19) |
1.8 (19) |
930 (19) |
32.5 (38) |
|
9/21 |
12 |
81.3 (19) |
1.6 (38) |
957 (23) |
31.4 (39) |
|
13/21 |
12 |
78.7 (18) |
1.6 (26) |
968 (24) |
31.1 (36) |
|
EE |
|||||
|
Cycle / Day |
No. of Subjects |
Cmax |
Tmax |
AUC(0-24h) (pg•h/mL) |
t1/2 |
|
1/1 |
11 |
53.5 (43) |
1.9 (45) |
280 (87) |
NA* |
|
1/21 |
11 |
92.1 (35) |
1.5 (40) |
461 (94) |
NA* |
|
6/21 |
11 |
99.1 (45) |
1.5 (47) |
346 (74) |
NA* |
|
9/21 |
11 |
87 (43) |
1.5 (42) |
485 (92) |
NA* |
|
13/21 |
10 |
90.5 (45) |
1.6 (38) |
469 (83) |
NA* |
Food Effect
The rate of absorption of DRSP and EE following single administration of a formulation similar to Yasmin was slower under fed (high fat meal) conditions with the serum Cmax being reduced about 40% for both components. The extent of absorption of DRSP, however, remained unchanged. In contrast, the extent of absorption of EE was reduced by about 20% under fed conditions.
Distribution
DRSP and EE serum concentrations decline in two phases. The apparent volume of distribution of DRSP is approximately 4 L/kg and that of EE is reported to be approximately 4–5 L/kg.
DRSP does not bind to sex hormone binding globulin (SHBG) or corticosteroid binding globulin (CBG) but binds about 97% to other serum proteins. Multiple dosing over 3 cycles resulted in no change in the free fraction (as measured at trough concentrations). EE is reported to be highly but non-specifically bound to serum albumin (approximately 98.5 %) and induces an increase in the serum concentrations of both SHBG and CBG. EE induced effects on SHBG and CBG were not affected by variation of the DRSP dosage in the range of 2 to 3 mg.
Metabolism
The two main metabolites of DRSP found in human plasma were identified to be the acid form of DRSP generated by opening of the lactone ring and the 4,5-dihydrodrospirenone-3-sulfate, formed by reduction and subsequent sulfation. These metabolites were shown not to be pharmacologically active. Drospirenone is also subject to oxidative metabolism catalyzed by CYP3A4.
EE has been reported to be subject to significant gut and hepatic first-pass metabolism. Metabolism of EE and its oxidative metabolites occur primarily by conjugation with glucuronide or sulfate. CYP3A4 in the liver is responsible for the 2-hydroxylation which is the major oxidative reaction. The 2-hydroxy metabolite is further transformed by methylation and glucuronidation prior to urinary and fecal excretion.
Excretion
DRSP serum concentrations are characterized by a terminal disposition phase half-life of approximately 30 hours after both single and multiple dose regimens. Excretion of DRSP was nearly complete after ten days and amounts excreted were slightly higher in feces compared to urine. DRSP was extensively metabolized and only trace amounts of unchanged DRSP were excreted in urine and feces. At least 20 different metabolites were observed in urine and feces. About 38-47% of the metabolites in urine were glucuronide and sulfate conjugates. In feces, about 17-20% of the metabolites were excreted as glucuronides and sulfates.
For EE the terminal disposition phase half-life has been reported to be approximately 24 hours. EE is not excreted unchanged. EE is excreted in the urine and feces as glucuronide and sulfate conjugates and undergoes enterohepatic circulation.
Use in Specific Populations
Pediatric Use: Safety and efficacy of Yasmin has been established in women of reproductive age. Efficacy is expected to be the same for postpubertal adolescents under the age of 18 and for users 18 years and older. Use of this product before menarche is not indicated.
Geriatric Use: Yasmin has not been studied in postmenopausal women and is not indicated in this population.
Race: No clinically significant difference was observed between the pharmacokinetics of DRSP or EE in Japanese versus Caucasian women (age 25-35) when 3 mg DRSP/0.02 mg EE was administered daily for 21 days. Other ethnic groups have not been specifically studied.
Renal Impairment: Yasmin is contraindicated in patients with renal impairment.
The effect of renal impairment on the pharmacokinetics of DRSP (3 mg daily for 14 days) and the effect of DRSP on serum potassium concentrations were investigated in three separate groups of female subjects (n=28, age 30-65). All subjects were on a low potassium diet. During the study, 7 subjects continued the use of potassium-sparing drugs for the treatment of their underlying illness. On the 14th day (steady-state) of DRSP treatment, the serum DRSP concentrations in the group with CLcr of 50–79 mL/min were comparable to those in the control group with CLcr ≥ 80 mL/min. The serum DRSP concentrations were on average 37% higher in the group with CLcr of 30–49 mL/min compared to those in the control group. DRSP treatment did not show any clinically significant effect on serum potassium concentration. Although hyperkalemia was not observed in the study, in five of the seven subjects who continued use of potassium sparing drugs during the study, mean serum potassium concentrations increased by up to 0.33 mEq/L. [See Contraindications (4) and Warnings and Precautions (5.2).]
Hepatic Impairment: Yasmin is contraindicated in patients with hepatic disease.
The mean exposure to DRSP in women with moderate liver impairment is approximately three times higher than the exposure in women with normal liver function. Yasmin has not been studied in women with severe hepatic impairment. [See Contraindications (4) and Warnings and Precautions (5.4).]
Drug Interactions
Consult the labeling of all concurrently used drugs to obtain further information about interactions with oral contraceptives or the potential for enzyme alterations.
Effects of Other Drugs on Combined Oral Contraceptives
Substances diminishing the efficacy of COCs: Drugs or herbal products that induce certain enzymes, including CYP3A4, may decrease the effectiveness of COCs or increase breakthrough bleeding.
Substances increasing the plasma concentrations of COCs: Co-administration of atorvastatin and certain COCs containing EE increase AUC values for EE by approximately 20%. Ascorbic acid and acetaminophen may increase plasma EE concentrations, possibly by inhibition of conjugation. In a clinical drug-drug interaction study conducted in 20 premenopausal women, co-administration of a DRSP (3 mg)/EE (0.02 mg) COC with the strong CYP3A4 inhibitor ketoconazole (200 mg twice daily) for 10 days increased the AUC(0-24h) of DRSP and EE by 2.68-fold (90% CI: 2.44, 2.95) and 1.40-fold (90% CI: 1.31, 1.49), respectively. The increases in Cmax were 1.97-fold (90% CI: 1.79, 2.17) and 1.39-fold (90% CI: 1.28, 1.52) for DRSP and EE, respectively. Although no clinically relevant effects on safety or laboratory parameters including serum potassium were observed, this study only assessed subjects for 10 days. The clinical impact for a patient taking a DRSP-containing COC concomitantly with chronic use of a CYP3A4/5 inhibitor is unknown [see Warnings and Precautions (5.2)].
HIV/HCV protease inhibitors and non-nucleoside reverse transcriptase inhibitors: Significant changes (increase or decrease) in the plasma concentrations of estrogen and progestin have been noted in some cases of co-administration with HIV/HCV protease inhibitors or with non-nucleoside reverse transcriptase inhibitors.
Antibiotics: There have been reports of pregnancy while taking hormonal contraceptives and antibiotics, but clinical pharmacokinetic studies have not shown consistent effects of antibiotics on plasma concentrations of synthetic steroids.
Effects of Combined Oral Contraceptives on Other Drugs
COCs containing EE may inhibit the metabolism of other compounds. COCs have been shown to significantly decrease plasma concentrations of lamotrigine, likely due to induction of lamotrigine glucuronidation. This may reduce seizure control; therefore, dosage adjustments of lamotrigine may be necessary. Consult the labeling of the concurrently-used drug to obtain further information about interactions with COCs or the potential for enzyme alterations.
In vitro, EE is a reversible inhibitor of CYP2C19, CYP1A1 and CYP1A2 as well as a mechanism-based inhibitor of CYP3A4/5, CYP2C8, and CYP2J2. Metabolism of DRSP and potential effects of DRSP on hepatic CYP enzymes have been investigated in in vitro and in vivo studies. In in vitro studies DRSP did not affect turnover of model substrates of CYP1A2 and CYP2D6, but had an inhibitory influence on the turnover of model substrates of CYP1A1, CYP2C9, CYP2C19, and CYP3A4, with CYP2C19 being the most sensitive enzyme. The potential effect of DRSP on CYP2C19 activity was investigated in a clinical pharmacokinetic study using omeprazole as a marker substrate. In the study with 24 postmenopausal women [including 12 women with homozygous (wild type) CYP2C19 genotype and 12 women with heterozygous CYP2C19 genotype] the daily oral administration of 3 mg DRSP for 14 days did not affect the oral clearance of omeprazole (40 mg, single oral dose) and the CYP2C19 product 5-hydroxy omeprazole. Furthermore, no significant effect of DRSP on the systemic clearance of the CYP3A4 product omeprazole sulfone was found. These results demonstrate that DRSP did not inhibit CYP2C19 and CYP3A4 in vivo.
Two additional clinical drug-drug interaction studies using simvastatin and midazolam as marker substrates for CYP3A4 were each performed in 24 healthy postmenopausal women. The results of these studies demonstrated that pharmacokinetics of the CYP3A4 substrates were not influenced by steady state DRSP concentrations achieved after administration of 3 mg DRSP/day.
Women on thyroid hormone replacement therapy may need increased doses of thyroid hormone because serum concentration of thyroid-binding globulin increases with use of COCs.
Interactions With Drugs That Have the Potential to Increase Serum Potassium Concentration: There is a potential for an increase in serum potassium concentration in women taking Yasmin with other drugs that may increase serum potassium concentration [see Warnings and Precautions (5.2)].
A drug-drug interaction study of DRSP 3 mg/estradiol (E2) 1 mg versus placebo was performed in 24 mildly hypertensive postmenopausal women taking enalapril maleate 10 mg twice daily. Potassium concentrations were obtained every other day for a total of 2 weeks in all subjects. Mean serum potassium concentrations in the DRSP/E2 treatment group relative to baseline were 0.22 mEq/L higher than those in the placebo group. Serum potassium concentrations also were measured at multiple time points over 24 hours at baseline and on Day 14. On Day 14, the ratios for serum potassium Cmax and AUC in the DRSP/E2 group to those in the placebo group were 0.955 (90% CI: 0.914, 0.999) and 1.010 (90% CI: 0.944, 1.08), respectively. No patient in either treatment group developed hyperkalemia (serum potassium concentrations >5.5 mEq/L).
13. Nonclinical Toxicology
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
In a 24 month oral carcinogenicity study in mice dosed with 10 mg/kg/day DRSP alone or 1 + 0.01, 3 + 0.03 and 10 + 0.1 mg/kg/day of DRSP and EE, 0.1 to 2 times the exposure (AUC of DRSP) of women taking a contraceptive dose, there was an increase in carcinomas of the harderian gland in the group that received the high dose of DRSP alone. In a similar study in rats given 10 mg/kg/day DRSP alone or 0.3 + 0.003, 3 + 0.03 and 10 + 0.1 mg/kg/day DRSP and EE, 0.8 to
10 times the exposure of women taking a contraceptive dose, there was an increased incidence of benign and total (benign and malignant) adrenal gland pheochromocytomas in the group receiving the high dose of DRSP. Mutagenesis studies for DRSP were conducted in vivo and in vitro and no evidence of mutagenic activity was observed. [See Warnings and Precautions (5.3, 5.4)].
14. Clinical Studies
In the clinical efficacy studies of up to 2 years duration, 2,629 subjects completed 33,160 cycles of use without any other contraception. The mean age of the subjects was 25.5 ± 4.7 years. The age range was 16 to 37 years. The racial demographic was: 83% Caucasian, 1% Hispanic, 1% Black, <1% Asian, <1% other, <1% missing data, 14% not inquired and <1% unspecified. Pregnancy rates in the clinical trials were less than one per 100 woman-years of use.
15 REFERENCES
1. Seeger, J.D., Loughlin, J., Eng, P.M., Clifford, C.R., Cutone, J., and Walker, A.M. (2007). Risk of thromboembolism in women taking ethinylestradiol/drospirenone and other oral contraceptives. Obstet Gynecol 110, 587-593.
2. Dinger, J.C., Heinemann, L.A., and Kuhl-Habich, D. (2007). The safety of a drospirenone-containing oral contraceptive: final results from the European Active Surveillance Study on oral contraceptives based on 142,475 women-years of observation. Contraception 75, 344-354.
3. Combined hormonal contraceptives (CHCs) and the risk of cardiovascular endpoints. Sidney, S. (primary author) http://www.fda.gov/downloads/Drugs/DrugSafety/UCM277384.pdf, accessed Oct 27, 2011.
4. Lidegaard, O., Lokkegaard, E., Svendsen, A.L., and Agger, C. (2009). Hormonal contraception and risk of venous thromboembolism: national follow-up study. BMJ 339, b2890.
5. Lidegaard, O., Nielsen, L.H., Skovlund, C.W., Skjeldestad, F.E., and Lokkegaard, E. (2011). Risk of venous thromboembolism from use of oral contraceptives containing different progestogens and oestrogen doses: Danish cohort study, 2001-9. BMJ 343, d6423.
6. van Hylckama Vlieg, A., Helmerhorst, F.M., Vandenbroucke, J.P., Doggen, C.J., and Rosendaal, F.R. (2009). The venous thrombotic risk of oral contraceptives, effects of oestrogen dose and progestogen type: results of the MEGA case-control study. BMJ 339, b2921.
7. Dinger, J., Assmann, A., Mohner, S., and Minh, T.D. (2010). Risk of venous thromboembolism and the use of dienogest- and drospirenone-containing oral contraceptives: results from a German case-control study. J Fam Plann Reprod Health Care 36, 123-129.
8. Jick, S.S., and Hernandez, R.K. (2011). Risk of non-fatal venous thromboembolism in women using oral contraceptives containing drospirenone compared with women using oral contraceptives containing levonorgestrel: case-control study using United States claims data. BMJ 342, d2151.
9. Parkin, L., Sharples, K., Hernandez, R.K., and Jick, S.S. (2011). Risk of venous thromboembolism in users of oral contraceptives containing drospirenone or levonorgestrel: nested case-control study based on UK General Practice Research Database. BMJ 342, d2139.
16. How is Yasmin supplied
16.1 How Supplied
Yasmin (drospirenone/ethinyl estradiol) tablets are available in packages of three blister packs (NDC 50419-402-03).
The film-coated tablets are rounded with biconvex faces, one side is embossed with a regular hexagon shape with DO or DP.
Each blister pack contains 28 film-coated tablets in the following order:
- •
- 21 round, biconvex, yellow, film-coated tablets with embossed “DO” in a regular hexagon on one side each containing 3 mg drospirenone and 0.03 mg ethinyl estradiol
- •
- 7 round, biconvex, white, film-coated tablets with embossed “DP” in a regular hexagon on one side
16.2 Storage
Store at 25°C (77°F); excursions permitted to 15-30°C (59-86°F) [see USP Controlled Room Temperature].
17. Patient Counseling Information
Advise the patient to read the FDA-approved patient labeling (Patient Information).
- •
- Counsel patients that cigarette smoking increases the risk of serious cardiovascular events from COC use, and that women who are over 35 years old and smoke should not use COCs.
- •
- Counsel patients that the increased risk of VTE compared to non-users of COCs is greatest after initially starting a COC or restarting (following a 4-week or greater pill-free interval) the same or a different COC.
- •
- Counsel patients about the information regarding the risk of VTE with DRSP-containing COCs compared to COCs that contain levonorgestrel or some other progestins.
- •
- Counsel patients that Yasmin does not protect against HIV infection (AIDS) and other sexually transmitted diseases.
- •
- Counsel patients on Warnings and Precautions associated with COCs.
- •
- Counsel patients that Yasmin contains DRSP. Drospirenone may increase potassium. Patients should be advised to inform their healthcare provider if they have kidney, liver or adrenal disease because the use of Yasmin in the presence of these conditions could cause serious heart and health problems. They should also inform their healthcare provider if they are currently on daily, long-term treatment (NSAIDs, potassium-sparing diuretics, potassium supplementation, ACE inhibitors, angiotensin-II receptor antagonists, heparin or aldosterone antagonists) for a chronic condition or taking strong CYP3A4 inhibitors.
- •
- Inform patients that Yasmin is not indicated during pregnancy. If pregnancy occurs during treatment with Yasmin, instruct the patient to stop further intake.
- •
- Counsel patients to take one tablet daily by mouth at the same time every day. Instruct patients what to do in the event pills are missed.
- •
- Counsel patients to use a back-up or alternative method of contraception when enzyme inducers are used with COCs.
- •
- Counsel patients who are breastfeeding or who desire to breastfeed that COCs may reduce breast milk production. This is less likely to occur if breastfeeding is well established.
- •
- Counsel any patient who starts COCs postpartum, and who has not yet had a period, to use an additional method of contraception until she has taken a yellow tablet for 7 consecutive days.
- •
- Counsel patients that amenorrhea may occur. Rule out pregnancy in the event of amenorrhea in two or more consecutive cycles.
Manufactured for:
Bayer HealthCare Pharmaceuticals Inc.
Whippany, NJ 07981
Manufactured in Germany
©2015 Bayer HealthCare Pharmaceuticals Inc. All Rights Reserved
Bayer HealthCare Pharmaceuticals Inc.
FDA Approved Patient Labeling
Guide for Using Yasmin
- WARNING TO WOMEN WHO SMOKE
- Do not use Yasmin if you smoke cigarettes and are over 35 years old. Smoking increases your risk of serious cardiovascular side effects (heart and blood vessel problems) from birth control pills, including death from heart attack, blood clots or stroke. This risk increases with age and the number of cigarettes you smoke.
Birth control pills help to lower the chances of becoming pregnant when taken as directed. They do not protect against HIV infection (AIDS) and other sexually transmitted diseases.
What Is Yasmin?
Yasmin is a birth control pill. It contains two female hormones, a synthetic estrogen called ethinyl estradiol and a progestin called drospirenone.
The progestin drospirenone may increase potassium. Therefore, you should not take Yasmin if you have kidney, liver or adrenal disease because this could cause serious heart and health problems. Other drugs may also increase potassium. If you are currently on daily, long-term treatment for a chronic condition with any of the medications below, you should consult your healthcare provider about whether Yasmin is right for you, and during the first month that you take Yasmin, you should have a blood test to check your potassium level.
- •
- NSAIDs (ibuprofen [Motrin, Advil], naproxen [Aleve and others] when taken long-term and daily for treatment of arthritis or other problems)
- •
- Potassium-sparing diuretics (spironolactone and others)
- •
- Potassium supplementation
- •
- ACE inhibitors (Capoten, Vasotec, Zestril and others)
- •
- Angiotensin-II receptor antagonists (Cozaar, Diovan, Avapro and others)
- •
- Heparin
- •
- Aldosterone antagonists
How Well Does Yasmin Work?
Your chance of getting pregnant depends on how well you follow the directions for taking your birth control pills. The better you follow the directions, the less chance you have of getting pregnant.
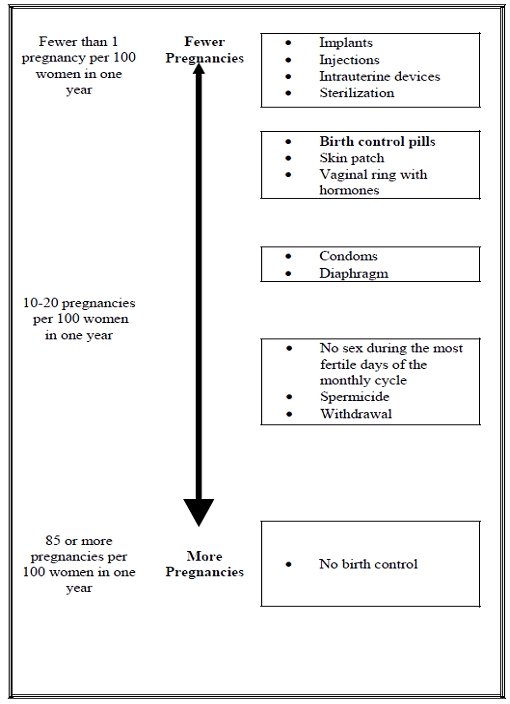
Based on the results of two clinical studies, about 1 woman out of 100 women may get pregnant during the first year they use Yasmin.
The following chart shows the chance of getting pregnant for women who use different methods of birth control. Each box on the chart contains a list of birth control methods that are similar in effectiveness. The most effective methods are at the top of the chart. The box on the bottom of the chart shows the chance of getting pregnant for women who do not use birth control and are trying to get pregnant.
How Do I Take Yasmin?
1. Be sure to read these directions before you start taking your pills or anytime you are not sure what to do.
2. The right way to take the pill is to take one pill every day at the same time in the order directed on the package. Preferably, take the pill after the evening meal or at bedtime, with some liquid, as needed. Yasmin can be taken without regard to meals.
If you miss pills you could get pregnant. This includes starting the pack late. The more pills you miss, the more likely you are to get pregnant. See «WHAT TO DO IF YOU MISS PILLS” below.
3. Many women have spotting or light bleeding at unexpected times, or may feel sick to their stomach during the first 1-3 packs of pills.
If you do have spotting or light bleeding or feel sick to your stomach, do not stop taking the pill. The problem will usually go away. If it does not go away, check with your healthcare provider.
4. Missing pills can also cause spotting or light bleeding, even when you make up these missed pills.
On the days you take two pills, to make up for missed pills, you could also feel a little sick to your stomach.
5. If you have vomiting (within 3 to 4 hours after you take your pill), you should follow the instructions for «WHAT TO DO IF YOU MISS PILLS.» If you have diarrhea or if you take certain medicines, including some antibiotics and some herbal products such as St. John’s Wort, your pills may not work as well.
Use a back-up method (such as condoms and spermicides) until you check with your healthcare provider.
6. If you have trouble remembering to take the pill, talk to your healthcare provider about how to make pill-taking easier or about using another method of birth control.
7. If you have any questions or are unsure about the information in this leaflet, call your healthcare provider.
Before You Start Taking Your Pills
1. Decide What Time of Day You Want to Take Your Pill
It is important to take Yasmin in the order directed on the package at the same time every day, preferably after the evening meal or at bedtime, with some liquid, as needed. Yasmin can be taken without regard to meals.
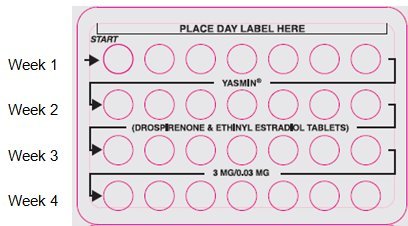
2. Look at Your Pill Pack – It has 28 Pills
The Yasmin pill pack has 21 yellow pills (with hormones) to be taken for three weeks, followed by 7 white pills (without hormones) to be taken for one week.
3. Also look for:
a) Where on the pack to start taking pills,
b) In what order to take the pills (follow the arrows)
4. Be sure you have ready at all times (a) another kind of birth control (such as condoms and spermicides) to use as a back-up in case you miss pills, and (b) an extra, full pill pack.
When To Start the First Pack of Pills
You have a choice for which day to start taking your first pack of pills. Decide with your healthcare provider which is the best day for you. Pick a time of day which will be easy to remember.
Day 1 Start:
1. Take the first yellow pill of the pack during the first 24 hours of your period.
2. You will not need to use a back-up method of birth control, because you are starting the Pill at the beginning of your period. However, if you start Yasmin later than the first day of your period, you should use another method of birth control (such as a condom and spermicide) as a back-up method until you have taken 7 yellow pills.
Sunday Start:
1. Take the first yellow pill of the pack on the Sunday after your period starts, even if you are still bleeding. If your period begins on Sunday, start the pack that same day.
2. Use another method of birth control (such as a condom and spermicide) as a back-up method if you have sex anytime from the Sunday you start your first pack until the next Sunday (7 days). This also applies if you start Yasmin after having been pregnant and you have not had a period since your pregnancy.
When You Switch From a Different Birth Control Pill
When switching from another birth control pill, Yasmin should be started on the same day that a new pack of the previous birth control pill would have been started.
When You Switch From Another Type of Birth Control Method
When switching from a transdermal patch or vaginal ring, Yasmin should be started when the next application would have been due. When switching from an injection, Yasmin should be started when the next dose would have been due. When switching from an intrauterine contraceptive or an implant, Yasmin should be started on the day of removal.
What to Do During the Month
1. Take one pill at the same time every day until the pack is empty.
Do not skip pills even if you are spotting or bleeding between monthly periods or feel sick to your stomach (nausea).
Do not skip pills even if you do not have sex very often.
2. When you finish a pack of pills, start the next pack on the day after your last white pill. Do not wait any days between packs.
What to Do if You Miss Pills
If you miss 1 yellow pill of your pack:
- 1. Take it as soon as you remember. Take the next pill at your regular time. This means you may take two pills in one day.
- 2. You do not need to use a back-up birth control method if you have sex.
If you miss 2 yellow pills in a row in Week 1 or Week 2 of your pack:
- 1. Take two pills on the day you remember and two pills the next day.
- 2. Then take one pill a day until you finish the pack.
- 3. You could become pregnant if you have sex in the 7 days after you restart your pills. You must use another birth control method (such as a condom and spermicide) as a back-up for those 7 days.
If you miss 2 yellow pills in a row in Week 3 or Week 4 of your pack:
- 1. If you are a Day 1 Starter:
- Throw out the rest of the pill pack and start a new pack that same day.
- 2. If you are a Sunday Starter:
- Keep taking one pill every day until Sunday. On Sunday, throw out the rest of the pack and start a new pack of pills that same day.
- 3. You could become pregnant if you have sex in the 7 days after you restart your pills. You must use another birth control method (such as a condom and spermicide) as a back-up for those 7 days.
- 4. You may not have your period this month but this is expected. However, if you miss your period two months in a row, call your healthcare provider because you might be pregnant.
If you miss 3 or more yellow pills in a row during any week:
- 1. If you are a Day 1 Starter:
- Throw out the rest of the pill pack and start a new pack that same day.
- 2. If you are a Sunday Starter:
- Keep taking 1 pill every day until Sunday. On Sunday, throw out the rest of the pack and start a new pack of pills that same day.
- 3. You could become pregnant if you have sex in the 7 days after you restart your pills. You must use another birth control method (such as condoms and spermicides) as a back-up for those 7 days.
- 4. You may not have your period this month but this is expected. However, if you miss your period two months in a row, call your healthcare provider because you might be pregnant.
If you miss any of the 7 white pills in Week 4:
- Throw away the pills you missed.
- Keep taking one pill each day until the pack is empty.
- You do not need a back-up method.
Finally, if you are still not sure what to do about the pills you have missed:
- Use a back-up method (such as condoms and spermicides) anytime you have sex.
- Contact your healthcare provider and continue taking one active yellow pill each day until otherwise directed.
WHO SHOULD NOT TAKE Yasmin?
Your healthcare provider will not give you Yasmin if you:
- •
- Ever had blood clots in your legs (deep vein thrombosis), lungs (pulmonary embolism), or eyes (retinal thrombosis)
- •
- Ever had a stroke
- •
- Ever had a heart attack
- •
- Have certain heart valve problems or heart rhythm abnormalities that can cause blood clots to form in the heart
- •
- Have an inherited problem with your blood that makes it clot more than normal
- •
- Have high blood pressure that medicine can’t control
- •
- Have diabetes with kidney, eye, nerve, or blood vessel damage
- •
- Ever had certain kinds of severe migraine headaches with aura, numbness, weakness or changes in vision
- •
- Ever had breast cancer which may be sensitive to female hormones
- •
- Have liver disease, including liver tumors
- •
- Take any Hepatitis C drug combination containing ombitasvir/paritaprevir/ritonavir, with or without dasabuvir. This may increase levels of the liver enzyme “alanine aminotransferase” (ALT) in the blood.
- •
- Have kidney disease
- •
- Have adrenal disease
Also, do not take birth control pills if you:
- •
- Smoke and are over 35 years old
- •
- Are or suspect you are pregnant
Birth control pills may not be a good choice for you if you have ever had jaundice (yellowing of the skin or eyes) caused by pregnancy (also called cholestasis of pregnancy).
Tell your healthcare provider if you have ever had any of the above conditions (your healthcare provider can recommend another method of birth control).
What Else Should I Know about Taking Yasmin?
Birth control pills do not protect you against any sexually transmitted disease, including HIV, the virus that causes AIDS.
Do not skip any pills, even if you do not have sex often.
- If you miss a period, you could be pregnant. However, some women miss periods or have light periods on birth control pills, even when they are not pregnant. Contact your healthcare provider for advice if you:
- •
- Think you are pregnant
- •
- Miss one period and have not taken your birth control pills on time every day
- •
- Miss two periods in a row
Birth control pills should not be taken during pregnancy. However, birth control pills taken by accident during pregnancy are not known to cause birth defects.
Due to an increased risk of blood clots, you should stop Yasmin at least four weeks before you have major surgery and not restart it until at least two weeks after the surgery.
If you are breastfeeding, consider another birth control method until you are ready to stop breastfeeding. Birth control pills that contain estrogen, like Yasmin, may decrease the amount of milk you make. A small amount of the pill’s hormones pass into breast milk.
If you have vomiting or diarrhea, your birth control pills may not work as well. Take another pill if you vomit within 3-4 hours after taking your pill, or use another birth control method, like condoms and a spermicide, until you check with your healthcare provider.
If you are scheduled for any laboratory tests, tell your doctor you are taking birth-control pills. Certain blood tests may be affected by birth-control pills.
Tell your healthcare provider about all the medicines you take, including prescription and over-the-counter medicines, vitamins and herbal supplements.
Yasmin may affect the way other medicines work, and other medicines may affect how well Yasmin works. Know the medicines you take.
Keep a list of them to show your healthcare provider and pharmacist when you get a new medicine.
What are the Most Serious Risks of Taking Birth Control Pills?
Like pregnancy, birth control pills increase the risk of serious blood clots (see following graph), especially in women who have other risk factors, such as smoking, obesity, or age greater than 35. This increased risk is highest when you first start taking birth control pills and when you restart the same or different birth control pills after not using them for a month or more. Women who use birth control pills with drospirenone (like Yasmin) may have a higher risk of getting a blood clot. Some studies reported that the risk of blood clots was higher for women who use birth control pills that contain drospirenone than for women who use birth control pills that do not contain drospirenone.
Talk with your healthcare provider about your risk of getting a blood clot before deciding which birth control pill is right for you.
It is possible to die or be permanently disabled from a problem caused by a blood clot, such as a heart attack or a stroke. Some examples of serious clots are blood clots in the:
- •
- Legs (deep vein thrombosis or DVT)
- •
- Lungs (pulmonary embolus or PE)
- •
- Eyes (loss of eyesight)
- •
- Heart (heart attack)
- •
- Brain (stroke)
To put the risk of developing a blood clot into perspective: If 10,000 women who are not pregnant and do not use birth control pills are followed for one year, between 1 and 5 of these women will develop a blood clot. The figure below shows the likelihood of developing a serious blood clot for women who are not pregnant and do not use birth control pills, for women who use birth control pills, for pregnant women, and for women in the first 12 weeks after delivering a baby.
Likelihood of Developing a Serious Blood Clot
A few women who take birth control pills may get:
- •
- High blood pressure
- •
- Gallbladder problems
- •
- Rare cancerous or noncancerous liver tumors
All of these events are uncommon in healthy women.
Call your healthcare provider right away if you have:
- •
- Persistent leg pain
- •
- Sudden shortness of breath
- •
- Sudden blindness, partial or complete
- •
- Severe pain in your chest
- •
- Sudden, severe headache unlike your usual headaches
- •
- Weakness or numbness in an arm or leg, or trouble speaking
- •
- Yellowing of the skin or eyeballs
What are the Common Side Effects of Birth Control Pills?
The most common side effects of birth control pills are:
- •
- Spotting or bleeding between menstrual periods
- •
- Nausea
- •
- Breast tenderness
- •
- Headache
These side effects are usually mild and usually disappear with time.
Less common side effects are:
- •
- Acne
- •
- Less sexual desire
- •
- Bloating or fluid retention
- •
- Blotchy darkening of the skin, especially on the face
- •
- High blood sugar, especially in women who already have diabetes
- •
- High fat (cholesterol; triglyceride) levels in the blood
- •
- Depression, especially if you have had depression in the past. Call your healthcare provider immediately if you have any thoughts of harming yourself.
- •
- Problems tolerating contact lenses
- •
- Weight changes
This is not a complete list of possible side effects. Talk to your healthcare provider if you develop any side effects that concern you. You may report side effects to the FDA at 1-800-FDA-1088.
No serious problems have been reported from a birth control pill overdose, even when accidentally taken by children.
Do Birth Control Pills Cause Cancer?
It is not known if hormonal birth control pills cause breast cancer. Some studies, but not all, suggest that there could be a slight increase in the risk of breast cancer among current users with longer duration of use.
If you have breast cancer now, or have had it in the past, do not use hormonal birth control because some breast cancers are sensitive to hormones.
Women who use birth control pills may have a slightly higher chance of getting cervical cancer. However, this may be due to other reasons such as having more sexual partners.
What Should I Know about My Period when Taking Yasmin?
Irregular vaginal bleeding or spotting may occur while you are taking Yasmin. Irregular bleeding may vary from slight staining between menstrual periods to breakthrough bleeding, which is a flow much like a regular period. Irregular bleeding occurs most often during the first few months of oral contraceptive use, but may also occur after you have been taking the pill for some time. Such bleeding may be temporary and usually does not indicate any serious problems. It is important to continue taking your pills on schedule. If the bleeding occurs in more than one cycle, is unusually heavy, or lasts for more than a few days, call your healthcare provider.
Some women may not have a menstrual period but this should not be cause for alarm as long has you have taken the pills regularly on time.
What if I Miss My Scheduled Period when Taking Yasmin?
It is not uncommon to miss your period. However, if you miss two periods in a row or miss one period when you have not taken your birth control pills regularly on time, call your healthcare provider. Also notify your healthcare provider if you have symptoms of pregnancy such as morning sickness or unusual breast tenderness. It is important that your healthcare provider checks you to find out if you are pregnant. Stop taking Yasmin if you are pregnant.
What if I Want to Become Pregnant?
You may stop taking the pill whenever you wish. Consider a visit with your healthcare provider for a pre-pregnancy checkup before you stop taking the pill.
General Advice about Yasmin
Your healthcare provider prescribed Yasmin for you. Please do not share Yasmin with anyone else. Keep Yasmin out of the reach of children.
If you have concerns or questions, ask your healthcare provider. You may also ask your healthcare provider for a more detailed label written for medical professionals.
Package/Label Principal Display Panel
NDC 50419-402-01
1 Unit
YASMIN
(drospirenone and ethinyl estradiol tablets) 3 mg/0.03 mg
This product (like all oral contraceptives) is intended to prevent pregnancy. It does not protect against HIV infection (AIDS) and other sexually transmitted diseases.
Store at 25°C with excursions permitted between15–30°C. [See USP Controlled Room Temperature].
To the Dispenser: This unit contains two pieces of information intended for the patient, which are combined in a single booklet. This informational piece is to be provided to the patient with eachprescription.
Rx only
Произношение
Общее название: дроспиренон и этинилэстрадиол (dro SPY re-out, ETH in il, ESS tra dy ol)
Торговое название: Джанви, Лорина, Никки, Очелла, Сайда, Вестура, Ясмин, Яз, Зара
Ясмин (дроспиренон и этинилэстрадиол) предотвращает овуляцию (высвобождение яйца из яичника), а также вызывает изменения в вашей шейной и маточной оболочках, что затрудняет достижение спермы в матке и более сложное для оплодотворенного яйца для прикрепления к матке ,
Ясмин используется женщинами в качестве контрацептива для предотвращения беременности.
Yasmin также может использоваться для целей, не указанных в данном руководстве.
Не используйте Yasmin, если вы беременны или если у вас недавно был ребенок.
Вы не должны принимать Ясмин, если у вас есть одно из следующих состояний: неконтролируемое высокое кровяное давление, сердечные заболевания, нарушение свертывания крови, проблемы с кровообращением, диабетические проблемы с глазами или почками, необычные вагинальные кровотечения, заболевания печени или рак печени, тяжелые Головные боли мигрени, если вы курите и старше 35 лет, или если у вас когда-либо были рак груди или матки, желтуха, вызванная противозачаточными таблетками, сердечным приступом, инсультом или сгустком крови.
Слайд-шоу Депрессия, риск самоубийства и варианты лечения
Принимая Ясмин, вы можете увеличить свой риск сгустков крови, инсульта или сердечного приступа, особенно если у вас есть другие условия или у вас избыточный вес.
Курение может значительно увеличить риск возникновения сгустков крови, инсульта или сердечного приступа. Вы не должны принимать Ясмин, если вы курите и старше 35 лет.
Взятие Ясмин может увеличить риск возникновения сгустков крови, инсульта или сердечного приступа. Вы еще более подвержены риску, если у вас высокое кровяное давление, диабет, высокий уровень холестерина или избыточный вес. Ваш риск инсульта или сгустка крови является самым высоким в течение вашего первого года приема противозачаточных таблеток. Ваш риск также высок, когда вы перезапускаете Yasmin после того, как не принимаете их в течение 4 недель или дольше.
Курение может значительно увеличить риск возникновения сгустков крови, инсульта или сердечного приступа. Ваш риск увеличивается, если вы старше, и чем больше вы курите. Вы не должны принимать комбинированные противозачаточные таблетки, если вы курите и старше 35 лет.
Не используйте, если вы беременны. Прекратите принимать Ясмин и расскажите своему врачу, если вы забеременели, или если вы пропустите два менструальных цикла подряд. Если у вас недавно был ребенок, подождите не менее 4 недель, прежде чем принимать Ясмин.
Вы не должны принимать Ясмин, если у вас есть:
-
Необработанное или неконтролируемое высокое кровяное давление;
-
Болезни сердца (болезнь коронарной артерии, неконтролируемое нарушение сердечного клапана, история сердечного приступа, инсульта или сгустка крови);
-
Расстройство свертывания крови или проблемы с кровообращением;
-
Проблемы с глазами, почками или кровообращением, вызванные диабетом;
-
История рака, связанного с гормонами, такого как рак молочной железы или матки;
-
Необычное вагинальное кровотечение, которое не было проверено врачом;
-
Болезни печени, рака печени, истории желтухи, вызванной беременностью или противозачаточными таблетками; или
-
Сильные головные боли мигрени (с аурой, онемением, слабостью или изменениями зрения), особенно если вы старше 35 лет.
Чтобы убедиться, что Yasmin безопасен для вас, сообщите своему врачу, если у вас есть:
-
Высокое кровяное давление, варикозное расширение вен;
-
Высокий уровень холестерина или триглицеридов, или если у вас избыточный вес;
-
Дисбаланс электролита (например, высокий уровень калия в крови);
-
История депрессии;
-
Диабет, недостаточная тиреоидная болезнь, болезнь желчного пузыря;
-
Судороги или эпилепсия;
-
туберкулез; или
-
История фиброзно-кистозной болезни молочной железы, глыбы, узлы или аномальная маммограмма.
Гормоны в Yasmin могут переходить в грудное молоко и могут нанести вред грудному ребенку. Ясмин также может замедлить производство грудного молока. Не используйте, если вы кормите грудью.
Возьмите Ясмин точно так, как предписано вашим доктором. Следуйте всем указаниям на этикетке рецепта. Не принимайте это лекарство в больших или меньших количествах или дольше, чем рекомендуется. Вы получите первую таблетку в первый день вашего периода или в первое воскресенье после начала периода. Возможно, вам придется использовать резервный контроль рождаемости, например презервативы или спермицид, когда вы впервые начнете использовать Yasmin. Следуйте инструкциям вашего врача.
Правильный способ приема таблетки — принимать по одной таблетке каждый день в одно и то же время в порядке, указанном на упаковке. Предпочтительно принимать таблетку после ужина или перед сном, при необходимости, с какой-то жидкостью. Ясмин можно принимать без учета блюд.
Когда таблетки закончились, запустите новую упаковку на следующий день. Вы можете забеременеть, если вы не принимаете одну таблетку в день. Получите рецепт, наполненный до того, как вы исчерпаете таблетки полностью.
Пакеты Yasmin содержат 21 желтую таблетку (с гормонами) и семь белых «напоминающих» таблеток. Напоминающие таблетки дают вам перерыв от гормональных таблеток и удерживают вас на регулярном цикле. Ваш период обычно начинается, когда вы используете белые напоминания.
У вас может быть прорыв кровотечения, особенно в течение первых 3 месяцев. Расскажите своему врачу, если это кровотечение продолжается или очень тяжело.
Используйте резервный контроль над рождаемостью, если вы больны сильной рвотой или диареей.
Если вам нужны хирургические или медицинские тесты, или если вы будете в постельном режиме, вам может потребоваться прекратить использование Yasmin в течение короткого времени. Любой врач или хирург, который лечит вас, должен знать, что вы используете противозачаточные таблетки.
Принимая противозачаточные таблетки, вам нужно регулярно посещать врача.
Храните Yasmin при комнатной температуре вдали от влаги и тепла.
См. Также: Информация дозирования (более подробно)
Следуйте инструкциям пациента, предоставленным вашим лекарством. Попросите вашего врача или фармацевта, если вы не понимаете эти инструкции. Отсутствие таблетки увеличивает риск забеременеть.
Если вы пропустите одну таблетку, возьмите две таблетки в тот день, который вы помните. Затем возьмите одну таблетку в день для остальной части пакета.
Если вы пропустите две активные таблетки подряд в первой или второй неделях, принимайте две таблетки в день в течение двух дней подряд. Затем возьмите одну таблетку в день для остальной части пакета. Используйте резервный контроль рождаемости в течение как минимум 7 дней после пропущенных таблеток.
Если вы пропустите две активные таблетки подряд в Неделе 3, выбросьте оставшуюся часть пакета и запустите новый пакет в тот же день, если вы начинаете день 1. Если вы — воскресный стартер, продолжайте принимать таблетки каждый день до воскресенья. В воскресенье выкиньте оставшуюся часть пакета и запустите новый пакет в тот день.
Если вы пропустите три активных таблетки подряд в 1-й, 2-й или 3-й строках, выбросьте оставшуюся часть пакета и запустите новый пакет в тот же день, если вы начинаете день 1. Если вы — воскресный стартер, продолжайте принимать таблетки каждый день до воскресенья. В воскресенье выкиньте оставшуюся часть пакета и запустите новый пакет в тот день.
Если вы пропустите две или более таблетки, у вас может не быть периода в течение месяца. Если вы пропустите период в течение двух месяцев подряд, позвоните своему врачу, потому что вы можете быть беременным.
Если вы пропустите пилюлю с напоминанием, выбросьте ее и продолжайте принимать одну таблетку напоминания в день, пока пакет не станет пустым. Если вы пропустите напоминание, вам не нужен резервный контроль рождаемости.
Читайте так же про препарат Буспирон.
Обратитесь за неотложной медицинской помощью или позвоните в справочную строку Poison по телефону 1-800-222-1222. Симптомы передозировки могут включать тошноту, рвоту и вагинальное кровотечение.
Не курите, принимая Ясмин, особенно если вы старше 35 лет.
Ясмин не защитит вас от болезней, передающихся половым путем, включая ВИЧ и СПИД. Использование презерватива — единственный способ защитить себя от этих заболеваний.
Читайте так же про препарат Антиверт.
Получите неотложную медицинскую помощь, если у вас есть признаки аллергической реакции на Ясмин : ульи; Затрудненное дыхание; Отек лица, губ, языка или горла.
Прекратите использовать Yasmin и сразу же обратитесь к врачу, если у вас есть:
-
Признаки инсульта — внезапное онемение или слабость (особенно на одной стороне тела), внезапная сильная головная боль, невнятная речь, проблемы со зрением или равновесием;
-
Признаки сгустка крови — боль в груди, внезапный кашель, хрипы, кашель крови, отек или тепло в одной или обеих ногах;
-
Симптомы сердечного приступа — боль в груди или давление, боль, распространяющаяся на вашу челюсть или плечо, тошноту, потливость;
-
Проблемы с печенью — сильная боль в желудке, лихорадка, чувство усталости, потеря аппетита, темная моча, стул из глинистого цвета, желтуха (пожелтение кожи или глаз);
-
Изменение характера или тяжести головных болей мигрени;
-
Отек в ваших руках, лодыжках или ногах;
-
Грудной комок; или
-
Симптомы депрессии — проблемы со сном, слабость, чувство усталости, изменения настроения.
Общие побочные эффекты Yasmin могут включать:
-
Тошнота, рвота;
-
болезненность молочных желез;
-
Головная боль, изменения настроения, чувство усталости или раздражительности;
-
увеличение веса; или
-
Изменения в менструальных периодах, снижение сексуального влечения.
Это не полный список побочных эффектов, и другие могут возникнуть. Спросите у своего доктора о побочных эффектах. Вы можете сообщить о побочных эффектах FDA на уровне 1-800-FDA-1088.
См. Также: Побочные эффекты (более подробно)
Многие препараты могут взаимодействовать с противозачаточными таблетками и сделать их менее эффективными, что может привести к беременности. Этинилэстрадиол может также влиять на уровень некоторых других лекарств, делая их менее эффективными или увеличивающимися побочными эффектами. Это включает в себя рецептурные и внебиржевые лекарства, витамины и растительные продукты.
- Ваш фармацевт может предоставить более подробную информацию о Yasmin.
Описание препарата Ярина® (таблетки, покрытые пленочной оболочкой, 3 мг+0.03 мг) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 22.09.2022
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Ярина®
- Заказ в аптеках Москвы
Фотографии упаковок

22.09.2022
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| активные вещества: | |
| этинилэстрадиол | 30 мкг |
| дроспиренон | 3 мг |
| вспомогательные вещества: лактозы моногидрат — 48,17 мг; крахмал кукурузный — 14,400 мг; крахмал кукурузный прежелатинизированный — 9,600 мг; повидон К25 — 4,000 мг; магния стеарат — 0,800 мг | |
| оболочка пленочная: гипромеллоза 5 сР — 1,0112 мг; макрогол 6000 — 0,2024 мг; тальк — 0,2024 мг; титана диоксид — 0,5565 мг; железа оксид желтый — 0,0275 мг |
Описание лекарственной формы
Таблетки покрытые пленочной оболочкой, круглые, двояковыпуклые, светло-желтого цвета, с одной стороны выгравирован шестиугольник, внутри которого буквы «DO».
Фармакологическое действие
Фармакологическое действие
—
контрацептивное.
Фармакодинамика
Препарат Ярина® — низкодозированный монофазный пероральный комбинированный эстроген-гестагенный контрацептивный препарат.
Контрацептивный эффект комбинированных пероральных контрацептивных препаратов (КОК) основан на взаимодействии различных факторов, наиболее важными из которых являются подавление овуляции, повышение вязкости секрета шейки матки и изменения в эндометрии.
При правильном применении препарата Ярина® индекс Перля (показатель, отражающий число беременностей у 100 женщин, применяющих контрацептив в течение года) составляет менее 1. При пропуске таблеток или неправильном применении индекс Перля может возрастать.
У женщин, принимающих КОК, менструальный цикл становится более регулярным, реже наблюдаются болезненные менструальноподобные кровотечения, уменьшается интенсивность и продолжительность кровотечения, в результате чего снижается риск железодефицитной анемии. Также имеются данные о снижении риска развития рака эндометрия и яичников при приеме КОК.
Дроспиренон, входящий в состав препарата Ярина®, обладает антиминералокортикоидной активностью и способен предупреждать увеличение массы тела и появление других симптомов (например, отеков), связанных с эстрогензависимой задержкой жидкости. Дроспиренон оказывает положительное воздействие на предменструальный синдром. В сочетании с этинилэстрадиолом дроспиренон демонстрирует благоприятный эффект на липидный профиль, характеризующийся повышением липопротеинов высокой плотности. Дроспиренон также обладает антиандрогенной активностью и способствует уменьшению угрей (акне), жирности кожи и волос (себореи). Эти особенности дроспиренона следует учитывать при выборе контрацептива женщинам с гормонозависимой задержкой жидкости, а также женщинам с акне и себореей.
Дроспиренон не обладает андрогенной, эстрогенной, глюкокортикоидной и антиглюкокортикоидной активностью. Все это в сочетании с антиминералокортикоидным и антиандрогенным действием обеспечивает дроспиренону биохимический и фармакологический профиль, сходный с естественным прогестероном.
Фармакокинетика
Дроспиренон
Абсорбция. При приеме внутрь дроспиренон быстро и почти полностью абсорбируется. После однократного приема внутрь максимальная концентрация (Cmax) дроспиренона в плазме крови, равная 38 нг/мл, достигается через 1–2 часа. Прием пищи не влияет на его биодоступность, которая колеблется в диапазоне от 76 до 85%.
Распределение. Дроспиренон связывается с альбумином плазмы крови и не связывается с глобулином, связывающим половые гормоны (ГСПГ) или кортикостероидсвязывающим глобулином (КСГ). Лишь 3–5% от общей концентрации вещества в сыворотке присутствует в качестве свободного гормона, 95–97% неспецифически связывается с альбумином. Индуцированное этинилэстрадиолом повышение ГСПГ не влияет на связывание дроспиренона белками плазмы крови. Средний кажущийся объем распределения (Vd) составляет (3,7±1,2) л/кг.
Метаболизм. После перорального приема дроспиренон интенсивно метаболизируется. Большинство метаболитов в плазме крови представлены кислотными формами дроспиренона. Дроспиренон также является субстратом для окислительного метаболизма, катализируемого изоферментом CYP3A4. Скорость клиренса дроспиренона из плазмы крови составляет (1,5±0,2) мл/мин/кг.
Выведение. Концентрация дроспиренона в плазме крови снижается двухфазно. Вторая, окончательная, фаза имеет период полувыведения (T1/2) около 31 часа. В неизмененном виде дроспиренон экскретируется в следовых количествах. Его метаболиты выводятся через желудочно-кишечный тракт (ЖКТ) и почки в соотношении примерно 1,2:1,4. T1/2 для экскреции метаболитов — около 40 часов.
Равновесная концентрация (Css). Концентрация ГСПГ не оказывает влияния на показатели фармакокинетики дроспиренона. При ежедневном применении препарата внутрь концентрация дроспиренона в плазме крови повышается в 2–3 раза, Css достигается через 8 дней приема препарата.
Нарушение функции почек. Исследования показали, что концентрация дроспиренона в плазме крови женщин с почечной недостаточностью легкой степени (клиренс креатинина (Cl креатинина) — 50–80 мл/мин) при достижении Css и у женщин с нормальной функцией почек (Cl креатинина — более 80 мл/мин) сопоставимы. Тем не менее у женщин с почечной недостаточностью средней степени тяжести (Cl креатинина — 30–50 мл/мин) средняя концентрация дроспиренона в плазме крови была на 37% выше, чем у пациенток с нормальной функцией почек. Не отмечено изменения концентрации калия в плазме крови при применении дроспиренона. Фармакокинетика дроспиренона не изучалась у пациенток с почечной недостаточностью тяжелой степени.
Нарушение функции печени. У женщин с печеночной недостаточностью средней степени тяжести (класс B по шкале Чайлд-Пью) площадь под кривой «концентрация — время» (AUC) сопоставима с соответствующим показателем у здоровых женщин с близкими значениями Cmax в фазе абсорбции и распределения. T1/2 дроспиренона у больных с печеночной недостаточностью средней степени тяжести оказался в 1,8 раза выше, чем у здоровых добровольцев с нормальной функцией печени. У больных с печеночной недостаточностью средней степени тяжести отмечено снижение клиренса дроспиренона приблизительно на 50% по сравнению с женщинами с нормальной функцией печени, при этом не отмечено различий в концентрации калия в плазме крови в изучаемых группах. При выявлении сахарного диабета и сопутствующем применении спиронолактона (оба состояния расцениваются как факторы, предрасполагающие к развитию гиперкалиемии) повышения концентрации калия в плазме крови не установлено. Переносимость дроспиренона у женщин с печеночной недостаточностью легкой и средней степени тяжести (класс B по шкале Чайлд-Пью) хорошая. Фармакокинетика дроспиренона не изучалась у пациенток с печеночной недостаточностью тяжелой степени.
Этническая принадлежность. Не установлено влияния этнической принадлежности (исследование проведено на когортах женщин европеоидной расы и японок) на параметры фармакокинетики дроспиренона и этинилэстрадиола.
Этинилэстрадиол
Абсорбция. После приема внутрь этинилэстрадиол быстро и полностью абсорбируется. Cmax — 100 пг/мл — достигается в течение 1–2 часов. Во время всасывания и первого прохождения через печень этинилэстрадиол метаболизируется, в результате чего его биодоступность при приеме внутрь составляет в среднем около 45% при высокой межиндивидуальной вариабельности — от 20 до 65%. Одновременный прием пищи в отдельных случаях сопровождается снижением биодоступности этинилэстрадиола на 25%.
Распределение. Этинилэстрадиол неспецифически, но прочно связывается с альбумином плазмы крови (около 98%) и индуцирует повышение концентрации в плазме крови ГСПГ. Предполагаемый Vd составляет 5 л/кг.
Метаболизм. Этинилэстрадиол подвергается значительному первичному метаболизму в кишечнике и печени. Этинилэстрадиол и его окислительные метаболиты первично конъюгированы с глюкуронидами или сульфатом.
Скорость метаболического клиренса этинилэстрадиола — около 5 мл/мин/кг.
Выведение. Уменьшение концентрации этинилэстрадиола в плазме крови носит двухфазный характер; первая фаза характеризуется T1/2 около 1 часа, вторая — 20 часов.
Этинилэстрадиол практически не выводится в неизмененном виде. Метаболиты этинилэстрадиола выводятся почками и через кишечник в соотношении 4:6. Период полувыведения метаболитов составляет примерно 24 ч.
Css. Равновесное состояние достигается во второй половине цикла приема препарата, когда концентрация этинилэстрадиола в плазме крови повышается на 40–110% по сравнению с применением разовой дозы.
Показания
Контрацепция.
Противопоказания
Препарат Ярина® противопоказан при наличии какого-либо из состояний/заболеваний/факторов риска, перечисленных ниже. Если какие-либо из этих состояний/заболеваний/факторов риска развиваются впервые на фоне приема, препарат должен быть немедленно отменен.
- тромбоз (венозный и артериальный) и тромбоэмболия в настоящее время или в анамнезе (в т.ч. тромбоз глубоких вен (ТГВ), тромбоэмболия легочной артерии (ТЭЛА), инфаркт миокарда, инсульт), цереброваскулярные нарушения — в настоящее время или в анамнезе;
- состояния, предшествующие тромбозу (в т.ч. транзиторные ишемические атаки, стенокардия) в настоящее время или в анамнезе;
- выявленная приобретенная или наследственная предрасположенность к венозному или артериальному тромбозу, включая резистентность к активированному протеину С, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, гипергомоцистеинемия, антитела к фосфолипидам (антитела к кардиолипину, волчаночный антикоагулянт);
- наличие высокого риска венозного или артериального тромбоза (см. «Особые указания»);
- мигрень с очаговыми неврологическими симптомами в настоящее время или в анамнезе;
- сахарный диабет с сосудистыми осложнениями;
- панкреатит с выраженной гипертриглицеридемией в настоящее время или в анамнезе;
- печеночная недостаточность и тяжелые хронические заболевания печени (до нормализации печеночных проб);
- совместное применение с противовирусными препаратами прямого действия (ПППД), содержащими омбитасвир, паритапревир, дасабувир или комбинацию этих веществ (см. «Взаимодействие»);
- опухоли печени (доброкачественные или злокачественные) в настоящее время или в анамнезе;
- тяжелая и/или острая почечная недостаточность;
- выявленные гормонозависимые злокачественные новообразования (в т.ч. половых органов или молочных желез) или подозрение на них;
- кровотечение из влагалища неясного генеза;
- беременность или подозрение на нее;
- период грудного вскармливания;
- повышенная чувствительность к любому из компонентов препарата Ярина®;
- непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (в состав препарата входит лактозы моногидрат).
С осторожностью
Следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения КОК в каждом индивидуальном случае при наличии следующих заболеваний/состояний и факторов риска:
- факторы риска развития тромбоза и тромбоэмболий — курение, ожирение, дислипопротеинемия, контролируемая артериальная гипертензия, мигрень без очаговой неврологической симптоматики, неосложненные пороки клапанов сердца, наследственная предрасположенность к тромбозу (тромбозы, инфаркт миокарда или нарушение мозгового кровообращения в возрасте менее 50 лет у кого-либо из ближайших родственников);
- другие заболевания, при которых могут отмечаться нарушения периферического кровообращения — сахарный диабет, системная красная волчанка (СКВ), гемолитико-уремический синдром, болезнь Крона и язвенный колит, серповидно-клеточная анемия (СКА), флебит поверхностных вен;
- наследственный ангионевротический отек;
- гипертриглицеридемия;
- заболевания печени легкой и средней степени тяжести в анамнезе при нормальных показателях функциональных проб печени;
- заболевания, впервые возникшие или усугубившиеся во время беременности или на фоне предыдущего приема половых гормонов (например, желтуха и/или зуд, связанные с холестазом, холелитиаз, отосклероз с ухудшением слуха, порфирия, герпес во время беременности, хорея Сиденгама);
- послеродовый период.
Применение при беременности и кормлении грудью
Препарат Ярина® противопоказан во время беременности и в период грудного вскармливания.
Если беременность выявляется во время приема препарата Ярина®, прием препарата должен быть немедленно прекращен. Обширные эпидемиологические исследования не выявили повышенного риска дефектов развития у детей, рожденных женщинами, получавшими половые гормоны до беременности или тератогенного действия в случаях приема половых гормонов по неосторожности в ранние сроки беременности. В то же время имеющиеся данные о применении препарата Ярина® во время беременности ограничены, что не позволяет сделать какие-либо выводы о негативном влиянии препарата на беременность, здоровье плода и новорожденного ребенка. В настоящее время какие-либо значимые эпидемиологические данные отсутствуют.
Прием препарата может уменьшать количество грудного молока и изменять его состав, поэтому применение препарата противопоказано до прекращения грудного вскармливания. Небольшое количество половых гормонов и/или их метаболитов может проникать в грудное молоко и оказывать влияние на здоровье ребенка.
Способ применения и дозы
Реклама: ООО «РЛС-Библиомед», ИНН 7714758963, erid=4CQwVszH9pUmKjt23pm
Как и когда принимать таблетки препарата Ярина®
Внутрь. Календарная упаковка препарата Ярина® содержит 21 таблетку. Каждая таблетка в упаковке маркируется днем недели, в который она должна быть принята. Таблетки следует принимать внутрь каждый день в течение 21 дня по порядку, указанному на упаковке, примерно в одно и то же время, запивая небольшим количеством воды. Прием таблеток из следующей упаковки начинается после 7-дневного перерыва, во время которого обычно развивается менструальноподобное кровотечение (кровотечение «отмены»). Как правило, оно начинается на 2–3-й день после приема последней таблетки и может не закончиться до начала приема таблеток из новой упаковки. После 7-дневного перерыва начинать прием таблеток из новой упаковки необходимо даже в случае, если менструальноподобное кровотечение еще не прекратилось. Это означает, что начинать прием таблеток из новой упаковки необходимо в один и тот же день недели, и что каждый месяц кровотечение «отмены» будет наступать примерно в один и тот же день недели.
Прием таблеток из первой упаковки препарата Ярина®
Когда никакое гормональное противозачаточное средство не применялось в предыдущем месяце. Прием препарата Ярина® следует начинать в первый день менструального цикла (т.е. в первый день менструального кровотечения). Необходимо принять таблетку, которая промаркирована соответствующим днем недели. Затем следует принимать таблетки по порядку. Допускается начинать прием препарата на 2–5-й день менструального цикла, но в этом случае в течение первых 7 дней приема таблеток из первой упаковки рекомендуется дополнительно использовать барьерный метод контрацепции.
При переходе с других КОК, вагинального кольца или контрацептивного пластыря. Предпочтительно начинать прием препарата Ярина® на следующий день после приема последней активной таблетки из предыдущей упаковки, но ни в коем случае не позднее следующего дня после обычного 7-дневного перерыва (для препаратов, содержащих 21 таблетку) или после приема последней неактивной таблетки (для препаратов, содержащих 28 таблеток в упаковке). Начинать прием препарата Ярина® следует после обычного перерыва в приеме активных таблеток в случае перехода с контрацептивных препаратов с пролонгированным режимом применения. Прием препарата Ярина® следует начинать в день удаления вагинального кольца или пластыря, но не позднее дня, когда должно быть введено новое кольцо или наклеен новый пластырь.
При переходе с контрацептивов, содержащих только гестагены (мини-пили, инъекционные формы, имплантат), или с внутриматочной терапевтической системы с высвобождением гестагена. Можно перейти с мини-пили на препарат Ярина® в любой день (без перерыва), с имплантата или внутриматочной спирали с гестагеном — в день их удаления, с инъекционного контрацептива — в день, когда должна быть сделана следующая инъекция. Во всех случаях необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток (например, презерватив).
После аборта (в т.ч. самопроизвольного) в I триместре беременности. Можно начать прием препарата немедленно. При соблюдении этого условия дополнительных мер контрацепции не требуется.
После родов (при отсутствии грудного вскармливания) или прерывания беременности (в т.ч. самопроизвольного) во II триместре беременности. Прием препарата рекомендуется начать на 21–28-й день после родов (при отсутствии грудного вскармливания) или прерывания беременности во II триместре. Если прием препарата начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток. Если половой контакт имел место до начала приема препарата Ярина®, необходимо исключить беременность.
Прием пропущенных таблеток
Если опоздание в приеме препарата составило менее 12 часов, контрацептивная защита не снижается. Нужно принять пропущенную таблетку как можно скорее, следующая таблетка принимается в обычное время.
Если опоздание в приеме таблеток составило более 12 часов, контрацептивная защита снижается. Чем больше таблеток пропущено, и чем ближе пропуск к 7-дневному перерыву в приеме таблеток, тем выше вероятность наступления беременности.
При этом необходимо помнить:
— прием препарата никогда не должен быть прерван более чем на 7 дней;
— 7 дней непрерывного приема таблеток требуется для достижения адекватного подавления гипоталамо-гипофизарно-яичниковой системы.
Соответственно, если опоздание в приеме таблеток превышает 12 ч (интервал с момента приема последней таблетки более 36 ч), в зависимости от недели, когда пропущена таблетка, необходимо следующее:
1-я неделя приема препарата. Необходимо принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если это означает прием двух таблеток одновременно). Следующие таблетки следует принимать в обычное время. Кроме того, в течение последующих 7 дней необходимо дополнительно использовать барьерный метод контрацепции (например, презерватив). Если половой контакт имел место в течение 7 дней перед пропуском таблетки, следует учесть возможность наступления беременности.
2-я неделя приема препарата. Необходимо принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если это означает прием двух таблеток одновременно). Следующие таблетки следует принимать в обычное время. При условии соблюдения режима приема таблеток в течение 7 дней, предшествующих первой пропущенной таблетке, нет необходимости в использовании дополнительных мер контрацепции. В противном случае, а также при пропуске двух и более таблеток необходимо дополнительно использовать барьерные методы контрацепции в течение последующих 7 дней.
3-я неделя приема препарата. Риск снижения контрацептивной надежности неизбежен из-за предстоящего перерыва в приеме таблеток. В этом случае необходимо придерживаться следующих алгоритмов:
— если в течение 7 дней, предшествующих первой пропущенной таблетке, все таблетки принимались правильно, нет необходимости использовать дополнительные контрацептивные методы. При приеме пропущенных таблеток следует руководствоваться пунктами 1 или 2.
— если в течение 7 дней, предшествующих первой пропущенной таблетке, все таблетки принимались неправильно, то в течение последующих 7 дней необходимо дополнительно использовать барьерный метод контрацепции (например, презерватив), и в этом случае следует руководствоваться пунктом 1 для приема пропущенных таблеток.
1. Необходимо принять пропущенную таблетку как можно скорее, как только вспомните об этом (даже если это означает прием двух таблеток одновременно). Следующие таблетки принимают в обычное время, пока не закончатся таблетки из текущей упаковки. Прием таблеток из следующей упаковки следует начать сразу же без обычного 7-дневного перерыва. Кровотечение «отмены» маловероятно, пока не закончатся таблетки из второй упаковки, но могут отмечаться «мажущие» выделения и/или «прорывные» кровотечения в дни приема препарата.
2. Можно также прервать прием таблеток из текущей упаковки, сделать перерыв на 7 или менее дней (включая дни пропуска таблеток), после чего начинать прием таблеток из новой упаковки. Если женщина пропустила прием таблеток, а во время перерыва в приеме у нее нет кровотечения «отмены», необходимо исключить беременность.
Схема действий при нарушении режима приема таблеток указана ниже.
Допускается принимать не более двух таблеток в один день.
Рекомендации при желудочно-кишечных расстройствах
При тяжелых желудочно-кишечных расстройствах всасывание может быть неполным, поэтому следует принять дополнительные контрацептивные меры.
Если в течение 3–4 ч после приема таблеток отмечается рвота или диарея, в зависимости от недели приема препарата следует ориентироваться на рекомендации при пропуске таблеток, указанные выше. Если женщина не хочет менять свою обычную схему приема и переносить начало менструации на другой день недели, дополнительную таблетку следует принять из другой упаковки.
Прекращение приема препарата Ярина®
Прием препарата Ярина® можно прекратить в любое время. Если женщина не планирует беременность, следует позаботиться о других методах контрацепции. Если планируется беременность, следует просто прекратить прием препарата Ярина® и подождать естественного менструального кровотечения.
Отсрочка начала менструальноподобного кровотечения
Для того чтобы отсрочить начало менструальноподобного кровотечения, необходимо продолжить дальнейший прием таблеток из новой упаковки препарата Ярина® без 7-дневного перерыва. Таблетки из новой упаковки могут приниматься так долго, как это необходимо, в том числе до тех пор, пока таблетки в упаковке не закончатся. На фоне приема препарата из второй упаковки могут отмечаться «мажущие» кровянистые выделения из влагалища и/или «прорывные» маточные кровотечения. Возобновить прием препарата Ярина® из очередной упаковки следует после обычного 7-дневного перерыва.
Изменение дня начала менструальноподобного кровотечения
Для того чтобы перенести день начала менструальноподобного кровотечения на другой день недели, женщине следует сократить (но не удлинять) ближайший 7-дневный перерыв в приеме таблеток на столько дней, на сколько женщина хочет. Например, если цикл обычно начинается в пятницу, а в будущем женщина хочет, чтобы он начинался во вторник (3 днями ранее), прием таблеток из следующей упаковки необходимо начать на 3 дня раньше, чем обычно. Чем короче перерыв в приеме таблеток, тем выше вероятность, что менструальноподобное кровотечение не наступит, и во время приема таблеток из второй упаковки будут наблюдаться «мажущие» выделения и/или «прорывные» кровотечения.
Применение у отдельных групп пациенток
Девочки-подростки. Препарат Ярина® показан только после наступления менархе. Имеющиеся данные не предполагают коррекции дозы у данной группы пациенток.
Пожилые пациентки. Не применимо. Препарат Ярина® не показан после наступления менопаузы.
Нарушения функции печени. Препарат Ярина® противопоказан к применению у женщин с тяжелыми заболеваниями печени до тех пор, пока показатели функции печени не придут в норму (см. «Противопоказания» и «Фармакокинетика»).
Нарушения функции почек. Препарат Ярина® противопоказан к применению у женщин с тяжелой почечной недостаточностью и при острой почечной недостаточности (см. «Противопоказания» и «Фармакокинетика»).
Побочные действия
Серьезные нежелательные явления при приеме КОК описаны также в разделе «Особые указания».
При приеме препарата Ярина® отмечались описанные ниже побочные реакции, классифицированные по системно-органным классам (MedDRA) со следующей частотой: часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100); редко (от ≥1/10 000 до <1/1000).
| Системно-органные классы (MedDRA) | Часто | Нечасто | Редко |
| Нарушения со стороны иммунной системы | − | − | Реакция гиперчувствительности, бронхиальная астма |
| Нарушения психики | Подавленное настроение | Повышение либидо, снижение либидо | − |
| Нарушения со стороны нервной системы | Головная боль | − | − |
| Нарушения со стороны органа слуха и лабиринтные нарушения | − | − | Гипоакузия |
| Нарушения со стороны сосудов | Мигрень | Повышение АД, снижение АД | Венозная тромбоэмболия (ВТЭ), артериальная тромбоэмболия (АТЭ) |
| Нарушения со стороны ЖКТ | Тошнота | Рвота, диарея | − |
| Нарушения со стороны кожи и подкожных тканей | − | Акне, экзема, зуд, алопеция | Узловатая эритема, многоформная эритема |
| Нарушения со стороны половых органов и молочной железы | Нарушения менструального цикла, межменструальные кровотечения, боль в молочных железах, нагрубание молочных желез, выделения из влагалища, кандидозный вульвовагинит | Увеличение молочных желез, вагинальная инфекция | Выделения из молочных желез |
| Общие расстройства | − | Задержка жидкости, увеличение массы тела, снижение массы тела | − |
Описание отдельных побочных реакций
У пациенток, принимающих КОК, имеется повышенный риск развития артериальных и венозных тромботических и тромбоэмболических нарушений, включая инфаркт миокарда, инсульт, транзиторные ишемические атаки, ТГВ и ТЭЛА, более подробно описанные в разделе «Особые указания».
Сообщалось о следующих серьезных побочных реакциях у женщин, применяющих КОК. Данные побочные реакции описаны в разделе «Особые указания»:
— венозные тромбоэмболические нарушения;
— артериальные тромбоэмболические нарушения;
— повышение АД;
— опухоли печени;
— развитие или ухудшение состояний, для которых связь с применением КОК не является неоспоримой: болезнь Крона, язвенный колит, эпилепсия, миома матки, порфирия, СКВ, герпес во время беременности, хорея Сиденгама, гемолитико-уремический синдром, холестатическая желтуха;
— хлоазма;
— острые или хронические нарушения функции печени, при которых может потребоваться отмена КОК до нормализации функциональных проб печени;
— у женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызвать или усилить симптомы ангионевротического отека.
Частота диагностирования рака молочной железы у женщин, применяющих пероральные контрацептивные препараты, повышена весьма незначительно. Рак молочной железы редко наблюдается у женщин до 40 лет, превышение частоты незначительно по отношению к общему риску возникновения рака молочной железы. Причинная связь возникновения рака молочной железы с применением КОК не установлена. Дополнительная информация — см. «Противопоказания» и «Особые указания».
Взаимодействие
Взаимодействия других препаратов (индукторы ферментов) с пероральными контрацептивами могут приводить к прорывным кровотечениям и/или снижению контрацептивного эффекта (см. «Взаимодействие»).
Взаимодействие
Влияние других лекарственных препаратов на препарат Ярина®
Возможно взаимодействие с лекарственными препаратами, индуцирующими микросомальные ферменты печени, в результате чего может увеличиваться клиренс половых гормонов, что, в свою очередь, может приводить к «прорывным» маточным кровотечениям и/или снижению контрацептивного эффекта.
Индукция микросомальных ферментов печени может наблюдаться уже через несколько дней лечения. Максимальная индукция микросомальных ферментов печени обычно наблюдается в течение нескольких недель. После отмены препарата индукция микросомальных ферментов печени может сохраняться в течение 4 недель.
Краткосрочная терапия. Женщинам, которые получают лечение такими препаратами в дополнение к препарату Ярина®, рекомендуется временно использовать барьерный метод контрацепции или выбрать иной негормональный метод контрацепции. Барьерный метод контрацепции следует использовать в течение всего периода приема сопутствующих препаратов, а также в течение 28 дней после их отмены. В случае необходимости продолжения терапии препаратом-индуктором после того как закончен прием таблеток из текущей упаковки препарата Ярина®, следует начинать прием таблеток из новой упаковки препарата Ярина® без обычного перерыва в приеме.
Долгосрочная терапия. Женщинам, длительно принимающим препараты — индукторы микросомальных ферментов печени, рекомендуется использовать другой надежный негормональный метод контрацепции.
Вещества, увеличивающие клиренс препарата Ярина® (ослабляющие эффективность путем индукции ферментов). Фенитоин, барбитураты, примидон, карбамазепин, рифампицин и, возможно, также окскарбазепин, топирамат, фелбамат, гризеофульвин, а также препараты, содержащие зверобой продырявленный.
Вещества с различным влиянием на клиренс препарата Ярина®. При совместном применении с препаратом Ярина® многие ингибиторы протеаз ВИЧ или вируса гепатита С и ненуклиозидные ингибиторы обратной транскриптазы могут как увеличивать, так и уменьшать концентрацию эстрогена или прогестина в плазме крови. В некоторых случаях такое влияние может быть клинически значимо.
Вещества, снижающие клиренс КОК (ингибиторы ферментов). Сильные и умеренные ингибиторы CYP3A4, такие как азольные антимикотики (в т.ч. итраконазол, вориконазол, флуконазол), верапамил, макролиды (в т.ч. кларитромицин, эритромицин), дилтиазем и грейпфрутовый сок, могут повышать плазменные концентрации эстрогена или прогестина или их обоих. Было показано, что эторикоксиб в дозах 60 и 120 мг/сутки при совместном приеме с КОК, содержащими 0,035 мг этинилэстрадиола, повышает концентрации этинилэстрадиола в плазме крови в 1,4 и 1,6 раза соответственно.
Влияние препарата Ярина® на другие лекарственные препараты
КОК могут влиять на метаболизм других препаратов, что приводит к повышению (в т.ч. циклоспорин) или снижению (в т.ч. ламотриджин) их концентрации в плазме крови и тканях.
In vitro дроспиренон способен слабо или умеренно ингибировать ферменты CYP1A1, CYP2C9, CYP2C19 и CYP3A4.
На основании исследований взаимодействия in vivo у женщин-добровольцев, принимавших омепразол, симвастатин или мидазолам в качестве маркерных субстратов, можно заключить, что клинически значимое влияние 3 мг дроспиренона на метаболизм лекарственных препаратов, опосредованный ферментами цитохрома P450, маловероятно.
In vitro этинилэстрадиол является обратимым ингибитором CYP2C19, CYP1A1 и CYP1A2, а также необратимым ингибитором CYP3A4/5, CYP2C8 и CYP2J2. В клинических исследованиях назначение гормонального контрацептива, содержащего этинилэстрадиол, не приводило к какому-либо повышению или приводило лишь к слабому повышению концентраций субстратов CYP3A4 в плазме крови (в т.ч. мидазолам), в то время как плазменные концентрации субстратов CYP1A2 могут возрастать слабо (в т.ч. теофиллин) или умеренно (в т.ч. мелатонин и тизанидин).
Фармакодинамические взаимодействия
Было показано, что совместное применение этинилэстрадиолсодержащих препаратов и ПППД, содержащих омбитасвир, паритапревир, дасабувир или их комбинацию, ассоциируется с повышением концентрации аланинаминотрансферазы (АЛТ) более чем в 20 раз по сравнению с верхней границей нормы у здоровых и инфицированных вирусом гепатита C женщин (см. «Противопоказания»).
Другие формы взаимодействия
У пациенток с ненарушенной функцией почек сочетанное применение дроспиренона и ингибиторов ангиотензинпревращающего фермента (АПФ) или нестероидных противовоспалительных препаратов не оказывает значимого эффекта на концентрацию калия в плазме крови. Тем не менее сочетанное применение препарата Ярина® с антагонистами альдостерона или калийсберегающими диуретиками не изучено. При совместном приеме с данными препаратами концентрацию калия в плазме крови необходимо контролировать в течение первого цикла приема (см. «Особые указания»).
Передозировка
О серьезных нарушениях при передозировке не сообщалось.
На основании суммарного опыта применения КОК симптомы, которые могут отмечаться при передозировке: тошнота, рвота и кровотечение «отмены». Последнее может возникать у девочек, не достигших возраста менархе, при приеме препарата по неосторожности.
Специфического антидота нет, следует проводить симптоматическое лечение.
Особые указания
Если какие-либо из состояний, заболеваний и факторов риска, указанных ниже, имеются в настоящее время, то следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения препарата Ярина® в каждом индивидуальном случае и обсудить его с женщиной до того, как она решит начинать прием препарата. В случае утяжеления, усиления или первого проявления любого из этих состояний, заболеваний или факторов риска, женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости отмены препарата.
Заболевания сердечно-сосудистой системы. Результаты эпидемиологических исследований указывают на наличие взаимосвязи между применением КОК и повышением частоты развития венозных и артериальных тромбозов и тромбоэмболий (таких как тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда, цереброваскулярные нарушения) при приёме КОК. Данные заболевания отмечаются редко. Риск развития ВТЭ максимален в первый год приема КОК. Повышенный риск присутствует после первоначального применения КОК или возобновления применения одного и того же или другого КОК (после перерыва между приемами препарата в 4 недели и более). Данные крупномасштабного проспективного исследования с участием 3 групп пациенток показывают, что этот повышенный риск присутствует преимущественно в течение первых 3 месяцев.
Общий риск развития ВТЭ у женщин, принимающих низкодозированные КОК (<0,05 мг этинилэстрадиола), в 2–3 раза выше, чем у небеременных пациенток, которые не принимают КОК, тем не менее этот риск остается более низким по сравнению с риском ВТЭ при беременности и родах.
ВТЭ может оказаться жизнеугрожающей или привести к летальному исходу (в 1–2% случаев).
ВТЭ, проявляющаяся в виде ТГВ или ТЭЛА, может развиться при применении любых КОК.
Крайне редко при применении КОК возникает тромбоз других кровеносных сосудов, например печеночных, брыжеечных, почечных, мозговых вен и артерий или сосудов сетчатки глаза.
Симптомы тромбоза глубоких вен (ТГВ): односторонний отек нижней конечности или вдоль вены на нижней конечности, боль или дискомфорт в нижней конечности только в вертикальном положении или при ходьбе, локальное повышение температуры в пораженной нижней конечности, покраснение или изменение окраски кожных покровов нижней конечности.
Симптомы тромбоэмболии легочной артерии (ТЭЛА): затрудненное или учащенное дыхание; внезапный кашель, в т.ч. с кровохарканием; острая боль в грудной клетке, которая может усиливаться при глубоком вдохе; чувство тревоги; сильное головокружение; учащенное или нерегулярное сердцебиение. Некоторые из этих симптомов (например, одышка, кашель) являются неспецифическими и могут быть истолкованы неверно как признаки других более часто встречающихся и менее тяжелых состояний/заболеваний (например, инфекция дыхательных путей).
Артериальная тромбоэмболия может привести к инсульту, окклюзии сосудов или инфаркту миокарда.
Симптомы инсульта: внезапная слабость или потеря чувствительности лица, конечностей, особенно с одной стороны тела, внезапная спутанность сознания, проблемы с речью и пониманием; внезапная одно- или двухсторонняя потеря зрения; внезапное нарушение походки, головокружение, потеря равновесия или координации движений; внезапная, тяжелая или продолжительная головная боль без видимой причины; потеря сознания или обморок с приступом судорог или без него.
Другие признаки окклюзии сосудов: внезапная боль, отечность и незначительная синюшность конечностей, «острый» живот.
Симптомы инфаркта миокарда: боль, дискомфорт, давление, тяжесть, чувство сжатия или распирания в груди или за грудиной, с иррадиацией в спину, челюсть, левую верхнюю конечность, область эпигастрия; холодный пот, тошнота, рвота или головокружение, сильная слабость, тревога или одышка; учащенное или нерегулярное сердцебиение.
Артериальная тромбоэмболия может оказаться жизнеугрожающей или привести к летальному исходу.
У женщин с сочетанием нескольких факторов риска или высокой выраженностью одного из них следует рассматривать возможность их взаимоусиления. В подобных случаях суммарное значение имеющихся факторов риска повышается. В этом случае прием препарата Ярина® противопоказан (см. «Противопоказания»).
Риск развития тромбоза (венозного и/или артериального), тромбоэмболии или цереброваскулярных нарушений повышается:
— с возрастом;
— у курящих (с увеличением количества выкуриваемых сигарет или повышением возраста риск нарастает, особенно у женщин старше 35 лет);
при наличии:
— ожирения (индекс массы тела (ИМТ) >30 кг/м2);
— семейного анамнеза (например, ВТЭ или АТЭ когда-либо у близких родственников или родителей в возрасте менее 50 лет). В случае наследственной или приобретенной предрасположенности женщина должна быть осмотрена соответствующим специалистом для решения вопроса о возможности приема препарата Ярина®;
— длительной иммобилизации, серьезного хирургического вмешательства, любой операции на нижних конечностях или обширной травмы. В данных ситуациях прием препарата Ярина® следует прекратить (в случае планируемой операции по крайней мере за 4 недели до нее) и не возобновлять прием в течение 2 недель после окончания иммобилизации. Временная иммобилизация (например, авиаперелет длительностью более 4 ч) может также являться фактором риска развития ВТЭ, особенно при наличии других факторов риска — дислипопротеинемии, артериальной гипертензии, мигрени, заболеваний клапанов сердца, фибрилляции предсердий.
Применение любых комбинированных гормональных контрацептивов повышает риск развития ВТЭ. Применение препаратов, содержащих левоноргестрел, норгестимат или норэтистерон, вызывает наименьший риск развития ВТЭ. Применение других препаратов, таких как Ярина®, может привести к двукратному увеличению риска. Выбор в пользу применения КОК с более высоким риском развития ВТЭ может быть сделан только после консультации пациентки, позволяющей убедиться, что она полностью понимает риск развития ВТЭ, связанный с применением препарата Ярина®, влияние препарата на существующие у нее факторы риска и то, что риск развития ВТЭ максимален в течение первого года применения препарата. Вопрос о возможной роли варикозного расширения вен и поверхностного тромбофлебита в развитии ВТЭ остается спорным.
Следует учитывать повышенный риск развития тромбоэмболий в послеродовом периоде.
Нарушения периферического кровообращения также могут отмечаться при сахарном диабете, СКВ, гемолитико-уремическом синдроме, хронических воспалительных заболеваниях кишечника (болезнь Крона или язвенный колит) и серповидно-клеточной анемии (СКА).
Увеличение частоты и тяжести мигрени во время применения препарата Ярина® (что может предшествовать цереброваскулярным нарушениям) является основанием для немедленного прекращения приема этого препарата.
К биохимическим показателям, указывающим на наследственную или приобретенную предрасположенность к венозному или артериальному тромбозу относят резистентность к активированному протеину С, гипергомоцистеинемию, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, антитела к фосфолипидам (антитела к кардиолипину, волчаночный антикоагулянт).
При оценке соотношения риска и пользы следует учитывать, что адекватное лечение соответствующего состояния может уменьшить связанный с ним риск развития тромбоза. Также следует учитывать, что риск развития тромбозов и тромбоэмболий при беременности выше, чем при приеме низкодозированных пероральных контрацептивных препаратов (<0,05 мг этинилэстрадиола).
Опухоли
Наиболее существенным фактором риска развития рака шейки матки является персистирующая папилломавирусная инфекция. Имеются сообщения о некотором повышении риска развития рака шейки матки при длительном применении КОК. Однако связь с приемом КОК не доказана. Обсуждается возможность взаимосвязи этих данных со скринингом заболеваний шейки матки и с особенностями полового поведения (более редкое применение барьерных методов контрацепции).
Метаанализ 54 эпидемиологических исследований показал, что имеется несколько повышенный относительный риск развития рака молочной железы, диагностированного у женщин, принимающих КОК в настоящее время (относительный риск 1,24). Повышенный риск постепенно исчезает в течение 10 лет после прекращения приема этих препаратов. В связи с тем, что рак молочной железы отмечается редко у женщин до 40 лет, увеличение числа диагнозов рака молочной железы у женщин, принимающих КОК в настоящее время или принимавших их недавно, является незначительным по отношению к общему риску этого заболевания. Его связь с приемом КОК не доказана. Наблюдаемое повышение риска может быть следствием тщательного наблюдения и более ранней диагностики рака молочной железы у женщин, применяющих КОК, биологическим действием половых гормонов или сочетанием обоих факторов. У женщин, когда-либо применявших КОК, выявляются более ранние стадии рака молочной железы, чем у женщин, никогда их не применявших.
В редких случаях на фоне применения КОК наблюдалось развитие доброкачественных, а в крайне редких случаях — злокачественных новообразований печени, которые в отдельных случаях приводили к угрожающему жизни внутрибрюшному кровотечению. При появлении сильных болей в области живота, увеличении печени или признаках внутрибрюшного кровотечения это следует учитывать при проведении дифференциального диагноза.
Злокачественные опухоли могут оказаться жизнеугрожающими или привести к летальному исходу.
Другие состояния
Прогестиновый компонент в препарате Ярина® является антагонистом альдостерона, обладающим калийсберегающими свойствами. В большинстве случаев не должно наблюдаться повышения концентрации калия в плазме крови. В клинических исследованиях у некоторых пациенток с почечной недостаточностью легкой или средней степени тяжести и сопутствующем приеме калийсберегающих препаратов концентрация калия в плазме крови незначительно повышалась во время приема дроспиренона. Поэтому концентрацию калия в плазме крови необходимо контролировать в течение первого цикла приема препарата у пациенток с почечной недостаточностью и при изначальной концентрации калия на верхней границе нормы, особенно при сопутствующем приеме калийсберегающих препаратов (см. «Взаимодействие»).
У женщин с гипертриглицеридемией (или наличии этого состояния в семейном анамнезе) возможно повышение риска развития панкреатита во время приема КОК.
Несмотря на то что небольшое повышение АД было описано у многих женщин, принимающих КОК, клинически значимые повышения отмечались редко. Тем не менее если во время приема препарата Ярина® развивается стойкое, клинически значимое повышение АД, следует отменить этот препарат и начать лечение артериальной гипертензии. Прием препарата может быть продолжен, если с помощью гипотензивной терапии достигнуты нормальные значения АД.
Следующие состояния, как сообщалось, развиваются или ухудшаются как во время беременности, так и при приеме КОК, но их связь с приемом КОК не доказана: желтуха и/или зуд, связанные с холестазом, формирование камней в желчном пузыре, порфирия; СКВ, гемолитико-уремический синдром, хорея Сиденгама, герпес во время беременности, потеря слуха, связанная с отосклерозом. Также описаны случаи ухудшения течения эндогенной депрессии, эпилепсии, болезни Крона и язвенного колита на фоне применения КОК.
У женщин с наследственными формами ангионевротического отека экзогенные эстрогены могут вызывать или ухудшать симптомы ангионевротического отека.
Острые или хронические нарушения функции печени могут потребовать отмены препарата до тех пор, пока показатели функции печени не вернутся в норму. Рецидив холестатической желтухи, развившейся впервые во время предшествующей беременности или предыдущего приема половых гормонов, требует прекращения приема препарата.
Хотя КОК могут оказывать влияние на инсулинорезистентность и толерантность к глюкозе, необходимости в коррекции дозы гипогликемических препаратов у пациенток с сахарным диабетом, применяющих низкодозированные КОК (<0,05 мг этинилэстрадиола), как правило, не возникает. Тем не менее женщины с сахарным диабетом должны тщательно наблюдаться во время приема КОК.
Иногда может развиться хлоазма, особенно у женщин с наличием в анамнезе хлоазмы беременных. Женщины со склонностью к хлоазме во время приема препарата Ярина® должны избегать длительного пребывания на солнце и воздействия ультрафиолетового излучения.
Лабораторные тесты
Прием препарата Ярина® может влиять на результаты некоторых лабораторных тестов, включая показатели функции печени, почек, щитовидной железы, надпочечников, концентрацию транспортных белков в плазме, показатели углеводного обмена, параметры свертывания крови и фибринолиза. Изменения обычно не выходят за границы нормальных значений. Дроспиренон увеличивает активность ренина плазмы и концентрацию альдостерона, что связано с его антиминералокортикоидным эффектом.
Снижение эффективности
Контрацептивная эффективность препарата Ярина® может быть снижена в следующих случаях: при пропуске таблеток, желудочно-кишечных расстройствах или в результате лекарственного взаимодействия.
Частота и выраженность менструальноподобных кровотечений
На фоне приема препарата Ярина® могут наблюдаться нерегулярные (ациклические) кровотечения из влагалища («мажущие» кровянистые выделения и/или «прорывные» маточные кровотечения), особенно в течение первых месяцев применения. Поэтому оценка любых нерегулярных менструальноподобных кровотечений должна проводиться после периода адаптации, составляющего около 3 циклов приема препарата. Если нерегулярные менструальноподобные кровотечения повторяются или развиваются после предшествующих регулярных циклов, следует провести тщательное обследование для исключения злокачественных новообразований или беременности.
У некоторых женщин во время перерыва в приеме таблеток может не развиться кровотечение «отмены». Если препарат Ярина® принимался согласно рекомендациям, маловероятно, что женщина беременна. Тем не менее при нерегулярном применении препарата и отсутствии двух подряд менструальноподобных кровотечений, прием препарата не может быть продолжен до исключения беременности.
Медицинские осмотры
Перед началом или возобновлением применения препарата Ярина® необходимо ознакомиться с анамнезом жизни, семейным анамнезом женщины, провести тщательное
общемедицинское и гинекологическое обследование, исключить беременность. Объем исследований и частота контрольных осмотров должны основываться на существующих нормах медицинской практики при необходимом учете индивидуальных особенностей каждой пациентки. Как правило, измеряется АД, частота сердечных сокращений, определяется ИМТ, проверяется состояние молочных желез, брюшной полости и органов малого таза, включая цитологическое исследование эпителия шейки матки (тест по Папаниколау). Обычно контрольные обследования следует проводить не реже 1 раза в 6 месяцев.
Необходимо иметь в виду, что препарат Ярина® не предохраняет от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем.
Состояния, требующие консультации врача:
— какие-либо изменения в здоровье, особенно возникновение состояний, перечисленных в разделах «Противопоказания» и С осторожностью;
— локальное уплотнение в молочной железе;
— одновременный прием других лекарственных препаратов (см. «Взаимодействие»);
— если ожидается длительная неподвижность (например, на нижнюю конечность наложен гипс), планируется госпитализация или операция (по крайней мере за 4 недели до предполагаемой операции);
— необычно сильное кровотечение из влагалища;
— пропущена таблетка в первую неделю приема упаковки, и был половой контакт за 7 или менее дней до этого;
— отсутствие очередного менструальноподобного кровотечения 2 раза подряд или подозрение на беременность (не следует начинать прием таблеток из следующей упаковки до консультации с врачом).
Следует прекратить прием таблеток и немедленно обратиться за медицинской помощью, если имеются возможные признаки тромбоза, инфаркта миокарда или инсульта (необычный кашель, необычно сильная боль за грудиной, отдающая в левую руку, неожиданно возникшая одышка, необычная, сильная и длительная головная боль или приступ мигрени, частичная или полная потеря зрения или двоение в глазах, нечленораздельная речь, внезапные изменения слуха, обоняния или вкуса, головокружение или обморок, слабость или потеря чувствительности в любой части тела, сильная боль в животе, сильная боль в нижней конечности или внезапно возникший отек любой из нижних конечностей).
Влияние на способность к управлению транспортными средствами и механизмами. Не изучалось. Случаев неблагоприятного влияния на способность к управлению транспортными средствами и механизмами при приеме препарата не выявлено.
Форма выпуска
Таблетки, покрытые пленочной оболочкой. По 21 таблетке помещают в блистер из алюминиевой фольги и поливинилхлоридной пленки. 1 или 3 блистера вместе с кармашком для ношения блистера и инструкцией по применению помещают в картонную пачку с контролем первого вскрытия.
Производитель
Байер АГ. Мюллерштрассе 178, 13353 Берлин, Германия /Bayer AG. Mullerstrasse 178, 13353 Berlin, Germany.
Юридическое лицо, на имя которого выдано регистрационное удостоверение: Байер АГ. Кайзер-Вильгельм-Аллее, 1, 51373, г. Леверкузен, Германия/Bayer AG. Kaiser-Wilhelm-Allee, 1, 51373 Leverkusen, Germany.
За дополнительной информацией и с претензиями обращаться по адресу: 107113, Москва, 3-я Рыбинская ул., 18, стр. 2.
Тел.: +7 (495) 231-12-00.
www.bayer.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Торговое название:
Yasmin
Ясмин
Состав:
этинилэстрадиол 0. 03 мг
дроспиренон 3 мг
Вспомогательные компоненты:
лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон К25 , магния стеарат.
Свойства:
Ясмин® — низкодозированный монофазный пероральный комбинированный эстроген-гестагенный контрацептивный препарат.
Контрацептивный эффект комбинированных пероральных контрацептивных препаратов (КОК) основан на взаимодействии различных факторов, наиболее важными из которых являются подавление овуляции, повышение вязкости секрета шейки матки и изменения в эндометрии.
При правильном применении препарата Ясмин® индекс Перля (показатель, отражающий число беременностей у 100 женщин, применяющих контрацептив в течение года) составляет менее 1. При пропуске таблеток или неправильном применении индекс Перля может возрастать.
У женщин, принимающих КОК, менструальный цикл становится более регулярным, реже наблюдаются болезненные менструальноподобные кровотечения, уменьшается интенсивность и продолжительность кровотечения, в результате чего снижается риск железодефицитной анемии. Также имеются данные о снижении риска развития рака эндометрия и яичников при приеме КОК. Дроспиренон, входящий в состав препарата Ясмин®, обладает антиминералокортикоидной активностью и способен предупреждать увеличение массы тела и появление других симптомов (например, отеков), связанных с эстрогензависимой задержкой жидкости. Дроспиренон оказывает положительное воздействие на предменструальный синдром. В сочетании с этинилэстрадиолом дроспиренон демонстрирует благоприятный эффект на липидный профиль, характеризующийся повышением ЛПВП. Дроспиренон также обладает антиандрогенной активностью и способствует уменьшению угрей (акне), жирности кожи и волос (себореи). Эти особенности дроспиренона следует учитывать при выборе контрацептива женщинам с гормонозависимой задержкой жидкости, а также женщинам с акне и себореей.
Дроспиренон не обладает андрогенной, эстрогенной, глюкокортикоидной и антиглюкокортикоидной активностью. Все это в сочетании с антиминералокортикоидным и антиандрогенным действием обеспечивает дроспиренону биохимический и фармакологический профиль, сходный с естественным прогестероном.
Показания:
Контрацепция.
Способ применения и дозы:
Календарная упаковка препарата Ясмин® содержит 21 таблетку. Каждая таблетка в упаковке маркируется днем недели, в который она должна быть принята. Таблетки следует принимать внутрь каждый день в течение 21 дня по порядку, указанному на упаковке, примерно в одно и то же время, запивая небольшим количеством воды. Прием таблеток из следующей упаковки начинается после 7-дневного перерыва, во время которого обычно развивается менструальноподобное кровотечение (кровотечение «отмены»). Как правило, оно начинается на 2-3 день после приема последней таблетки и может не закончиться до начала приема таблеток из новой упаковки. После 7-дневного перерыва начинать прием таблеток из новой упаковки необходимо даже в случае, если менструальноподобное кровотечение еще не прекратилось. Это означает, что начинать прием таблеток из новой упаковки необходимо в один и тот же день недели, и что каждый месяц кровотечение «отмены» будет наступать примерно в один и тот же день недели.
Начало приема препарата Ясмин®:
Если никакое гормональное противозачаточное средство не применялось в предыдущем месяце
Прием препарата Ясмин® следует начинать в 1-й день менструального цикла (т. е. в 1-й день менструального кровотечения). Необходимо принять таблетку, которая промаркирована соответствующим днем недели. Затем следует принимать таблетки по порядку. Допускается начало приема на 2-5-й день менструального цикла, но в этом случае рекомендуется дополнительно использовать барьерный метод контрацепции в течение первых 7 дней приема таблеток из первой упаковки.
Прием пропущенных таблеток:
Если опоздание в приеме препарата составило менее 12 ч, контрацептивная защита не снижается. Женщина должна принять таблетку как можно скорее, следующая таблетка принимается в обычное время.
Если опоздание в приеме препарата составило более 12 ч, контрацептивная защита снижается. Чем больше таблеток пропущено, и чем ближе пропуск к 7-дневному перерыву в приеме таблеток, тем больше вероятность наступления беременности.
При этом необходимо помнить:
Прием препарата никогда не должен быть прерван более чем на 7 дней.
7 дней непрерывного приема таблеток требуется для достижения адекватного подавления гипоталамо-гипофизарно-яичниковой системы.
Противопоказания:
-тромбозы (венозные и артериальные) и тромбоэмболии (в т. ч. тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда, инсульт), цереброваскулярные нарушения — в настоящее время или в анамнезе;
-мигрень с очаговыми неврологическими симптомами в настоящее время или в анамнезе;
-сахарный диабет с сосудистыми осложнениями;
-панкреатит с выраженной гипертриглицеридемией в настоящее время или в анамнезе;
-печеночная недостаточность и тяжелые заболевания печени (до нормализации печеночных проб);
-тяжелая или острая почечная недостаточность;
-кровотечение из влагалища неясного генеза;
-беременность или подозрение на нее;
-период грудного вскармливания;
Меры предосторожности:
Следует учитывать повышенный риск развития тромбоэмболий в послеродовом периоде.
Нарушения периферического кровообращения также могут отмечаться при сахарном диабете, системной красной волчанке, гемолитико-уремическом синдроме, хронических воспалительных заболеваниях кишечника (болезнь Крона или язвенный колит) и серповидно-клеточной анемии.
Увеличение частоты и тяжести мигрени во время применения КОК (что может предшествовать цереброваскулярным нарушениям) является основанием для немедленной отмены приема этих препаратов.
Побочные эффекты:
Головная боль, вялость, сонливость.
Способ хранения:
При температуре не выше 30 градусов. В сухом месте.
Упаковка:
Картонная коробка вмещает блистер по 21 таблетке, бумажную инструкцию.
Топ 20 лекарств с такими-же компонентами:
Топ 20 лекарств с таким-же применением:
Таблетки, покрытые пленочной оболочкой, светло-желтого цвета, с одной стороны выгравирован шестиугольник с буквами «DO» внутри.
Контрацепция (предупреждение нежелательной беременности).
Внутрь, по порядку, указанному на упаковке, каждый день примерно в одно и то же время, запивая небольшим количеством воды.
Принимают по одной таблетке в день непрерывно в течение 21 дня. Прием таблеток из следующей упаковки начинается после 7-дневного перерыва, во время которого обычно развивается менструальноподобное кровотечение (кровотечение отмены). Как правило, оно начинается на 2–3-й день после приема последней таблетки и может не закончиться до начала приема таблеток из новой упаковки.
Как начать прием Ярины®
При отсутствии приема каких-либо гормональных контрацептивов в предыдущем месяце
Прием Ярины® начинается в первый день менструального цикла (т.е. в первый день менструального кровотечения). Допускается начало приема на 2–5-й день менструального цикла, но в этом случае рекомендуется дополнительно использовать барьерный метод контрацепции в течение первых 7 дней приема таблеток из первой упаковки.
При переходе с других комбинированных пероральных контрацептивов, вагинального кольца или контрацептивного пластыря
Предпочтительно начать прием Ярины® на следующий день после приема последней активной таблетки из предыдущей упаковки, но ни в коем случае не позднее следующего дня после обычного 7-дневного перерыва (для препаратов, содержащих 21 таблетку) или после приема последней неактивной таблетки (для препаратов, содержащих 28 таблеток в упаковке). Прием Ярины® следует начинать в день удаления вагинального кольца или пластыря, но не позднее дня, когда должно быть введено новое кольцо или наклеен новый пластырь.
При переходе с контрацептивов, содержащих только гестагены («мини-пили», инъекционные формы, имплантат), или с высвобождающего гестаген внутриматочного контрацептива (Мирена)
Можно перейти с «мини-пили» на Ярину® в любой день (без перерыва), с импланта или внутриматочного контрацептива с гестагеном — в день его удаления, с инъекционной формы — со дня, когда должна быть сделана следующая инъекция. Во всех случаях необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток.
После аборта в I триместре беременности
Можно начать прием препарата немедленно, в день проведения аборта. При соблюдении этого условия женщина не нуждается в дополнительной контрацепции.
После родов или аборта во II триместре беременности
Начинать прием препарата следует не ранее 21–28-го дня после родов (при отсутствии грудного вскармливания) или аборта во II триместре беременности. Если прием начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток. Однако если женщина уже жила половой жизнью, до начала приема Ярины® должна быть исключена беременность или необходимо дождаться первой менструации.
Прием пропущенных таблеток
Если опоздание в приеме препарата составило менее 12 ч, контрацептивная защита не снижается. Женщина должна принять таблетку как можно скорее, следующая принимается в обычное время.
Если опоздание в приеме таблеток составило более 12 ч, контрацептивная защита снижается. Чем больше таблеток пропущено и чем ближе пропуск к 7-дневному перерыву в приеме таблеток, тем больше вероятность наступления беременности.
При этом можно руководствоваться следующими двумя основными правилами:
— прием препарата никогда не должен быть прерван, более чем на 7 дней;
— для достижения адекватного подавления гипоталамо-гипофизарно-яичниковой регуляции требуются 7 дней непрерывного приема таблеток.
Соответственно, могут быть даны следующие советы, если опоздание в приеме таблеток превышает 12 ч (интервал с момента приема последней таблетки — более 36 ч).
Первая неделя приема препарата
Необходимо принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если для этого нужно принять две таблетки одновременно). Следующую таблетку принимают в обычное время. Дополнительно должен быть использован барьерный метод контрацепции (например презерватив) в течение следующих 7 дней. Если половое сношение имело место в течение недели перед пропуском таблетки, необходимо учитывать вероятность наступления беременности.
Вторая неделя приема препарата
Необходимо принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если для этого нужно принять две таблетки одновременно). Следующую таблетку принимают в обычное время. При условии, что женщина принимала таблетки правильно в течение 7 дней, предшествующих первой пропущенной таблетке, нет необходимости в использовании дополнительных контрацептивных мер. В противном случае, а также при пропуске двух и более таблеток необходимо дополнительно использовать барьерные методы контрацепции (например презерватив) в течение 7 дней.
Третья неделя приема препарата
Риск беременности повышается из-за предстоящего перерыва в приеме таблеток. Женщина должна строго придерживаться одного из двух указанных ниже вариантов. При этом, если в течение 7 дней, предшествующих первой пропущенной таблетке, все таблетки принимались правильно, нет необходимости использовать дополнительные контрацептивные методы.
1. Необходимо принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если для этого нужно принять две таблетки одновременно). Следующие таблетки принимают в обычное время, пока не закончатся таблетки из текущей упаковки. Прием таблеток из следующей упаковки следует начать сразу же без перерыва. Кровотечение отмены маловероятно, пока не закончится вторая упаковка, но могут отмечаться мажущие выделения и прорывные кровотечения во время приема таблеток.
2. Можно прервать прием таблеток из текущей упаковки, начав таким образом 7-дневный перерыв (включая и день пропуска таблеток), а затем начать прием таблеток из новой упаковки.
Если женщина пропустила прием таблеток, и затем во время перерыва в приеме у нее нет кровотечения отмены, необходимо исключить беременность.
Рекомендации в случае рвоты и диареи
В случае рвоты или диареи в период до 4 ч после приема таблеток, всасывание может быть неполным, и должны быть приняты дополнительные меры предохранения от нежелательной беременности. В таких случаях следует ориентироваться на вышеизложенные рекомендации при пропуске таблеток.
Изменение дня начала менструальноподобного кровотечения
Для того, чтобы отложить начало менструальноподобного кровотечения, необходимо продолжить дальнейший прием таблеток из новой упаковки Ярины® без 7-дневного перерыва. Таблетки из новой упаковки могут приниматься так долго, как это необходимо, в т.ч. до тех пор, пока таблетки из упаковки не закончатся. На фоне приема препарата из второй упаковки возможны мажущие кровянистые выделения из влагалища или прорывные маточные кровотечения. Возобновить прием Ярины® из очередной упаковки следует после обычного 7-дневного перерыва.
Для того чтобы перенести день начала менструальноподобного кровотечения на другой день недели, женщине следует сократить ближайший перерыв в приеме таблеток на столько дней, на сколько она хочет. Чем короче интервал, тем выше риск, что у нее не будет кровотечения отмены, и в дальнейшем будут наблюдаться мажущие выделения и прорывные кровотечения во время приема второй упаковки (так же как в случае, когда она хотела бы отсрочить начало менструальноподобного кровотечения).
Дополнительная информация для особых категорий пациентов
Дети и подростки. Препарат Ярина показан только после наступления менархе. Имеющиеся данные не предполагают коррекцию дозы у данной группы пациентов.
Пациенты пожилого возраста. Не применимо. Препарат Ярина® не показан после наступления менопаузы.
Пациенты с нарушениями со стороны печени. Препарат Ярина® противопоказан женщинам с тяжелыми заболеваниями печени до тех пор, пока показатели функции печени не придут в норму (см. также «Противопоказания» и «Фармакокинетика»).
Пациенты с нарушениями со стороны почек. Препарат Ярина® противопоказан женщинам с тяжелой почечной недостаточностью или с острой почечной недостаточностью (см. также «Противопоказания» и «Фармакокинетика»).
Ярина® не должна применяться при наличии какого-либо из состояний/заболеваний, перечисленных ниже:
тромбозы (венозные и артериальные) и тромбоэмболии в настоящее время или в анамнезе (в т.ч. тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда, инсульт), цереброваскулярные нарушения;
состояния, предшествующие тромбозу (в т.ч. транзиторные ишемические атаки, стенокардия) в настоящее время или в анамнезе;
мигрень с очаговыми неврологическими симптомами в настоящее время или в анамнезе;
сахарный диабет с сосудистыми осложнениями;
множественные или выраженные факторы риска венозного или артериального тромбоза, в т.ч. осложненные поражения клапанного аппарата сердца, фибрилляция предсердий, заболевания сосудов головного мозга или коронарных артерий; неконтролируемая артериальная гипертензия, серьезное хирургическое вмешательство с длительной иммобилизацией, курение в возрасте старше 35 лет;
панкреатит с выраженной гипертриглицеридемией в настоящее время или в анамнезе;
печеночная недостаточность и тяжелые заболевания печени (до нормализации печеночных проб);
опухоли печени (доброкачественные или злокачественные) в настоящее время или в анамнезе;
тяжелая и/или острая почечная недостаточность;
выявленные гормонозависимые злокачественные заболевания (в т.ч. половых органов или молочных желез) или подозрение на них;
кровотечение из влагалища неясного генеза;
беременность или подозрение на нее;
период кормления грудью;
повышенная чувствительность к любому из компонентов препарата Ярина®.
Если какие-либо из этих состояний развиваются впервые на фоне приема Ярины®, препарат должен быть немедленно отменен.
С ОСТОРОЖНОСТЬЮ
Следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения комбинированных пероральных контрацептивов в каждом индивидуальном случае при наличии следующих заболеваний/состояний и факторов риска:
факторы риска развития тромбоза и тромбоэмболии: курение, ожирение, дислипопротеинемия, артериальная гипертензия, мигрень, пороки клапанов сердца, длительная иммобилизация, серьезные хирургические вмешательства, обширная травма, наследственная предрасположенность к тромбозу (тромбозы, инфаркт миокарда или нарушение мозгового кровообращения в молодом возрасте у кого-либо из ближайших родственников);
другие заболевания, при которых могут отмечаться нарушения периферического кровообращения (сахарный диабет, системная красная волчанка, гемолитический уремический синдром, болезнь Крона и неспецифический язвенный колит, серповидно-клеточная анемия), флебит поверхностных вен;
наследственный ангионевротический отек;
гипертриглицеридемия;
заболевания печени;
заболевания, впервые возникшие или усугубившиеся во время беременности или на фоне предыдущего приема половых гормонов (например желтуха и/или зуд, связанные с холестазом, холелитиаз, отосклероз с ухудшением слуха, порфирия, герпес беременных, хорея Сиденгама);
послеродовой период.
К наиболее часто сообщаемым побочным реакциям на препарат Ярина® относятся тошнота и боль в молочных железах. Они встречались более чем у 6% женщин, применяющих данный препарат.
Серьезными побочными реакциями являются артериальная и венозная тромбоэмболия.
Ниже в таблице приведена частота нежелательных реакций. о которых сообщалось в ходе клинических исследований препарата Ярина® (N=4897). В пределах каждой группы, выделенной в зависимости от частоты возникновения нежелательной реакции, нежелательные реакции представлены в порядке уменьшения их тяжести. По частоте они разделяются на частые (≥1/100 и <1/10), нечастые (≥1/1000 и <1/100) и редкие (≥1/10000 и <1/1000). Для дополнительных нежелательных реакций, выявленных только в процессе постмаркетинговых исследований, и для которых оценку частоты возникновения провести не представлялось возможным, указано «частота неизвестна» (см. табл. 1).
Таблица 1
| Системно-органные классы (версия MedDRA) | Часто | Нечасто | Частота неизвестна |
| Психические расстройства | Перепады настроения, депрессия, подавленное настроение, уменьшение или потеря либидо | ||
| Нервная система | Мигрень | ||
| Нарушения со стороны сосудов | Венозная или артериальная тромбоэмболия* | ||
| ЖКТ | Тошнота | ||
| Кожа и подкожные ткани | Многоформная эритема | ||
| Репродуктивная система и молочные железы | Боль в молочных железах, нерегулярные маточные кровотечения, кровотечения из половых путей неуточненного генеза |
Нежелательные явления в ходе клинических исследований были кодифицированы с использованием словаря MedDRA (Медицинский словарь регуляторной деятельности, версия 12.1). Различные термины MedDRA, отражающие один и тот же симптом, были сгруппированы вместе и представлены в качестве единственной побочной реакции, во избежание ослабления или размытия истинного эффекта.
* — Примерная частота по итогам эпидемиологических исследований, охватывающих группу комбинированных пероральных контрацептивов. Частота граничила с очень редкой.
— Венозная или артериальная тромбоэмболия включает в себя следующие нозологические единицы: окклюзия периферических глубоких вен, тромбоз и эмболия/окклюзия легочных сосудов, тромбоз, эмболия и инфаркт/инфаркт миокарда/церебральный инфаркт и инсульт, не определенный как геморрагический.
Для венозной и артериальной тромбоэмболии, мигрени см. также «Противопоказания» и «Особые указания».
Дополнительная информация
Ниже перечислены побочные реакции с очень редкой частотой возникновения или с отсроченными симптомами, которые, как полагают, могут быть связаны с приемом препаратов из группы комбинированных пероральных контрацептивов (см. также «Противопоказания» и «Особые указания»).
Опухоли:
— частота диагностирования рака молочной железы у женщин, принимающих комбинированные пероральные контрацептивы, несколько повышена. В связи с тем, что рак молочной железы отмечается редко у женщин до 40 лет, увеличение числа диагнозов рака молочной железы у женщин, принимающих комбинированные пероральные контрацептивы, является незначительным по отношению к общему риску этого заболевания.
— опухоли печени (доброкачественные и злокачественные).
Другие состояния:
— узловатая эритема;
— женщины с гипертриглицеридемией (повышенный риск панкреатита во время приема комбинированных пероральных контрацептивов);
— повышение АД;
— состояния, развивающиеся или ухудшающиеся во время приема комбинированных пероральных контрацептивов, но их связь с приемом препарата не доказана (желтуха и/или зуд, связанный с холестазом; формирование камней в желчном пузыре; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама; герпес беременных; потеря слуха, связанная с отосклерозом);
— у женщин с наследственным ангионевротическим отеком прием эстрогенов может вызывать или усугублять его симптомы;
— нарушения функции печени;
— нарушение толерантности к глюкозе или влияние на резистентность к инсулину;
— болезнь Крона, язвенный колит;
— хлоазма;
— гиперчувствительность (включая такие симптомы как сыпь, крапивница).
Взаимодействие. Взаимодействие комбинированных пероральных контрацептивов с другими ЛС (индукторы микросомальных ферментов печени, некоторые антибиотики) может привести к прорывным кровотечениям и/или снижению контрацептивной эффективности (см. «Взаимодействие»).
Симптомы (выявлены на основании суммарного опыта применения пероральных контрацептивов): тошнота, рвота, мажущие кровянистые выделения или метроррагия.
Лечение: симптоматическое. Специфического антидота нет.
О серьезных нарушениях при передозировке не сообщалось.
Ярина® — низкодозированный монофазный пероральный комбинированный эстроген-гестагенный контрацептивный препарат.
Контрацептивный эффект Ярины® в основном осуществляется за счет подавления овуляции и повышения вязкости цервикальной слизи.
Частота возникновения венозной тромбоэмболии (ВТЭ) у женщин с факторами риска ВТЭ или без них, применяющих этинилэстрадиол/дроспиренонсодержащие пероральные контрацептивы в дозе 0,03 мг/3 мг, такая же как и у женщин, применяющих левоноргестрелсодержащие комбинированные пероральные контрацептивы или другие комбинированные пероральные контрацептивы. Это было подтверждено при проведении проспективного контролируемого исследования баз данных, в ходе которого сравнивали женщин, применяющих пероральные контрацептивы в дозе 0,03 мг этинилэстрадиола/3 мг дроспиренона, с женщинами, применяющими другие комбинированные пероральные контрацептивы. Анализ данных выявил одинаковый риск возникновения ВТЭ среди выборки.
У женщин, принимающих комбинированные пероральные контрацептивы, менструальный цикл становится более регулярным, реже наблюдаются болезненные менструальноподобные кровотечения, уменьшается интенсивность и продолжительность кровотечения, в результате чего снижается риск железодефицитной анемии. Имеются также данные о снижении риска рака эндометрия и яичников.
Дроспиренон, содержащийся в Ярине®, обладает антиминералокортикоидным действием и способен предупреждать увеличение массы тела и появление других симптомов (например отеков), связанных с эстрогензависимой задержкой жидкости. Дроспиренон также обладает антиандрогенной активностью и способствует уменьшению акне (угрей), жирности кожи и волос. Такой эффект дроспиренона подобен действию естественного прогестерона, вырабатываемого женским организмом. Это следует учитывать при выборе контрацептива, особенно женщинам с гормонозависимой задержкой жидкости, а также женщинам с угревой сыпью (акне) и себореей. При правильном применении индекс Перля (показатель, отражающий число беременностей у 100 женщин, применяющих контрацептив в течение года) составляет менее 1. При пропуске таблеток или неправильном применении индекс Перля может возрастать.
Дроспиренон
При пероральном приеме дроспиренон быстро и почти полностью абсорбируется. После однократного приема внутрь Cmax дроспиренона в сыворотке, равная 37 нг/мл, достигается через 1–2 ч. Биодоступность колеблется от 76 до 85%. Прием пищи не влияет на биодоступность дроспиренона.
Дроспиренон связывается с сывороточным альбумином (0,5–0,7%) и не связывается с глобулином, связывающим половые гормоны (ГСПГ), или кортикостероид-связывающим глобулином (КСГ). В свободном виде находится только 3–5% общей концентрации в сыворотке крови. Индуцированное этинилэстрадиолом повышение ГСПГ не влияет на связывание дроспиренона белками плазмы.
После перорального приема дроспиренон полностью метаболизируется.
Большинство метаболитов в плазме представлены кислотными формами дроспиренона, которые образуются без вовлечения цитохрома Р450.
Концентрация дроспиренона в плазме крови снижается в 2 фазы. В неизмененном виде дроспиренон не экскретируется. Метаболиты дроспиренона экскретируются почками и через кишечник в соотношении примерно 1,2–1,4. T1/2 для экскреции метаболитов с мочой и фекалиями составляет примерно 40 ч.
Во время циклового лечения максимальная равновесная концентрация дроспиренона в сыворотке достигается во второй половине цикла.
Дальнейшее увеличение сывороточной концентрации дросперинона отмечается через 1–6 циклов приема, после чего увеличения концентрации не наблюдается.
Дополнительная информация для особых категорий пациентов
Пациенты с нарушениями со стороны печени. У женщин с умеренным нарушением функции печени (класс В по шкале Чайлд-Пью) AUC сопоставима с соответствующим показателем у здоровых женщин с близкими значениями Cmax в фазы абсорбции и распределения. T1/2 дроспиренона у больных с умеренным нарушением функции печени оказался в 1,8 раз выше, чем у здоровых добровольцев с сохранной функцией печени.
У больных с умеренным нарушением функции печени отмечено снижение клиренса дроспиренона на 50% по сравнению с женщинами с сохранной функцией печени, при этом не отмечено различий в концентрации калия в плазме крови в изучаемых группах. При выявлении сахарного диабета и сопутствующем применении спиронолактона (оба состояния расцениваются как факторы, предрасполагающие к развитию гиперкалиемии), повышение концентрации калия в плазме крови не установлено.
Следует заключить, что переносимость дроспиренона у женщин с легким и умеренным нарушением функции печени хорошая (класс В по шкале Чайлд-Пью).
Пациенты с нарушениями со стороны почек. Концентрация дроспиренона в плазме крови при достижении равновесного состояния была сопоставима у женщин с легким нарушением функции почек (Cl креатинина — 50–80 мл/мин) и у женщин с сохранной функцией почек (Cl креатинина — >80 мл/мин). Тем не менее, у женщин с умеренным нарушением функции почек (Cl креатинина — 30–50 мл/мин) средняя концентрация дроспиренона в плазме крови была на 37% выше, чем у пациенток с сохранной функцией почек. Дроспиренон хорошо переносился всеми группами пациенток. Не отмечено изменения концентрации калия в плазме крови при применении дроспиренона.
Этинилэстрадиол
После приема внутрь этинилэстрадиол быстро и полностью абсорбируется. Cmax в плазме крови, равная примерно 54–100 пг/мл, достигается за 1–2 ч. Во время всасывания и первого прохождения через печень этинилэстрадиол метаболизируется, в результате чего его биодоступность при приеме внутрь составляет, в среднем, около 45%.
Этинилэстрадиол практически полностью (приблизительно 98%), хотя и неспецифично, связывается альбумином. Этинилэстрадиол индуцирует синтез ГСПГ.
Этинилэстрадиол подвергается пресистемной конъюгации, как в слизистой оболочке тонкой кишки, так и в печени. Основной путь метаболизма — ароматическое гидроксилирование.
Уменьшение концентрации этинилэстрадиола в плазме крови носит двухфазный характер. В неизмененном виде из организма не выводится. Метаболиты этинилэстрадиола выводятся с мочой и желчью в соотношении 4:6 с T1/2 около 24 ч.
Css достигается па протяжении второй половины цикла.
Взаимодействие пероральных контрацептивов с другими ЛС может привести к прорывным кровотечениям и/или снижению контрацептивной надежности. Женщины, принимающие эти препараты, должны временно использовать барьерные методы контрацепции дополнительно к препарату Ярина®, или выбрать другой метод контрацепции.
В литературе сообщалось о следующих видах взаимодействия.
Влияние на печеночный метаболизм. Применение препаратов, индуцирующих микросомальные ферменты печени, может привести к возрастанию клиренса половых гормонов, что в свою очередь может привести к прорывным кровотечениям или снижению надежности контрацепции. К таким ЛС относятся: фенитоин, барбитураты, примидон, карбамазепин, рифампицин, рифабутин, возможно также окскарбазепин, топирамат, фелбамат, гризеофульвин и препараты, содержащие зверобой.
Ингибиторы ВИЧ-протеазы (например ритонавир) и ненуклеозидные ингибиторы обратной транскриптазы (например невирапин) и их комбинации также потенциально могут влиять на печеночный метаболизм.
Влияние на кишечно-печеночную циркуляцию. По данным отдельных исследований, некоторые антибиотики (например пенициллины и тетрациклин) могут снижать кишечно-печеночную циркуляцию эстрогенов, тем самым понижая концентрацию этинилэстрадиола.
Во время приема препаратов, влияющих на микросомальные ферменты, и в течение 28 дней после их отмены следует дополнительно использовать барьерный метод контрацепции.
Во время приема антибиотиков (таких как пенициллины и тетрациклины) и в течение 7 дней после их отмены следует дополнительно использовать барьерный метод контрацепции. Если в течение этих 7 дней барьерного метода контрацепции заканчиваются таблетки в текущей упаковке, то следует начать прием таблеток из следующей упаковки Ярины® без обычного перерыва в приеме таблеток.
Основные метаболиты дроспиренона образуются в плазме без участия системы цитохрома Р450. Поэтому маловероятно влияние ингибиторов системы цитохрома Р450 на метаболизм дроспиренона.
Пероральные комбинированные контрацептивы могут влиять на метаболизм других препаратов, что приводит к повышению (например циклоспорин) или снижению (например ламотриджин) их концентрации в плазме и тканях.
На основании исследований взаимодействия in vitro, а также исследовании in vivo на женщинах-добровольцах, принимающих омепразол, симвастатин и мидазолам в качестве маркеров, можно заключить, что влияние дроспиренона в дозе 3 мг на метаболизм других лекарственных субстанций маловероятно.
Имеется теоретическая возможность повышения сывороточного уровня калия у женщин, получающих Ярину® одновременно с другими препаратами, которые могут увеличивать сывороточный уровень калия. К этим препаратам относятся антагонисты рецепторов ангиотензина II, некоторые противовоспалительные препараты, калийсберегающие диуретики и антагонисты альдостерона. Однако в исследованиях, оценивающих взаимодействие дроспиренона с ингибиторами АПФ или индометацином, не было выявлено достоверного различия между сывороточной концентрацией калия в сравнении с плацебо.
- Контрацептивное средство (эстроген + гестаген) [Эстрогены, гестагены; их гомологи и антагонисты в комбинациях]
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности препарата Ярина®3 года.
Не применять по истечении срока годности, указанного на упаковке.
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| активные вещества: | |
| этинилэстрадиол | 30 мкг |
| дроспиренон | 3 мг |
| вспомогательные вещества: лактозы моногидрат — 48,17 мг; крахмал кукурузный — 14,4 мг; крахмал кукурузный прежелатинизированный — 9,6 мг; повидон К25 — 4 мг; магния стеарат — 800 мкг; гипромеллоза (гидроксипропилметилцеллюлоза) — 1,0112 мг; макрогол 6000 — 202,4 мкг; тальк (магния гидросиликат) — 202,4 мкг; титана диоксид (Е171) — 556,5 мкг; железа (II) оксид (Е172) — 27,5 мкг |
Форма выпуска
Таблетки, покрытые пленочной оболочкой. В блистере из алюминиевой фольги и ПВХ пленки 21 шт. 1 или 3 блистера помещают в картонную пачку.
Препарат не назначается во время беременности и в период кормления грудью. Если беременность выявляется во время приема препарата Ярина®, его следует сразу же отменить. Однако обширные эпидемиологические исследования не выявили повышенного риска дефектов развития у детей, рожденных женщинами, получавшими половые гормоны до беременности или тератогенного действия в случаях приема половых гормонов по неосторожности в ранние сроки беременности. В то же время, данные о результатах приема препарата Ярина® во время беременности ограничены, что не позволяет сделать какие-либо выводы о негативном влиянии препарата на беременность, здоровье новорожденного и плода. В настоящее время какие-либо значимые эпидемиологические данные отсутствуют.
Прием комбинированных пероральных контрацептивов может уменьшать количество грудного молока и изменять его состав, поэтому их использование не рекомендуется до прекращения грудного вскармливания. Небольшое количество половых стероидов и/или их метаболитов может выводиться с молоком.
Если какие-либо из состояний, заболеваний и факторов риска, указанных ниже, имеются в настоящее время, то следует тщательно взвесить потенциальный риск и ожидаемую пользу применения комбинированных пероральных контрацептивов в каждом индивидуальном случае и обсудить его с женщиной до того, как она решит начать прием препарата. В случае утяжеления, усиления или первого проявления любого из этих состояний, заболеваний или увеличения факторов риска, женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости отмены препарата.
Заболевания ССС
Результаты эпидемиологических исследований указывают на наличие взаимосвязи между применением комбинированных пероральных контрацептивов и повышением частоты развития венозных и артериальных тромбозов и тромбоэмболий (таких как тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда, цереброваскулярные нарушения) при приеме комбинированных пероральных контрацептивов. Данные заболевания отмечаются редко. Риск развития ВТЭ максимален в первый год приема таких препаратов. Повышенный риск присутствует после первоначального использования комбинированных пероральных контрацептивов или возобновления использования одного и того же или разных комбинированных пероральных контрацептивов (после перерыва между приемами препарата в 4 нед и более). Данные крупного проспективного исследования с участием 3 групп пациентов показывают, что этот повышенный риск присутствует преимущественно в течение первых 3 мес.
Общий риск ВТЭ у пациенток, принимающих низкодозированные комбинированные пероральные контрацептивы (содержание этинилэстрадиола — менее 50 мкг), в 2–3 раза выше, чем у небеременных пациенток, которые не принимают комбинированные пероральные контрацептивы, тем не менее, этот риск остается более низким по сравнению с риском ВТЭ при беременности и родах. ВТЭ может угрожать жизни или привести к летальному исходу (в 1–2% случаев).
ВТЭ, проявляющаяся как тромбоз глубоких вен, или эмболия легочной артерии, может произойти при применении любых комбинированных пероральных контрацептивов.
Очень редко при применении комбинированных пероральных контрацептивов возникает тромбоз других кровеносных сосудов (например печеночных, брыжеечных, почечных, мозговых вен и артерий или сосудов сетчатки). Единое мнение относительно связи между возникновением этих событий и применением комбинированных пероральных контрацептивов отсутствует. Симптомы тромбоза глубоких вен (ТГВ) включают следующее: односторонний отек нижней конечности или вдоль вены на ноге, боль или дискомфорт в ноге только в вертикальном положении или при ходьбе, локальное повышение температуры в пораженной ноге, покраснение или изменение окраски кожных покровов на ноге.
Симптомы тромбоэмболии легочной артерии (ТЭЛА) заключаются в следующем: затрудненное или учащенное дыхание; внезапный кашель, в т.ч. с кровохарканием; острая боль в грудной клетке, которая может усиливаться при глубоком вдохе; чувство тревоги; сильное головокружение; учащенное или нерегулярное сердцебиение. Некоторые из этих симптомов (например одышка, кашель) являются неспецифическими, и могут быть истолкованы неверно — как признаки других более или менее тяжелых событий (например инфекция дыхательных путей).
Артериальная тромбоэмболия может привести к инсульту, окклюзии сосудов или инфаркту миокарда. Симптомы инсульта состоят в следующем: внезапная слабость или потеря чувствительности лица, руки или ноги, особенно с одной стороны тела, внезапная спутанность сознания, проблемы с речью и пониманием; внезапная одно- или двухсторонняя потеря зрения; внезапное нарушение походки, головокружение, потеря равновесия или координации движений; внезапная, тяжелая или продолжительная головная боль без видимой причины; потеря сознания или обморок с эпилептическим припадком или без него. Другие признаки окклюзии сосудов: внезапная боль, отечность и слабое посинение конечностей, острый живот.
Симптомы инфаркта миокарда включают: боль, дискомфорт, давление, тяжесть, чувство сжатия или распирания в груди, в руке или за грудиной; дискомфорт с иррадиацией в спину, скулу, гортань, руку, желудок; холодный пот, тошнота, рвота или головокружение, сильная слабость, тревога или одышка; учащенное или нерегулярное сердцебиение. Артериальная тромбоэмболия может привести к летальному исходу. Риск развития тромбоза (венозного и/или артериального) и тромбоэмболии повышается:
— с возрастом;
— у курящих (с увеличением количества сигарет или повышением возраста риск нарастает, особенно у женщин старше 35 лет).
При наличии:
— ожирения (индекс массы тела более чем 30 кг/м2);
— семейного анамнеза (например венозной или артериальной тромбоэмболии когда-либо у близких родственников или родителей в относительно молодом возрасте). В случае наследственной или приобретенной предрасположенности, женщина должна быть осмотрена соответствующим специалистом для решения вопроса о возможности приема комбинированных пероральных контрацептивов;
— длительной иммобилизации, серьезного хирургического вмешательства, любой операции на ногах или обширной травмы. В этих ситуациях желательно прекратить использование комбинированных пероральных контрацептивов (в случае планируемой операции, по крайней мере за 4 нед до нее) и не возобновлять прием в течение 2 нед после окончания иммобилизации;
— дислипопротеинемии;
— артериальной гипертензии;
— мигрени;
— заболеваний клапанов сердца;
— фибрилляции предсердий.
Вопрос о возможной роли варикозного расширения вен и поверхностного тромбофлебита в развитии венозной тромбоэмболии остается спорным. Следует учитывать повышенный риск развития тромбоэмболии в послеродовом периоде.
Нарушение периферического кровообращения также может отмечаться при сахарном диабете, системной красной волчанке, гемолитическом уремическом синдроме, хронических воспалительных заболеваниях кишечника (болезнь Крона или неспецифический язвенный колит) и серповидно-клеточной анемии. Увеличение частоты и тяжести мигрени во время применения комбинированных пероральных контрацептивов (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема этих препаратов.
К биохимическим показателям, указывающим на наследственную или приобретенную предрасположенность к венозному или артериальному тромбозу относятся следующие: резистентность к активированному протеину С, гипергомоцистеинемия, недостаток антитромбина-III, дефицит протеина С, недостаток белка S, антифосфолипидные антитела (антикардиолипиновые антитела, волчаночный антикоагулянт). При оценке соотношения риска и пользы, следует учитывать, что адекватное лечение соответствующего состояния может уменьшить связанный с ним риск тромбоза. Также следует учитывать, что риск тромбозов и тромбоэмболии при беременности выше, чем при приеме низкодозированных пероральных контрацептивов (содержание этинилэстрадиола — 0,05 мг).
Опухоли
Наиболее существенным фактором риска развития рака шейки матки, является персистирующая папилломавирусная инфекция. Имеются сообщения о некотором повышении риска развития рака шейки матки при длительном применении комбинированных пероральных контрацептивов. Однако связь с приемом комбинированных пероральных контрацептивов не доказана. Обсуждается возможность взаимосвязи этих данных со скринингом заболеваний. Сохраняются противоречия относительно того, в какой степени эти данные связаны со скринингом на предмет патологии шейки матки или с особенностями полового поведения (более редкое применение барьерных методов контрацепции).
Мета-анализ 54 эпидемиологических исследований показал, что имеется несколько повышенный относительный риск развития рака молочной железы, диагностированного у женщин, принимающих комбинированные пероральные контрацептивы в настоящее время (относительный риск — 1,24). Повышенный риск постепенно исчезает в течение 10 лет после прекращения приема этих препаратов. В связи с тем, что рак молочной железы отмечается редко у женщин до 40 лет, увеличение числа диагнозов рака молочной железы у женщин, принимающих комбинированные пероральные контрацептивы в настоящее время или принимавших недавно, является незначительным по отношению к общему риску этого заболевания. Его связь с приемом комбинированных пероральных контрацептивов не доказана. Наблюдаемое повышение риска может быть также следствием тщательного наблюдения и более ранней диагностики рака молочной железы у женщин, применяющих комбинированные пероральные контрацептивы. У женщин, когда-либо использовавших комбинированные пероральные контрацептивы, выявляются более ранние стадии рака молочной железы, чем у женщин, никогда их не применявших.
В редких случаях на фоне применения комбинированных пероральных контрацептивов наблюдалось развитие доброкачественных, а в крайне редких случаях — злокачественных опухолей печени, которые иногда приводили к угрожающему жизни внутрибрюшному кровотечению. В случае появления сильных болей в области живота, увеличения печени или признаков внутрибрюшного кровотечения это следует учитывать при проведении дифференциального диагноза. Злокачественные опухоли могут угрожать жизни или привести к летальному исходу.
Другие состояния
Клинические исследования показали отсутствие влияния дроспиренона на концентрацию калия в плазме крови у больных с легкой и умеренной почечной недостаточностью. Тем не менее, у больных с нарушением функции почек и изначальной концентрацией калия на уровне ВГН, нельзя исключить риск развития гиперкалиемии на фоне приема ЛС, приводящих к задержке калия в организме.
У женщин с гипертриглицеридемией (или наличием этого состояния в семейном анамнезе) возможно повышение риска развития панкреатита во время приема комбинированных пероральных контрацептивов.
Несмотря на то, что небольшое повышение АД было описано у многих женщин, принимающих комбинированные пероральные контрацептивы, клинически значимые повышения отмечались редко. Тем не менее, если во время приема препарата развивается стойкое, клинически значимое повышение АД, следует отменить эти препараты и начать лечение артериальной гипертензии. Прием препарата может быть продолжен, если с помощью гипотензивной терапии достигнуты нормальные значения АД. Как было сообщено, следующие состояния развиваются или ухудшаются как во время беременности, так и при приеме комбинированных пероральных контрацептивов (но их связь с приемом комбинированных пероральных контрацептивов не доказана): желтуха и/или зуд, связанный с холестазом; формирование камней в желчном пузыре; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама; герпес беременных; потеря слуха, связанная с отосклерозом. Также описаны случаи болезни Крона и неспецифического язвенного колита на фоне применения комбинированных пероральных контрацептивов. У женщин с наследственными формами ангионевротического отека экзогенные эстрогены могут вызывать или ухудшать симптомы ангионевротического отека.
Острые или хронические нарушения функции печени могут потребовать отмены препарата до тех пор, пока показатели функции печени не вернутся в норму. Рецидивирующая холестатическая желтуха, которая развивается впервые во время беременности или предыдущего приема половых гормонов, требует прекращения приема препарата. Хотя комбинированные пероральные контрацептивы могут оказывать влияние на резистентность к инсулину и толерантность к глюкозе, нет необходимости изменения терапевтического режима у больных сахарным диабетом, использующих низкодозированные комбинированные пероральные контрацептивы (содержание этинилэстрадиола — менее 0,05 мг). Тем не менее, женщины с сахарным диабетом должны тщательно наблюдаться во время приема данного препарата.
Иногда может развиваться хлоазма, особенно у женщин с наличием в анамнезе хлоазмы беременных. Женщины со склонностью к хлоазме во время приема препарата Ярина® должны избегать длительного пребывания на солнце и воздействия УФ-излучения.
Доклинические данные о безопасности
Доклинические данные, полученные в ходе стандартных исследований на предмет выявления токсичности при многократном приеме доз препарата, а также генотоксичности, канцерогенного потенциала и токсичности для репродуктивной системы, не указывают на наличие особого риска для человека. Тем не менее, следует помнить, что половые стероиды могут способствовать росту некоторых гормонозависимых тканей и опухолей.
Лабораторные тесты
Прием комбинированных пероральных контрацептивов может влиять на результаты некоторых лабораторных тестов, включая показатели функции печени, почек, щитовидной железы, надпочечников, уровень транспортных белков в плазме, показатели углеводного обмена, показатели свертывания крови и фибринолиза. Изменения обычно не выходят за границы нормальных значений. Дроспиренон увеличивает активность ренина плазмы и уровень альдостерона в плазме, что связано с его антиминералокортикоидным эффектом.
Снижение эффективности
Эффективность препарата Ярина® может быть снижена в следующих случаях: при пропуске приема таблеток, при рвоте и диарее (см. «Прием пропущенных таблеток») или в результате лекарственного взаимодействия.
Недостаточный контроль менструальноподобного цикла
На фоне приема препарата Ярина® могут отмечаться нерегулярные (ациклические) кровянистые выделения/кровотечения из влагалища (мажущие кровянистые выделения или прорывные кровотечения), особенно в течение первых месяцев применения. Поэтому оценка любых нерегулярных менструальноподобных кровотечений должна проводиться после периода адаптации, составляющего приблизительно 3 цикла. Если нерегулярные менструальноподобные кровотечения повторяются или развиваются после предшествующих регулярных циклов, следует провести тщательное обследование для исключения злокачественных новообразований или беременности.
У некоторых женщин во время перерыва в приеме таблеток может не развиться кровотечение отмены. Если препарат Ярина® принимался согласно рекомендациям, маловероятно, что женщина беременна. Тем не менее, при нерегулярном применении препарата и отсутствии двух подряд менструальноподобных кровотечений, прием препарата не может быть продолжен до исключения беременности.
Медицинские осмотры
Перед началом или возобновлением применения препарата Ярина® необходимо ознакомиться с анамнезом жизни, семейным анамнезом женщины, провести тщательное общемедицинское и гинекологическое обследование, исключить беременность. Объем исследований и частота контрольных осмотров должны основываться на существующих нормах медицинской практики при необходимом учете индивидуальных особенностей каждой пациентки. Как правило, измеряется АД, ЧСС, определяется индекс массы тела, проверяется состояние молочных желез, брюшной полости и органов малого таза, включая цитологическое исследование эпителия шейки матки (тест по Папаниколау). Обычно контрольные обследования следует проводить не реже 1 раза в 6 мес.
Следует предупредить женщину, что гормональные контрацептивы не предохраняют от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем.
Влияние на способность управлять автомобилем или выполнять работы, требующие повышенной скорости физических и психических реакций. Не выявлено.
G03AA12 Дроспиренон + этинилэстрадиол
- Z30 Наблюдение за применением противозачаточных средств
- Z30.0 Общие советы и консультации по контрацепции
Источники:
- https://www.drugs.com/mtm/drospirenone-and-ethinyl-estradiol.html
- https://pubmed.ncbi.nlm.nih.gov/?term=yasmin
Доступно в странах
Найти в стране:
А
Б
В
Г
Д
Е
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ч
Ш
Э
Ю
Я
Показания:
Ясмин контрацептив назначают в нескольких случаях: предотвращение нежелательной беременности; сбой в менструальном цикле; угревая сыпь; отечность. Гормональная контрацепция эффективна и при чрезмерном нагрубании молочных желез.
Противопоказания:
Прием таблеток Ясмин может быть противопоказан, если пациент имеет следующие заболевания: аллергия на компоненты препарата; рак молочных желез; диабет; почечная и печеночная недостаточность; беременность; ишемия сердца; высокое кровяное давление.
Побочные эффекты:
Первые дни после приема контрацептива Ясмин открывается кровотечение — псевдоменструация. При приеме препарат Ясмин, цикл длится нормально, без осложнений и болей в животе. Часто этот медикамент принимают для контроля над менструальным циклом, в частности, для уменьшения болезненных ощущений. Не следует прекращать курс приема препарата после начала кровяных выделений во избежание серьезных осложнений в матке. Среди отрицательных побочных эффектов наблюдаются следующие: головокружение; тошнота; рвота; боли в животе; отдышка; сильный отхаркивающий кашель с присутствием крови (рекомендуется сразу вызвать скорую помощь); бессонница; аллергические реакции.
Способ применения и дозировка:
Таблетки Ясмин употребляют один раз в сутки по 1 таблетке строго в одно и то же время. При пропускании или нарушении приема дозы препарата возможны негативные для организма последствия. По истечению 21 дня нужно сделать 7-дневный перерыв, после которого повторить стандартную дозировку. Во время перерыва начинаются кровяные выделения — нормальная реакция организма. Контрацепция восстанавливает регулярный менструальный цикл.
Информация о цене, технических характеристиках, комплекте поставки, стране изготовления, внешнем виде и цвете товара носит справочный характер и основывается на последних доступных к моменту публикации сведениях.